脂肪间充质干细胞来源外泌体对阿霉素所致心肌损伤的影响及其分子机制
2021-04-23陈睿马骞傅建芳张婧朱军王伟东王旁
陈睿,马骞,傅建芳,张婧,朱军,王伟东,王旁
空军军医大学西京医院,西安710032
阿霉素是治疗肿瘤的常用药,但会引起比较严重的心脏不良反应,导致其应用受到限制[1-2]。外泌体是细胞分泌的一种直径为30~200 nm 的脂质双分子膜结构囊泡,在多种疾病的发生和治疗过程中发挥重要作用。研究表明,间充质干细胞(MSCs)来源外泌体在治疗炎症和退行性疾病方面均具有良好疗效[3]。骨髓间充质干细胞(BMSCs)来源外泌体被证实能够减小心肌梗死面积,改善心功能[4]。脂肪间充质干细胞(mADSC)的生物学特性及免疫标志物与 BMSCs 基本相似[5],因此,mADSC 来源外泌体可能发挥与BMSCs 外泌体相似的作用,但目前关于mADSC 来源外泌体对阿霉素所致心肌损伤的影响及其机制鲜有报道。为此,我们于2019 年2 月—2020年5月进行了如下研究。
1 材料与方法
1.1 材料 实验动物:雄性C57 小鼠30 只,6~8 周龄,均购自空军军医大学动物实验中心,于SPF条件下饲养,动物实验操作均符合空军军医大学动物实验管理委员会制定标准。细胞:心肌细胞H9C2 购自陕西帆昌生物科技有限公司。主要试剂:阿霉素购自上海源叶生物科技有限公司;α-MEM 培养基、胎牛血清、胰酶、Ⅰ型胶原酶均购自美国Gibco 公司,双抗购自美国Thermo Scientific 公司,外泌体提取试剂盒购自美国System Biosciences 公司,TUNEL检测试剂盒购自杭州碧云天生物科技有限公司,DiI染料购自南京建成生物技术有限公司;外泌体表面标志物 CD81、TSG101、GAPDH 及高尔基体标记物GM130 均购自美国 CST 公司,mADSC 表面标志物CD29、CD90 和粒细胞表面标志物 CD34、CD45 抗体均购自英国Abcam公司;QIAQuick PCR纯化试剂盒、miRNA qRT-PCR 试剂盒、miR-21a-5p 引物均购自广州锐博生物技术有限公司。主要仪器:Western blot⁃ting 电泳仪及相关成像设备购自美国Bio-Rad 公司,激光共聚焦扫描系统购自日本Olympus 公司,Vevo 2100 超声成像仪购自加拿大Visual Sonics 公司。
1.2 外泌体的提取、培养及鉴定
1.2.1 mADSC 的提取与培养 取雄性C57 小鼠3只,无菌条件下采集皮下脂肪组织,用眼科剪剪碎至糜状,置于无菌离心管中。加入0.5%Ⅰ型胶原酶,避光消化45 min,加入等体积α-MEM 培养基终止消化。将上述混合物通过200 目无菌钢筛过滤,收集过滤物于无菌离心管中,1 500 g 离心5 min、离心半径13.5 cm。弃上清后加入等体积红细胞裂解液,冰上裂解5 min。在4 ℃环境下离心后,加入α-MEM完全培养基,将细胞悬液铺于培养皿中。24 h 后换液去除未贴壁细胞,待生长融合度达80%后,按照1∶2 比例进行传代。光镜下观察显示提取的细胞形态为长梭形,在脂肪诱导培养基中生长可诱导为脂肪细胞,油红染色可见脂滴形成;在成骨诱导培养基中生长可诱导为骨细胞,茜素红染色可见钙结节;流式细胞术检测结果显示提取的细胞表面高表达CD29、CD90,不表达CD34、CD45(图1);提示成功获取并培养mADSC。
1.2.2 mADSC来源外泌体的提取与鉴定 取3~4代mADSC,待其生长融合度达80%后,将完全培养基更换为无血清α-MEM 培养基,48 h 后收集细胞上清。按说明书加入适当体积的ExoQuick-TC 外泌体提取试剂,4 ℃条件下孵育过夜,1 500 g 离心30 min、离心半径15 cm,分离外泌体。磷钨酸染色后透射电镜下显示其为圆形或椭圆形,包膜完整(图2);粒径分析技术检测其直径为30~220 nm(图3),与 HESSVIK 等[6]检测结果一致;Western blotting 法检测结果显示其表达TSG101、CD81、GAPDH 蛋白,不表达高尔基体相关蛋白GM130(图4);提示成功提取mADSC 来源外泌体。将分离后的外泌体后用1 mL无菌PBS溶解,-80 ℃冰箱保存备用。
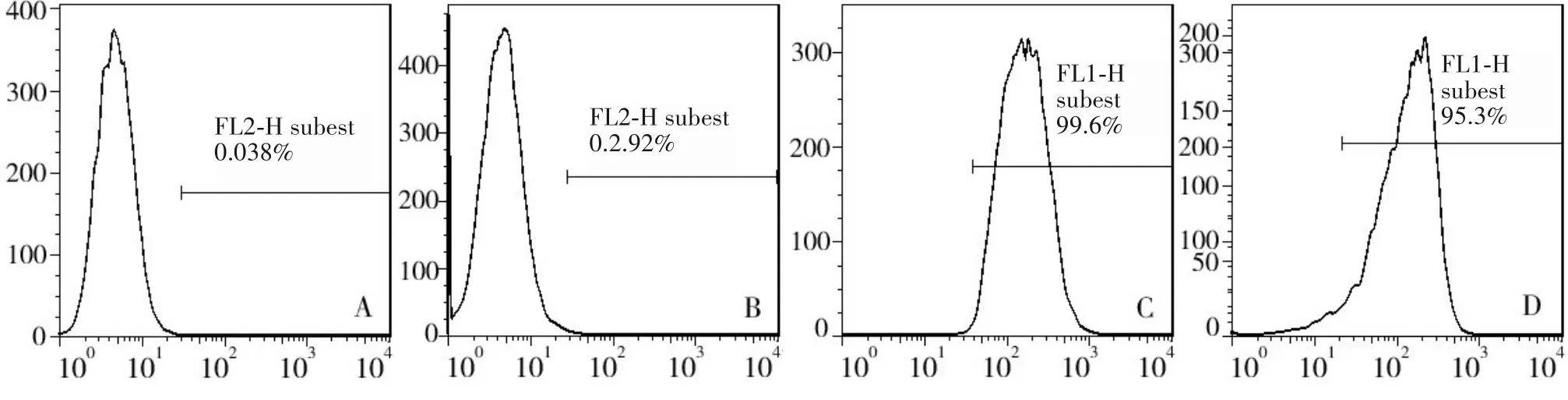
图1 提取细胞的表面标志物表达情况(流式细胞术)
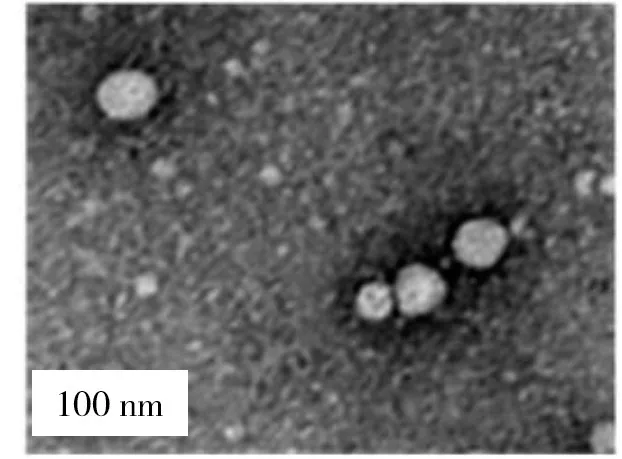
图2 mADSC来源外泌体形态鉴定结果(透射电镜)
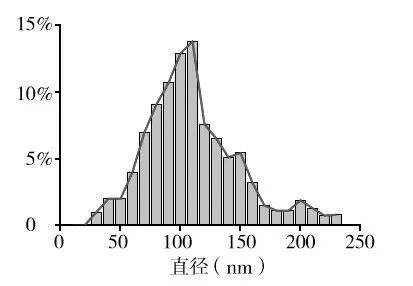
图3 mADSC来源外泌体粒径分析鉴定结果

图4 mADSC来源外泌体表面标志物鉴定结果
1.2.3 血浆外泌体的提取与鉴定 取雄性C57 小鼠血浆1 mL,根据说明书加入适当体积ExoQuick-TC外泌体提取试剂,4 ℃条件孵育过夜,1 500 g离心30 min、离心半径13.5 cm,参照1.2.2 的方法进行鉴定,证实为外泌体。
1.3 心肌细胞、心脏组织对mADSC 来源外泌体的摄取情况观察 将mADSC 来源外泌体重悬于无菌PBS 中,加入 5 µmol/L DiI 孵育 10 min。洗涤 DiI 标记的外泌体,重悬于无菌PBS 中漂洗3 次,去除游离的DiI 和其他杂质。①心肌细胞摄取情况观察:将H9C2细胞培养于37 ℃、5%CO2的细胞培养孵箱中,使用DMEM+10%胎牛血清+1%双抗进行培养。待生长融合度达80%后,按照1∶2比例传代。将DiI标记的外泌体加入正常传代培养的H9C2 细胞,并在无血清条件下以2µg/mL 工作浓度孵育3 h,倒置显微镜观察显示H9C2 细胞出现红色荧光。②心脏组织摄取情况观察:取C57 小鼠2 只,尾静脉注射DiI标记的外泌体(1 µg/µL)20 µL,12 h 后取小鼠心脏进行冰冻切片,共聚焦显微镜观察显示小鼠心脏组织出现红色荧光。以上结果提示,mADSC 来源外泌体可被H9C2细胞及小鼠心脏组织摄取。
1.4 mADSC 来源外泌体对阿霉素所致心肌细胞损伤影响的观察
1.4.1 细胞分组处理 将H9C2细胞按1.3的方法培养于10 cm2培养皿中,待生长融合度达80%后,分为损伤1组、处理1组和对照1组。损伤1组、处理1组均加入无菌PBS稀释的阿霉素(终浓度为1µmol/L),处理1组同时加入终浓度为2µg/mL的mADSC来源外泌体,对照1组加入等体积的PBS,作用24 h后收集细胞。
1.4.2 细胞凋亡能力观察 ①TUNEL 染色法:取各组细胞爬片,4%多聚甲醛固定10 min 后,PBS 漂洗3 次。配置0.5% Triton 溶液,在细胞爬片中滴入适量体积 Triton 溶液,10 min 后用 PBS 漂洗 3 次。按说明书将TUNEL 染色试剂盒中的A、B 液进行混合,避光条件下将混合液滴加到细胞爬片上,37 ℃条件下孵育60 min。将细胞爬片用PBS 漂洗后,使用共聚焦显微镜观察并对凋亡细胞进行计数。②流式细胞术:取各组细胞,消化后收集细胞,将1×105个细胞重悬于200µL Binding Buffer中。加入0.5 mg/mL PI溶 液 4 µL 和 Annexin V-FITC 溶 液 2 µL(Annexin V-FITC 最大激发光为488 nm、发射光为520 nm,PI最大激发光为535 nm、发射光为617 nm),室温避光孵育15 min,使用流式细胞仪检测细胞凋亡率。
1.5 mADSC 来源外泌体对阿霉素所致小鼠心肌损伤影响的观察
1.5.1 阿霉素心肌损伤动物模型建立及分组处理 取雄性C57小鼠18只,随机分为损伤2组、处理2 组和对照 2 组,每组 6 只。损伤 2 组与处理 2 组尾静脉注射阿霉素10 mg/kg,处理2组同时尾静脉注射mADSC来源外泌体20µL(浓度为1µg/µL),对照组尾静脉注射等体积生理盐水;1次/周,连续4周。
1.5.2 心肌组织细胞凋亡情况观察 采用TUNEL染色法。各组处理4周后分别取3只小鼠,处死后取出心脏,用刀片单向切割成3~4 mm2大小的组织块,进行常规固定、脱水透明、浸蜡、包埋,4~6 µm厚度切片。4%多聚甲醛固定10 min,PBS漂洗3次。参照1.4.2 采用TUNEL 染色对凋亡细胞进行计数,采用流式细胞术检测细胞凋亡率。
1.5.3 心脏纤维化情况观察 采用Masson 染色。将1.5.2 获取的心脏切片脱蜡至水,Weiger 铁苏木素染5~10 min,PBS 漂洗后5.1%盐酸乙醇分化;流水冲洗后丽春红酸性品红液染5~10 min,蒸馏水稍冲洗,1%磷钼酸水溶液处理约5 min;苯胺蓝液或绿液复染5 min,11.1%醋酸处理1 min,95%乙醇脱水多次;无水乙醇脱水,Xylenes 透明,中性树胶封片。判读结果,胶原纤维、黏液、软骨染色呈蓝色,细胞质、肌肉、纤维素、红细胞染色呈红色,细胞核染色呈蓝黑色,记录三组染色情况并计算胶原纤维占心脏面积的百分比,简称纤维化比例。
1.5.4 左心室射血分数(LVEF)测量 各组处理4周后分别取3 只小鼠,2.5%~3.0%异氟烷麻醉,使用配备有13~24 MHz传感器的Vevo 2100超声成像仪进行检测,在乳头肌中段水平进行二维短轴M 型超声心动图检查,测量LVEF。
1.6 小鼠血浆外泌体与mADSC 来源外泌体中miR-21a-5p 表达检测 采用实时荧光定量PCR 法。将血浆外泌体与mADSC 来源外泌体重悬于250µL PBS 中,并溶解于 750 µL TRIzol 试剂中,提取总RNA。在 RNA 沉淀过程中添加 GlycoBlue 5 µL,通过Agilent 2100 生物分析仪测量总RNA。使用QIA⁃Quick PCR 纯化试剂盒(Qiagen)进行纯化,miRNA qRT-PCR试剂盒检测miR-21a-5p表达。
1.7 miR-21a-5p 作用靶点的 GO 功能、KEGG 通路富 集 分 析 利 用“clusterProfiler”“enrichplot”“gg⁃plot2”软件包进行基因本体(GO)功能和京都基因与基因组百科全书(KEGG)通路富集分析。GO 功能富集分析主要包括生物学过程(BP)、细胞组分(CC)和分子功能(MF),基于GO 数据库进行显著性分析。KEGG 通路富集分析是依据KEGG 数据库对差异的基因进行通路显著性分析。
1.8 统计学方法 采用SPSS21.0、R3.63 软件和GraphPad Prism7 统计软件。计量资料以±s表示,多组间比较采用方差分析,两组间比较和组内比较分别采用成组t检验和配对t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 损伤1组、处理1组和对照1组细胞凋亡情况比较 损伤1组、处理1组和对照1组细胞凋亡数和细胞凋亡率均逐渐降低,组间两两比较P均<0.05。见表1。
表1 各组细胞凋亡数及凋亡率比较(±s)

表1 各组细胞凋亡数及凋亡率比较(±s)
注:与对照1组比较,*P<0.05;与处理1组比较,#P<0.05。
组别损伤1组处理1组对照1组细胞凋亡数(个)103±5*#44±4*13±3细胞凋亡率(%)23.2±0.1*#8.6±0.3*2.2±0.2
2.2 损伤2 组、处理2 组和对照2 组小鼠心肌组织细胞凋亡情况比较 损伤2 组、处理2 组和对照2组小鼠心肌组织细胞凋亡数和细胞凋亡率均依次降低,组间两两比较P均<0.05。见表2。

表2 损伤2组、处理2组和对照2组小鼠心肌组织细胞凋亡数及凋亡率比较(-x± s)
2.3 损伤2 组、处理2 组和对照2 组小鼠心脏纤维化情况、LVEF 比较 损伤2 组、处理2 组和对照2组小鼠心肌组织纤维化比例依次降低、LVEF 依次升高,组间两两比较P均<0.05。见表3。
表3 损伤2组、处理2组和对照2组小鼠心肌组织纤维化比例及LVEF比较(%,±s)

表3 损伤2组、处理2组和对照2组小鼠心肌组织纤维化比例及LVEF比较(%,±s)
注:与对照2组比较,*P<0.05;与处理2组比较,#P<0.05。
组别损伤2组处理2组对照2组n 6 6 6纤维化比例11.5±3.2*#5.1±0.3*2.3±0.1 LVEF 0.39±0.04*#0.60±0.03*0.79±0.03
2.4 小鼠血浆外泌体与mADSC来源外泌体中miR-21a-5p表达比较 小鼠血浆外泌体与mADSC来源外泌体中miR-21a-5p 相对表达量分别为1.05±0.01、5.41± 0.05,二者比较P<0.05。
2.5 miR-21a-5p 的 GO 功能、KEGG 通路富集分析结果 GO 功能分析结果显示,miR-21a-5p主要富集在输尿管芽形成、泛素结合酶复合物、突触囊泡聚集、窦房结细胞与心房肌细胞的通讯、回旋处连接、核糖体拆卸、回旋处大亚基结合、肺形态发生因子参与的上皮细胞增殖调控、rDNA 连接、K6 相关蛋白泛素化等通路。KEGG 通路富集分析结果显示,miR-21a-5p 可调控多种信号通路,如DNA 损伤修复、mTOR 信号通路、血管平滑肌舒张相关信号通路、脂肪酸代谢相关通路等。
3 讨论
阿霉素是蒽环类药物的代表性药物,也是治疗多种癌症的首选药物之一,但其临床应用受到剂量依赖性以及延迟性心脏毒性的限制。阿霉素导致的心脏损伤往往为不可逆性心肌损伤,主要表现为恶性心律失常、扩张性心肌病、心功能不全以及心力衰竭等[1-2]。阿霉素引起心肌损伤机制极为复杂,其主要机制包括:①阿霉素与NADH 脱氢酶和细胞色素P-450 还原酶发生氧化还原反应,产生大量活性氧(ROS),ROS 蓄积导致心肌损伤[7-8];②阿霉素与DNA 相互作用,并抑制拓扑异构酶Ⅱβ(Top2β)生成,从而抑制DNA 解旋,并最终阻止蛋白质合成,从而导致心肌细胞凋亡[9];③阿霉素可引起心肌细胞中铁代谢异常,导致心肌细胞中线粒体DNA 损伤,从而导致心肌细胞凋亡[10]。尽管关于阿霉素导致心肌损伤的分子机制研究较多,但相关靶点药物及治疗策略仍未在临床上进行推广使用。因此,探究一种新型心肌保护策略对于减轻阿霉素所致心肌损伤至关重要。
既往研究表明,MSCs 是一种多能祖细胞,可以通过诱导心肌细胞分化、组织修复、抗炎和免疫抑制等多种机制来减轻动物心肌损伤和改善患者心脏功能[11-12]。但是,宿主移植的MSC 生存率低,只有一小部分移植MSC 在其可能的靶组织中存活,这极大地限制了MSC的临床应用。尽管存在这些限制,但细胞具有旁分泌作用,移植后存活的MSC在某些情况下仍能正常工作。MSC可以分泌大量生长因子、细胞因子和趋化因子,这些因子可以促进心肌细胞增殖、减少细胞凋亡、改善缺血性微环境并动员内源性心脏干细胞[13]。同样,MSC可以通过分泌外泌体来调节靶细胞的生物学功能。既往研究表明,BMSCs来源外泌体可促进心肌缺血模型中的心肌细胞存活并延缓心肌结构重塑[13]。但 BMSCs 获取困难,增殖能力较弱,而mADSC则容易获取且其增殖能力强于BMSCs。
外泌体功能的发挥需要细胞和组织的摄取,从而释放活性物质,对相应靶点进行干预。为使得外泌体的摄取功能可视化,首先需要对外泌体进行标记。DiI是一种亲脂性的荧光染料,可以用来对细胞膜和其他脂溶性生物结构染色,常用于外泌体标记。当被绿光激发并结合到细胞膜中时,DiI会发出强红色荧光,并且不会破坏膜的特性。本研究结果显示,小鼠mADSC来源外泌体可以减轻阿霉素所致H9C2细胞和小鼠心肌细胞凋亡,减轻阿霉素所致小鼠的心肌纤维化及心功能下降。
miR-21a-5p 是一种心脏保护性miRNA,而外泌体中富含miRNA,因此本研究检测了小鼠血浆外泌体与干细胞外泌体中miR-21a-5p 表达情况,验证干细胞外泌体是否通过增加miR-21a-5p 表达来保护心脏。本研究结果显示,mADSC 来源外泌体miR-21a-5p 表达显著高于血浆外泌体,推测mADSC 来源外泌体通过升高miR-21a-5p 表达而发挥心肌保护作用。利用GO 数据库可以得到目标基因在CC、MF 和BP 三个层面上主要和哪些分子功能和生物过程有关。本研究结果显示,miR-21a-5p 可调控多种信号通路,如DNA 损伤修复、mTOR 信号通路、血管平滑肌舒张相关信号通路、脂肪酸代谢相关通路等,这提示mADSC 来源外泌体可升高miR-21a-5p表达并通过调控多种信号转导通路来保护心肌。此外,mADSC 来源外泌体中核酸及蛋白含量丰富,其他蛋白、miRNA 及IncRNA 是否在阿霉素所致的心脏损伤中发挥保护作用尚未可知。因此,mAD⁃SC 来源外泌体中的其他成分还有待进一步检测及研究。
综上所述,mADSC 来源外泌体可减少阿霉素所致心肌细胞凋亡,减轻阿霉素所致小鼠心肌纤维化并提高其心功能,其机制可能与升高miR-21a-5p 表达进而调控多种信号通路有关。尽管mADSC来源外泌体能够发挥心肌保护作用,但其在临床上的应用还面临重大挑战。外泌体通过不同注射途径注射进入小鼠后的主要富集器官各不相同,静脉注射外泌体主要富集于肝脏、脾脏以及肺脏,而腹腔注射外泌体主要富集于腹腔脏器[14]。由于心脏内血流速度快且单核吞噬细胞含量较低,故外泌体在心脏内的浓度较低,低剂量外泌体无法起到应有的保护作用,而增加外泌体浓度则无法排除其对肝脏、脾脏等其他器官的影响[15]。因此,如何提高外泌体在心脏内的富集浓度是解决外泌体治疗心脏疾病的关键问题。
