甘松新酮对H9C2心肌细胞低氧损伤的作用及其机制
2021-04-23李红艳赵思涵梅显运李旭光孙芳云
李红艳, 赵思涵, 梅显运, 陈 政, 李旭光, 孙芳云
(西藏民族大学医学院∥西藏高原相关疾病分子遗传机制与干预研究省级重点实验室,咸阳 712082)
缺血性心脏病(ischemic heart disease, IHD)已成为世界上死亡率较高疾病之一,主要是由冠状动脉狭窄致心肌缺血引起的[1]. 而心肌缺血造成的氧含量降低是IHD发病的重要原因之一. 虽有研究表明急性低氧能提高细胞存活率,促进细胞对低氧环境的适应,但慢性或极端低氧却引起细胞死亡. 同时,心肌低氧常常伴有氧自由基增加、钙超载、细胞凋亡和炎症反应等现象. 因此,保护心肌细胞免受低氧损伤是降低IHD风险的有效策略.
自噬是一个复杂的细胞分解代谢过程[2]. 通常自噬可以保护细胞免受各种破坏性因素的影响,如低氧或饥饿,以维持细胞内稳态[3]. 同时,自噬对于维持心脏正常功能至关重要[4]. 在缺血应激下,自噬被激活以保护心肌细胞免受缺血或缺血/再灌注损伤[5]. 而严重缺血时,心脏过度自噬会促进细胞死亡并恶化心脏功能[6].
甘松新酮(Nardosinone,Nar)是一种从甘松提取而来的倍半萜类化合物,已将其含量作为衡量甘松品质定性的主要标准. 研究发现,Nar的药理作用主要有镇静、抗癫痫、抗抑郁、促神经生长、改善认知能力、保护心肌细胞、降血压、抑菌与抗疟、抗肿瘤等[7]. Nar可通过激活蛋白激酶A(Protein Kinase A, PKA)促进小鼠胚胎神经干细胞的增殖、迁移和选择性分化;通过细胞外信号调节激酶(Extracellular Signal-Regulated Kinase, ERK)减少原代培养神经元因缺氧缺葡萄糖诱导的损伤,提高细胞活力;促进神经生长因子诱导的神经生长等[8]. Nar通过抑制核因子-κB(Nuclear Factor-κB, NF-κB)和丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase, MAPK)途径治疗相关神经炎症疾病[9]. 另外,Nar可抑制NF-κB配体诱导的破骨细胞生成,减轻脂多糖诱导牙槽骨吸收等. 在心血管研究中发现,Nar可阻断SD大鼠心室肌细胞钠离子通道电流或通过影响cAMP-PKA信号通路,抑制心律失常大鼠心肌细胞钙超载,从而发挥抗心律失常作用,以及通过靶向磷脂酰肌醇-3激酶(Phosphatidylinositol-3-Kinase, PI3K)/Akt和MEK/ERK信号通路,减轻血管紧张素Ⅱ诱导的H9C2细胞肥大等.
尽管Nar在神经生长、心律失常和心肌肥大中有着重要作用,但Nar在心肌低氧损伤中是否有作用及该过程是否由自噬介导还未见报道. 因此,本研究利用氯化钴(CoCl2)模拟H9C2心肌细胞低氧,探讨Nar干预的作用及机制.
1 材料与方法
1.1 试剂、药品和仪器
甘松新酮(SN8280,北京索莱宝,纯度≥98%);氯化钴(Sigma);3-MA(Selleckchem);DMEM高糖培养基和胰蛋白酶(Gibco);胎牛血清(杭州四季青生物工程研究所);CCK-8试剂盒(北京同仁);乳酸脱氢酶(LDH)、肌酸激酶(CK)、丙二醛(MDA)和超氧化物歧化酶(SOD)检测试剂盒(南京建成生物工程研究院);Annexin V-FITC/PI凋亡检测试剂盒(上海贝博生物);RIPA裂解液(碧云天生物技术研究所);BCA蛋白浓度测定试剂盒(西安晶彩生物科技有限公司);一抗Caspase-3、β-actin、Bax、Bcl-2、LC3B、Beclin-1、P62和羊抗鼠二抗(ImmunoWay公司);二氧化碳培养箱(美国Thermo公司);分光光度计(上海精密科学仪器有限公司);低温高速离心机(德国Eppendorf公司);流式细胞仪(美国BD公司);蛋白电泳与转移仪和凝胶成像系统(美国Bio-Rad公司)等.
1.2 细胞培养
H9C2细胞系购自中国科学院上海细胞库. 细胞放置在相对湿度95%、5% CO2、37 ℃培养箱中,以DMEM高糖培养基并补加10%胎牛血清和1%青链霉素培养. 每隔3 d进行一次细胞传代,选用对数生长期细胞进行实验.
1.3 细胞活性检测
细胞以5×103个/孔的密度接种在96孔板中,24 h后,分别以CoCl2(0、50、100、200、500、1 000 μmol/L)孵育24 h. 根据CCK-8试剂盒说明测定细胞活力. 后续实验选用CoCl2半最大效应浓度(EC50)500 μmol/L进行细胞低氧造模. 另外,用Nar(0、10、50、100、200 μmol/L)预处理细胞24 h后,再用CoCl2(EC50)作用24 h,CCK-8检测细胞活力.
1.4 流式细胞仪测细胞凋亡
细胞以5×104个/孔的密度接种在6孔板中,24 h后,分为对照组(0.1% DMSO作用48 h)、CoCl2组(500 μmol/L CoCl2作用24 h)、Nar组(50 μmol/L Nar作用24 h)和Nar+CoCl2组(Nar预作用24 h后,CoCl2再作用24 h). 根据Annexin V-FITC/PI试剂盒说明处理细胞,通过流式细胞仪检测细胞凋亡.
1.5 Western Blot
细胞以5×104个/孔的密度接种在6孔板中,24 h后,分为对照组(0.1% DMSO)、CoCl2组(500 μmol/L)、Nar组(50 μmol/L)、Nar+CoCl2组和3-MA+Nar+CoCl2组(5 mmol/L 3MA预处理3 h,随后同Nar+CoCl2组). 在冰上以RIPA裂解缓冲液裂解细胞,提取总蛋白. 用BCA蛋白检测试剂盒测定蛋白浓度. SDS-PAGE凝胶电泳分离蛋白. 电泳完成后,以湿转的方式将蛋白转移到PVDF膜上. 室温下以5%脱脂奶粉封闭2 h,再一抗4 ℃孵育过夜. 根据抗体说明进行稀释. 用到的一抗有:Caspase-3、β-actin、Bax、Bcl-2、LC3B、Beclin-1和P62. TBST洗3次(室温,摇床上缓慢晃动),每次10 min. 二抗室温孵育2 h, TBST洗3遍(同上). 用Bio-Rad分光成像系统曝光.
1.6 氧化应激相关指标检测
细胞以5×104个/孔的密度接种在6孔板中,24 h后,细胞分组同“1.5”. 利用分光光度计测细胞上清液中MDA浓度及SOD、CK和LDH活性.
1.7 统计学分析
每个实验组至少进行3个独立实验. 数据采用Spss19.0统计软件进行分析,所有数据均以平均值±标准差的形式呈现. 采用t检验对2组间进行比较,多组间的比较采用单因素方差分析.
2 结果与分析
2.1 Nar对CoCl2诱导的H9C2细胞损伤的影响
不同浓度的CoCl2作用H9C2细胞24 h后(图1A),细胞活力以剂量依赖方式显著降低,500 μmol/L的CoCl2可抑制约50% H9C2细胞生长,故选此浓度造H9C2低氧模型. 不同浓度的Nar预作用H9C2细胞24 h,再以500 μmol/L CoCl2孵育24 h. 结果显示:与CoCl2组比,50、100、200 μmol/L Nar预作用均可提高细胞活力,而50 μmol/L Nar作用最显著(P<0.01)(图1B),因此后续实验以50 μmol/L Nar进行分析. 同时,与对照组(细胞不做任何处理组)相比,CoCl2(500 μmol/L)可显著减少细胞数. 而50 μmol/L Nar预干预24 h,可明显减轻CoCl2造成的细胞生长抑制现象(图1C).

图1 Nar对CoCl2诱导H9C2细胞损伤的影响
2.2 Nar对CoCl2诱导H9C2细胞凋亡的影响
流式细胞仪检测细胞凋亡发现:CoCl2可引起H9C2细胞凋亡,而Nar明显减轻CoCl2诱导的细胞凋亡(图2A、B). 与对照组比较,CoCl2组Caspase-3蛋白表达升高,Bcl-2/Bax相对比率降低. 而Nar预作用后,与CoCl2组相比,Caspase-3蛋白表达降低,Bcl-2/Bax相对比率升高(P<0.01)(图2C~E). 表明Nar对CoCl2诱导的细胞凋亡有抑制作用.
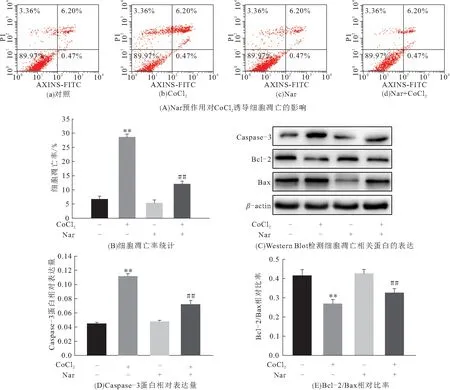
图2 Nar对CoCl2诱导细胞凋亡的影响
2.3 Nar对CoCl2诱导H9C2细胞损伤与自噬的关系
为了确定自噬是否介导了Nar对H9C2细胞低氧损伤的保护过程,Western Blot检测自噬相关蛋白Beclin-1、LC3II/LC3I和P62的表达. 与对照组相比(图3A),CoCl2组LC3II/LC3I、P62和Beclin-1蛋白表达均增加,这与先前研究结果一致[10]. 而Nar组LC3II/LC3I和Beclin-1蛋白表达显著升高,P62下降. 与CoCl2组相比,Nar+CoCl2组的LC3II/LC3I、Beclin-1和P62表达均降低. 而3-MA预处理可逆转Nar诱导的LC3II/LC3I和Beclin-1蛋白表达增加及P62蛋白表达降低(图3B). 这些结果表明:Nar通过激活自噬减轻了CoCl2诱导的细胞损伤. CoCl2也激活了自噬,但其对H9C2细胞的作用与Nar明显不同,具体机制有待进一步研究.
2.4 Nar抑制CoCl2诱导H9C2细胞凋亡与自噬的关系
为进一步探讨Nar激活自噬与CoCl2诱导H9C2细胞凋亡的关系,以3-MA预作用3 h,Western Blot检测凋亡相关蛋白表达. 结果表明:3-MA预作用组与Nar+CoCl2组相比,Caspase-3蛋白表达升高而Bcl-2/Bax降低,表明3-MA逆转了Nar的抗凋亡作用(图4A~C). 说明Nar以激活自噬方式对抗CoCl2诱导的凋亡.

图3 Nar对CoCl2诱导H9C2细胞损伤与自噬的关系
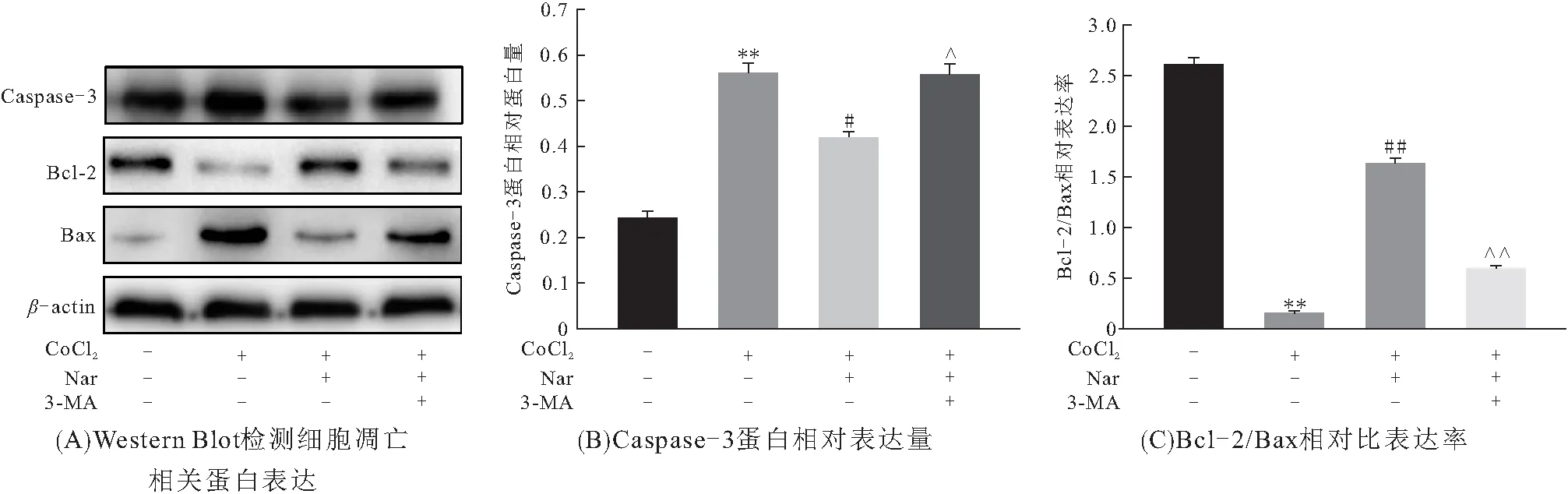
图4 Nar抑制CoCl2诱导H9C2细胞凋亡与自噬的关系
注:与对照组比较,*表示P<0.05,**表示P<0.01;与CoCl2组比较,#表示P<0.05,##表示P<0.01;与Nar+CoCl2组比较,∧表示P<0.05,∧∧表示P<0.01 . 图5同.
2.5 Nar减轻CoCl2诱导H9C2细胞凋亡与氧化应激的关系
氧自由基的升高是低氧诱发心肌损伤的重要原因之一. 过量的氧自由基会攻击生物膜诱发脂质过氧化,致使心肌中MDA含量增加,影响脂质的生物学功能. 同时心肌损伤后会引起细胞膜结合酶的泄露,如血清中CK和LDH水平的升高,最终引起细胞凋亡. 与CoCl2组相比(图5A~D),Nar预处理显著提高H9C2细胞SOD水平,降低CK、MDA和LDH水平. 而3-MA预作用降低SOD水平,提高CK、MDA和LDH水平,从而逆转了Nar对CoCl2诱导细胞损伤的抗氧化作用. 结果表明:Nar激活自噬减轻了CoCl2对H9C2细胞的氧化损伤.

图5 Nar减轻CoCl2诱导H9C2细胞凋亡与氧化应激的关系
3 讨论
CoCl2因其二价钴离子可以取代脯氨酰羟化酶辅因子(二价铁离子),已广泛用于包括H9C2细胞在内的各种细胞系模拟低氧条件. 本研究中CoCl2(500 μmol/L)对H9C2细胞生长有明显抑制作用,而Nar(50 μmol/L)预作用可减轻CoCl2(500 μmol/L)引起的细胞生长抑制现象. LI等[8]也报道Nar(50和100 μmol/L)能保护因低氧和缺糖引起的神经元损伤,并提高细胞活力. LI等[11]发现Nar有促神经干细胞增殖、增加细胞迁移和分化的作用. 这些结果提示:Nar可促进H9C2细胞低氧损伤条件下的生长.
Bcl-2家族是凋亡过程的主要调节因子,包括促凋亡蛋白如Bax和抗凋亡蛋白如Bcl-2[12-13]. Bcl-2/Bax决定了细胞是增殖还是凋亡[14]. 此外,Caspase-3是凋亡过程的关键执行者[15]. 本研究发现,Nar可降低CoCl2诱导的H9C2细胞凋亡,并减少Caspase-3蛋白表达,使Bcl/Bax比降升高,表明Nar通过抑制细胞凋亡减轻了CoCl2诱导的H9C2细胞损伤.
心肌细胞在缺血状态下因缺乏足够的葡萄糖、氨基酸和能量等而导致自噬被激活[16]. 正常生理活动中,自噬通过调节细胞代谢以适应营养供应和清除受损细胞器,从而起到维持细胞内稳态的作用[17]. 但在极端条件下,如慢性或极度低氧,激活自噬会引发细胞凋亡[18]. 在各种自噬相关基因中,Beclin-1和LC3B在协调自噬的细胞保护功能中有着重要作用,二者同时可对抗凋亡[19]. LC3B由LC3I和LC3II组成,自噬激活后LC3I转化为LC3II. 因此LC3II/LC3I反应了自噬体的形成程度[20]. Beclin-1表达在自噬体形成的初始阶段[21]. P62有向自噬体传递泛素结合蛋白复合物,并以自噬体溶酶体融合机制促进降解的作用,故自噬激活后,细胞内P62水平降低[17]. 本研究Western Blot结果显示:Nar和CoCl2均可激活自噬,但作用机制不同. CoCl2诱导细胞凋亡可能增加了自噬体形成通量,而不是降低清除率. Nar激活自噬可能增加了损伤细胞器的清除,从而对CoCl2诱导的H9C2细胞低氧损伤起保护作用. 另有研究发现,缺血预处理以激活自噬的形式对心脏起保护作用[22-23],且缺血预处理后,LC3II/LC3I和Beclin-1表达增加[24],与本研究中Nar作用一致. 因此,Nar可能具有保护H9C2细胞免受CoCl2诱导凋亡的低氧预处理作用,具体机制需要进一步验证. 另外,3-MA预作用明显增加了Nar+CoCl2组细胞凋亡的发生,表明Nar诱导的自噬对CoCl2造成的低氧损伤有抗凋亡作用.
SOD是细胞内抗氧化剂,有清除自由基的作用[25]. MDA是脂质过氧化的一个关键指标,可间接反应细胞的损伤程度[26-27]. 另外,CK和LDH是心肌损伤的标志物. 通常细胞上清中LDH活性增加与细胞死亡的程度相关[28],而CK可直接反应心肌受损程度[29-31]. 本研究中,CoCl2作用后引起的SOD下调,MDA、LDH和CK的上调被Nar预作用所逆转,表明Nar能改善CoCl2诱导的H9C2细胞氧化损伤,但当3-MA预作用时,SOD、MDA、LDH和CK水平接近CoCl2组水平,表明Nar以激活自噬起到抗氧化损伤的作用.
综上所述,CoCl2对H9C2细胞可造成凋亡和氧化损伤,Nar通过激活自噬对CoCl2造成的H9C2细胞损伤有促生长、抗凋亡和抗氧化作用.
