基于固相萃取-薄层色谱图像分析法鉴别糖浆掺假蜂蜜
2021-04-22张路遥陈瑞盈
张路遥,陈瑞盈,张 萌,卢 新,彭 强
(西北农林科技大学食品科学与工程学院 陕西杨凌712100)
蜂蜜是由蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经自身酿造而成的天然甜物质[1]。因蜂蜜营养丰富,具有美容养颜,帮助消化,促进伤口愈合等作用而深受消费者喜爱[2]。蜂蜜成分复杂,容易受到蜜源植物种类、蜜蜂种类、空气的温度和湿度以及蜂蜜酿造时间等多种因素的影响[3]。在利益的驱动下,有些商户及厂家向蜂蜜中掺入果葡糖浆、麦芽糖浆、玉米糖浆等廉价糖浆,以天然蜂蜜的形式投放市场,欺骗消费者以获取暴利[4]。蜂蜜掺假损害了消费者权益,严重影响了蜂蜜市场秩序。
对掺假蜂蜜的鉴别研究,一直是科研人员关注的课题。国内外已建立多种检测分析方法,如高效液相色谱法、碳稳定同位素分析法、近红外光谱法、核磁共振法、气相色谱法和差热分析法等[5-10],这些方法所需仪器昂贵,检测成本较高,不适用于地方检测机构[11]。薄层色谱法(thin layer chromatographic,TLC)常用于物质的定性鉴别和筛选,是一种低成本、快速的检测方法[12]。在糖浆生产过程中,某些抗性糊精不能被完全酶解,其成品不可避免地存在少量聚合度较高的寡糖,而这种物质在真蜂蜜中并不存在[13-14]。2015 版药典采用薄层色谱法检测蜂蜜中的寡糖[15],然而该方法分离效果不理想,影响结果判断,且需要通过肉眼观察TLC 薄层板来判断是否掺假,易造成较大的主观偏差[16]。建立经济、简便、有效的蜂蜜掺假检测方法,对维护消费者利益,保护消费者健康,规范蜂蜜市场具有重要意义。
近年来,图像分析法用于定量评价薄层色谱图,TLC 图像可由CCD 摄像机或平板扫描仪获得,再用图像分析软件进一步处理,应用较广泛的图像分析软件有Image J、Image-Pro Plus、Scion ColorDens、TLSee、JustTLC 等[17-19]。这些软件有以下功能:(1)TLC 薄层板在展开显色过程中可能会被污染,可通过去除背景噪音来校正图像;(2)通过计算TLC 薄层板上特征斑点的峰面积或灰度值来进行定量分析;(3)绘制TLC 色谱图,每个特征斑点对应一个色谱峰。研究发现TLC 扫描法与TLC图像分析法对物质的定量分析无显著差异,图像分析法具有简便、快捷等优点,能够同时分析多个样品[20-21]。陆光兴等[22]用Image J 软件定量热凝胶β-1,3-葡寡糖,该方法灵敏度高,实现了对热凝胶β-1,3-葡寡糖的定量分析,相对标准偏差仅为1%~5%,且具有较好的稳定性;Fazakas 等[23]利用图像分析软件对荧光化合物进行定量分析,比较4种图像分析软件(Sorbfil TLC、Biodit、JustTLC 和Melanie),结果发现Biodit 软件对待测物质的定量分析最准确。Tang 等[24]采用薄层色谱图像分析技术对紫锥菊中菊苣酸进行定量研究,通过检测限、标准曲线、重复性和回收率等对整个方法进行评估,结果显示:该图像分析法适用于薄层色谱的定量分析。Sakunpak 等[25]建立并验证了定量冷榨米糠油中γ-谷维素的图像分析方法,分别采用TLC图像分析法和TLC 扫描法进行定量分析,用配对t 检验比较两种定量方法所得结果。结果显示:两种方法对冷榨米糠油中γ-谷维素的定量测定具有相似的稳定性、重复性和准确性。在γ-谷维素定量测定试验中,TLC 扫描法和TLC 图像分析法之间没有任何统计上的显著差异。本试验对固相萃取和薄层色谱的条件进行优化,结合Image J和Sorbfil 图像分析软件,对蜂蜜中掺假果葡糖浆进行检验和检测。
1 材料与方法
1.1 材料与试剂
天然蜂蜜,西北大学蜂产品研究所,蜂蜜品种为洋槐蜜;市售蜂蜜,陕西杨陵超市;葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖和麦芽七糖标准品(纯度≥97%),Solarbio 公司;F60 型果葡糖浆,浙江华康药业股份有限公司;无水乙醇、乙酸乙酯、乙酸、苯胺、二苯胺、磷酸等均为国产分析纯级。
1.2 仪器与设备
AR224CN 分析天平,上海奥豪斯仪器有限公司;XW-80A 旋涡混合器,海门市其林贝尔仪器制造有限公司;Epson Perfection V19 扫描仪,P.T.印度尼西亚爱普生工业公司;RE52-86A 旋转蒸发仪,上海亚荣生化仪器厂;SHB-III 循环水式多用真空泵,郑州长城科工贸有限公司;5 μL 微量进样针,上海高鸽工贸有限公司;岛津寡糖专用固相萃取柱(200 mg 硅藻土/500 mg 活性炭/200 mg 硅藻土,6 mL);SupelcleanTM椰壳活性炭固相萃取柱(2 g,6 mL),美国Supelco 公司;Sillca gel UV254薄层板 (长×宽:20 cm×20 cm),德国Macherey-Nagel 公司;薄层色谱展开缸 (长×高:20 cm×20 cm),上海信谊仪器厂有限公司。
1.3 方法
1.3.1 麦芽七糖标准溶液的制备 精密称取葡萄糖、麦芽二糖至七糖标准品10 mg,分别加蒸馏水制成每1 mL 含10 mg 的标准贮备液。分别量取麦芽七糖贮备液100 μL,加水稀释成0.1,0.3,0.5,0.7,0.9 mg/mL 系列标准溶液(Ⅰ),1.0,2.0,3.0,4.0,5.0 mg/mL 的系列标准溶液(Ⅱ),使用前配制。
1.3.2 固相萃取前处理 称取待测蜂蜜2 g,置25 mL 烧杯中,加入10 mL 蒸馏水溶解并混合均匀。将岛津固相萃取柱用25 mL 水活化后,使上述溶液通过固相萃取柱。用25 mL 体积分数20%的乙醇溶液清洗,弃清洗液,用20 mL 体积分数50%的乙醇溶液洗脱,收集洗脱液,用旋转蒸发仪65 ℃减压浓缩至干[26]。用200 μL 蒸馏水涡旋溶解残渣,供TLC 测定用。将果葡糖浆与天然蜂蜜按质量分数20%~40%的掺假水平配制掺假样品溶液,按上述方法进行样品前处理。取水(不加蜂蜜)10 mL,按上述方法制备空白样品溶液。
1.3.3 薄层色谱法分析 用微量进样针取蜂蜜样品溶液2 μL,点样于Sillca gel UV 254 薄层板上。采用二次展开法,以乙酸-乙酸乙酯-蒸馏水(2∶2∶1.4)和乙酸-乙酸乙酯-蒸馏水(2∶2.6∶1.4)为展开剂,两次展开的展距分别为5 cm 和11 cm。展开缸加入展开剂后预平衡15 min,再放入薄层板展开,展开过的薄层板自然晾干后,喷洒苯胺-二苯胺-磷酸溶液 (1 g 二苯胺、1 mL 苯胺、5 mL 磷酸溶解于50 mL 丙酮),105 ℃加热5 min 显色[27]。
1.3.4 图像处理与分析 用Epson Perfection V19 扫描仪扫描显色后的薄层板,扫描条件为:专业模式、24 位全彩、分辨率400 dpi,图片以JPEG格式保存。使用Image J 软件对扫描得到的图片进行图像分析,将图像转换为8 位灰度图,选择400 pixels 消除背景影响,将图片转换为亮带模式。选择工具栏下矩形框,圈出七糖斑点后使用快捷键“Ctrl+M”,弹出窗口内“IntDen”列表标题下即该区域的灰度值。在工具栏中选择矩形工具并框出寡糖条带,点击“Plot Lanes”后出现寡糖条带的灰度曲线图。
使用Sorbfil TLC Videodensitometer 软件对扫描得到的图片进行图像分析,设置每条轨道等宽,背景强度设置每条线宽度3,高度30,噪声过滤设置为7,点击轨道评估,对所选择的寡糖轨道进行分析,测得寡糖对应的峰面积和比移值。
2 结果与分析
2.1 固相萃取条件的选择
2.1.1 固相萃取柱比较 参照文献[28]、[29]方法,选择活性炭填料的固相萃取柱,比较岛津萃取柱和SupelcleanTM萃取柱对寡糖的萃取效果,结果显示,在岛津萃取柱萃取后的掺假蜂蜜中观察到五糖及以上寡糖条带,而在SupelcleanTM萃取柱萃取后的掺假蜂蜜中观察不到寡糖条带,含有较多的单糖,大量存在的单糖会干扰寡糖的分析,见图1。分析认为由于SupelcleanTM萃取柱没有岛津萃取柱的填料紧实,因此洗脱速度较快,导致寡糖成分和洗脱剂不能达到洗脱平衡,不利于寡糖的解吸,不如岛津萃取柱对寡糖的富集效果好。
2.1.2 清洗剂的选择 分别称取5 份天然蜂蜜样品,每份2 g,各加入10 mL 水溶解后注入固相萃取柱,分别用25 mL 体积分数10%,15%,20%,25%和30%的乙醇溶液清洗,弃清洗液。分别用20 mL 50%乙醇溶液洗脱,收集洗脱液,65 ℃减压浓缩至干,分别向残渣中加200 μL 水复溶。按1.3.3 节方法进行TLC 展开并显色,按1.3.4 节方法扫描,用Image J 软件灰度分析得到不同清洗条件下清洗液中单糖和寡糖的灰度值,见图2。随着乙醇溶液体积分数的增大,单糖和寡糖的灰度值逐渐减小,即保留在萃取柱中的单糖和寡糖逐渐减少,说明乙醇浓度越高,对单糖和寡糖的清洗能力越强。因较高浓度的乙醇溶液可能清洗掉五糖以上寡糖,故需对不同浓度的清洗剂做进一步验证。
取质量浓度为3 mg/mL 的麦芽五糖、麦芽六糖、麦芽七糖标准品各40 μL,加水定容10 mL。平行配制5 份上述混合标准品,经固相萃取柱吸附,收集滤液,用25 mL 体积分数10%,15%,20%,25%和30%的乙醇溶液清洗,各清洗液旋蒸至干后加200 μL 水。清洗液和滤液按1.3.3 节方法进行薄层层析,按1.3.4 节方法进行灰度分析,用Image J 软件制作色谱图[24-25]。图3显示:以10%,15%,20%乙醇溶液做清洗剂时,麦芽五糖至七糖不受清洗过程的影响,可保留在萃取柱中,25%和30%乙醇溶液在清洗过程中目标寡糖被清洗掉,说明其不适合做清洗剂。由于20%乙醇溶液的洗脱能力较大并且不破坏目标寡糖,因此试验选择20%乙醇溶液作为清洗剂,清洗用量为25 mL,此条件可去除蜂蜜中大部分的单糖和二糖,见图1。
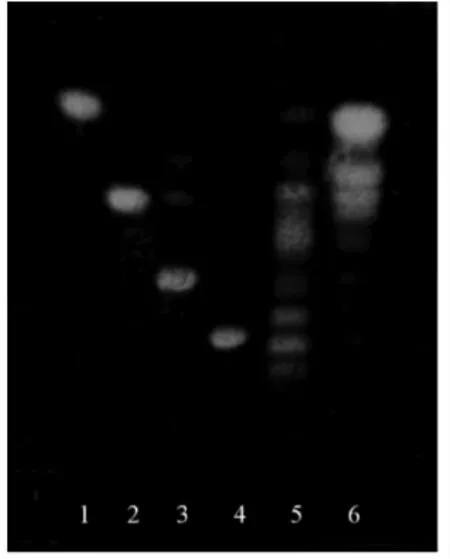
图1 萃取柱分离效果对比图Fig.1 Comparison of separation efficiency of extraction column
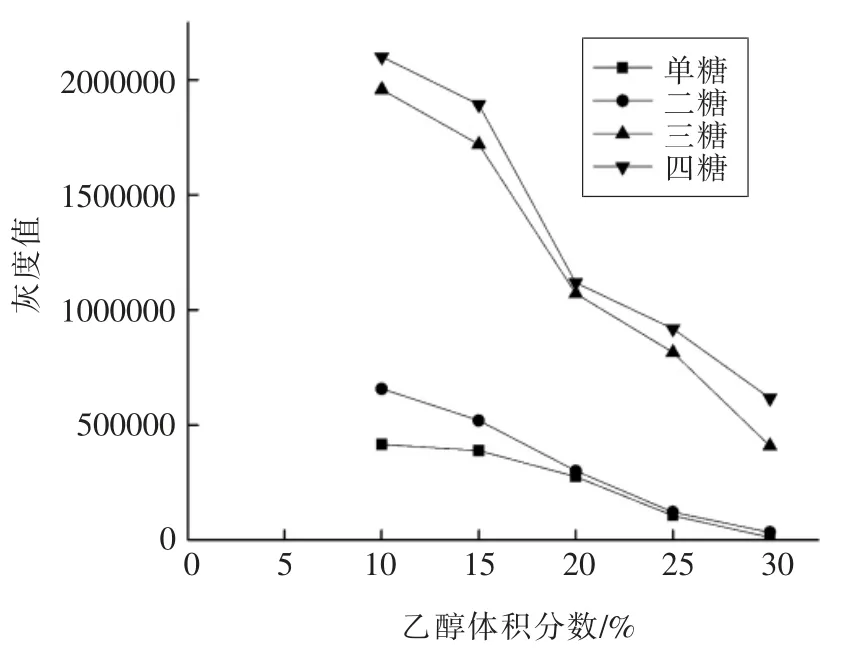
图2 不同体积分数清洗剂的清洗效果图Fig.2 Cleaning effect chart of different concentrations of cleaning agent
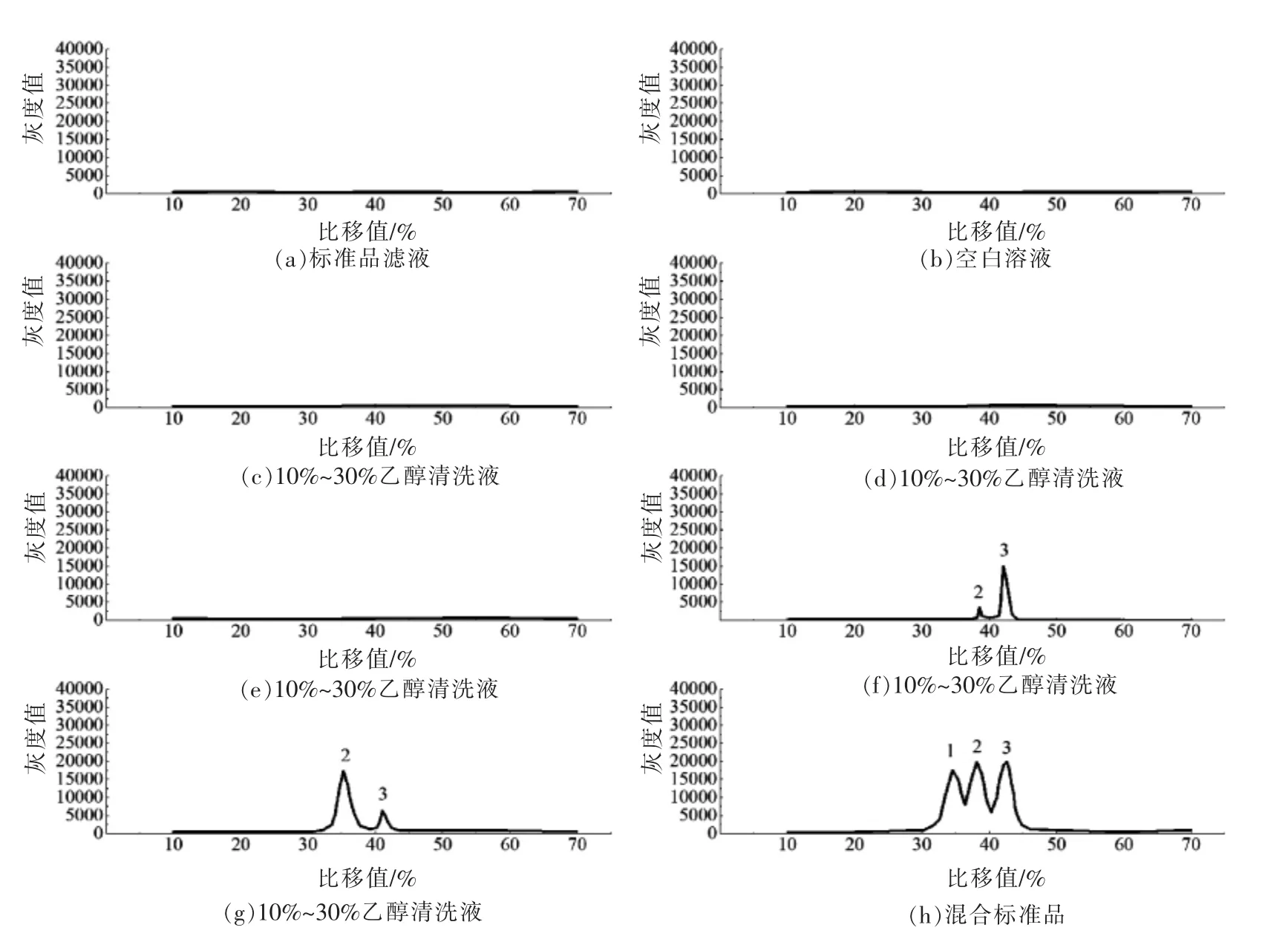
图3 麦芽五糖至七糖混合标准品、标准品清洗液和标准品萃取滤液色谱图Fig.3 Chromatographic charts of maltopentose-heptasaccharide mixed standard,standard cleaning solution and standard extraction filter
2.1.3 洗脱用量 参考已有文献[26],本试验选择50%乙醇溶液作为洗脱剂,考察不同体积(5,10,15,20,25,30 mL)乙醇对寡糖的洗脱情况。取1 g果葡糖浆,平行称取5 份,分别加入10 mL 水溶解后注入固相萃取柱,用25 mL 体积分数20%的乙醇溶液清洗,弃清洗液,分别用5,10,15,20 mL和25 mL 50%乙醇溶液洗脱,收集洗脱液,减压浓缩至干,分别向残渣中加200 μL 水复溶,按1.3.3节方法进行薄层层析,按1.3.4 节方法进行灰度分析,结果见图4。随着洗脱剂体积增加,目标寡糖的灰度值逐渐增大,在体积20 mL 时达到最大值,这说明随着洗脱剂体积的增加,保留在萃取柱中的目标物逐渐被洗脱下来,当洗脱剂体积增至20 mL 时,目标物被完全洗脱,因此选用20 mL 50%乙醇溶液洗脱。
2.2 薄层色谱展开剂
比较各种展开剂的展开效果,结果见表1。4种展开剂的展开效果均不理想,分析认为果葡糖浆中含有多种聚合度寡糖,一次展层不能很好地将各种聚合度的寡糖有效分离,而采用多次展层的方法可解决这一问题。参照文献[22],采用二次展开法,以乙酸-乙酸乙酯-蒸馏水(体积比2∶2∶1.4)和乙酸-乙酸乙酯-蒸馏水 (体积比2∶2.6∶1.4)为展开剂,结果见图5。寡糖斑点清晰,无拖尾现象,相邻斑点之间分离度较好,掺假蜂蜜中不同聚合度的寡糖都得到较好分离,这便于掺假定性和定量检测试验。

图4 不同用量洗脱剂的洗脱效果图Fig.4 Elution effect diagram of eluent with different dosage

表1 不同展开剂的展开效果Table 1 Separation effectiveness of different developing solvents
2.3 掺假定性分析
天然蜂蜜和果葡糖浆掺假蜂蜜经固相萃取净化后,与标准品点样于同一薄层板上,经展开、显色、扫描,用Image J 和Sorbfil 两种软件分析TLC图像,结果分别见图6和图7。在掺假蜂蜜色谱图中可清晰地观察到五糖以上的寡糖色谱峰,而经净化的天然蜂蜜色谱图中只有麦芽三糖和麦芽四糖色谱峰,这与王瑞忠等[26]的研究结果相似。两种软件均可用于蜂蜜的掺假分析。Sorbfil 是用于TLC 图像分析的专用软件,该软件可根据薄层板中的寡糖条带绘制出相应的色谱图,每个寡糖条带对应一个色谱峰。色谱图的纵坐标为不同寡糖条带的Rf值,横坐标为峰面积。与Image J 相比,Sorbfil 软件可直接获得不同寡糖的Rf值,并且蜂蜜样品与标准品可通过软件自动绘制在同一张图中,这有利于与标准品直接对比来鉴别蜂蜜真假。
2.4 标准曲线绘制
取1.3.1 节中质量浓度1.0~5.0 mg/mL 范围的麦芽七糖标准溶液,按1.3.3 节方法展开并显色,按1.3.4 节条件扫描,分别用Image J 和Sorbfil 两种软件分析。以标准品质量浓度x(mg/mL)为横坐标,分别以灰度值y 和峰面积y 为纵坐标,制作标准曲线。由两种软件所得相关系数分别为0.9946和0.9948,表明麦芽七糖标准溶液在1.0~5.0 mg/mL 范围,两种方法都有良好的线性关系。
2.5 检测限和定量限
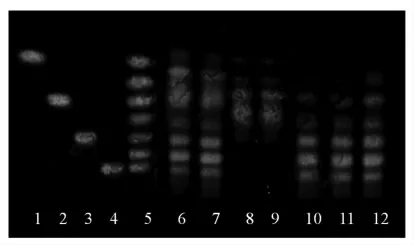
图5 寡糖分离的薄层色谱图Fig.5 TLC of oligosaccharide separation
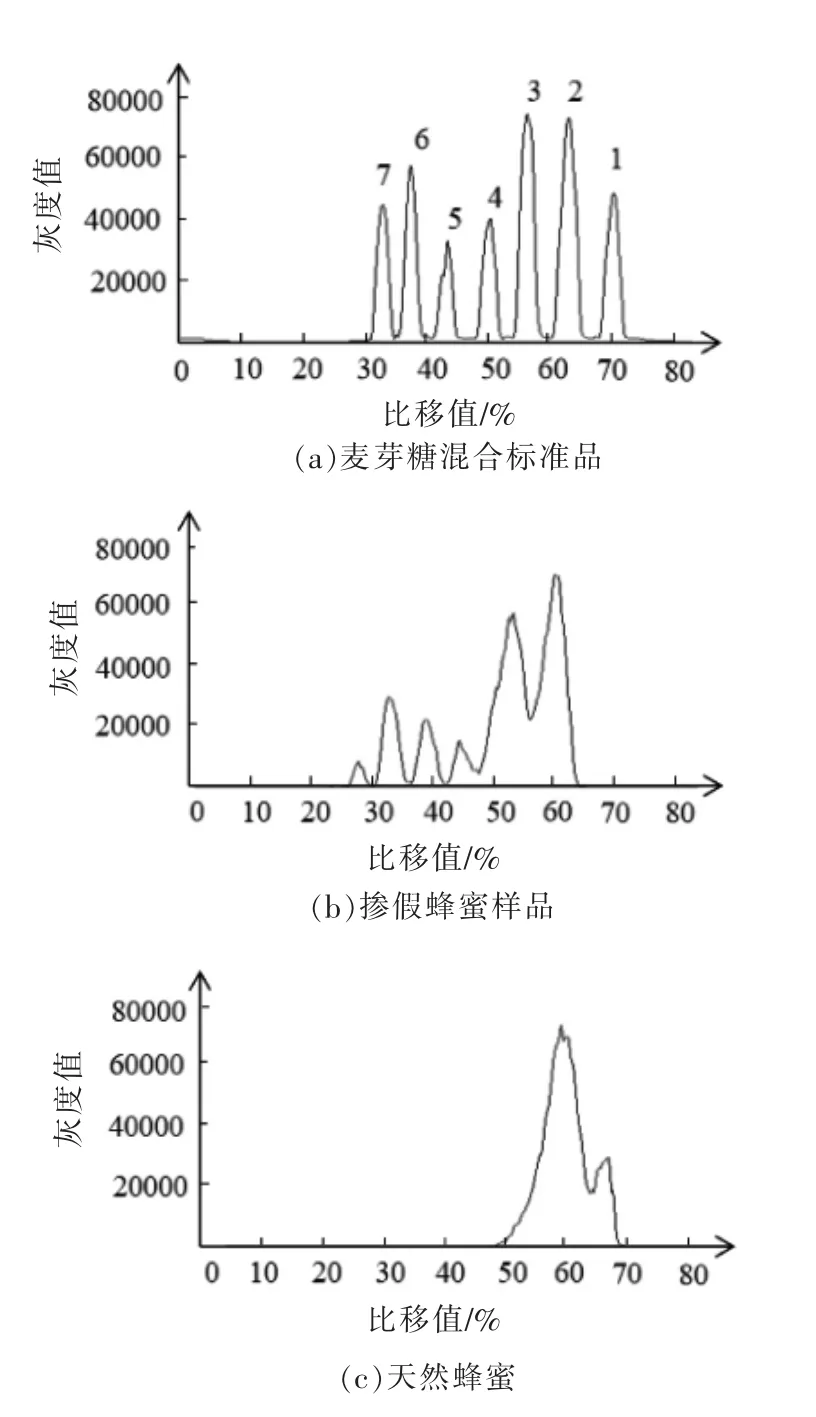
图6 真假蜂蜜寡糖检测的色谱图(Image J)Fig.6 Chromatogram for detection of oligosaccharides in true and false honey (Image J)

图7 真假蜂蜜寡糖检测的色谱图(Sorbfil)Fig.7 Chromatogram for detection of oligosaccharides in true and false honey (Sorbfil)
取1.3.1 节质量浓度0.1~0.9 mg/mL 范围的麦芽七糖标准溶液,按1.3.3 节条件展开显色,按1.3.4 节条件扫描,分别用Image J 和Sorbfil 两种软件分析,绘制标准曲线,相关系数分别为0.9988和0.9968。根据3 SD/S 和10 SD/S 计算LOD 和LOQ,其中SD 是截距的标准偏差,S 是斜率[30]。用Image J 和Sorbfil 两种软件所得麦芽七糖的检出限分别为0.037 mg/mL 和0.061 mg/mL,定量限分别为0.11 mg/mL 和0.19 mg/mL。
2.6 精密度试验
精密度试验包括同板精密度和异板精密度,分别取2,3,4 mg/mL 3 个质量浓度水平的麦芽七糖标准品溶液,同板精密度为同一标准品溶液,按1.3.3 节条件在同一板上点5 个样,展开。异板精密度为同一标准品溶液分别在5 块板上点样,展开,显色后扫描,用两种软件分析,计算精密度,结果见表2。Image J 软件同板、异板精密度试验的灰度值RSD 范围(n=5)分别为1.44%~1.62%和2.89%~3.01%,Sorbfil 软件同板、异板精密度试验的峰面积RSD 范围(n=5)分别为2.39%~3.31%和3.65%~4.71%,说明两种方法均有良好的精密度,同板比异板精密度更好。

表2 同板和异板精密度Table 2 Precision of same plate and different plate
2.7 重复性试验
取3 份质量分数为20%的掺假蜂蜜样品和1 g 果葡糖浆样品,经SPE 净化、薄层色谱分离、扫描仪扫描(图8),分别用Image J 和Sorbfil 两种软件分析。采用2.4 节麦芽七糖标准曲线计算掺假蜂蜜和果葡糖浆中的麦芽七糖含量,计算果葡糖浆回收率,结果见表3。Image J 和Sorbfil 所得回收率的RSD 范围分别为6.13%和3.08%,表明两种方法的重复性良好。
2.8 稳定性试验
取1 份质量分数为20%的掺假样品溶液,经SPE 净化、薄层色谱分离、扫描仪每隔10 min(0~50 min)扫描一次得到图像,用Image J 和Sorbfil两种软件分析,考察稳定性。由Image J 软件所得七糖灰度值的RSD(n=5)为0.73%,由Sorbfil 软件所得七糖峰面积的RSD(n=5)为2.80%,表明两种方法稳定性良好。
2.9 加标回收率试验
取2 g 质量分数20%~40%范围的掺假样品,溶于10 mL 水,经SPE 净化、薄层色谱分离、扫描仪扫描,分别用Image J 和Sorbfil 两种软件分析。每个样品重复分析3 次,计算回收率,结果见表4。两种图像分析软件所得样品的平均回收率分别为98.56%和101.20%。
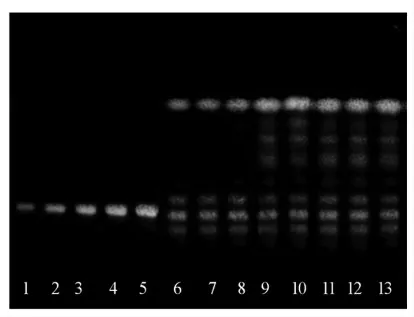
图8 重复性试验薄层色谱图Fig.8 TLC of repeated experimental
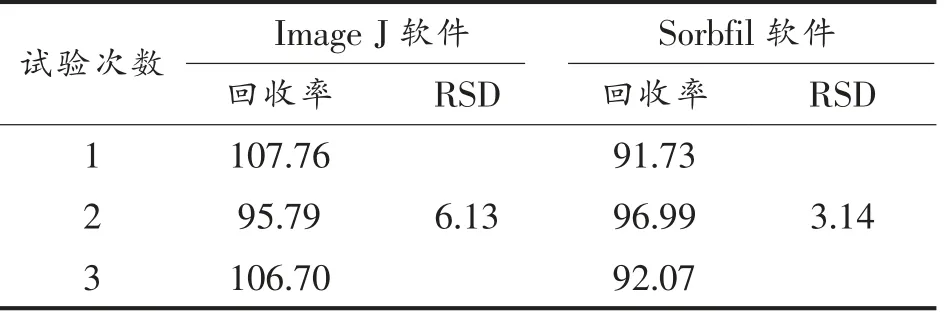
表3 重复性试验结果(%)Table 3 Repeated experimental results (%)

表4 加标回收率试验结果(%)Table 4 The experimental results of recovery rate of standard addition (%)
2.10 实际样品测定结果
采集多个市售蜂蜜样品,按1.3.2 节条件富集寡糖,按1.3.3 节层析条件分离后显色,薄层层析结果见图9。按1.3.4 节条件扫描薄层板,分别用Image J 和Sorbfil 两种软件对市售蜂蜜样品进行定性和定量分析,见图10和图11。部分样品存在聚合度五以上的寡糖,表明这些样品中掺有糖浆类物质。4 种市售蜂蜜中的七糖含量见表5。
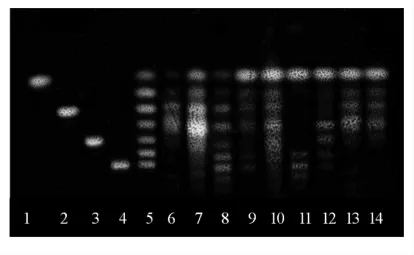
图9 市售蜂蜜样品薄层色谱图Fig.9 TLC of honey samples on sale
3 结论
蜂蜜被掺入果葡糖浆后,利用固相萃取法富集较高聚合度的寡糖,薄层色谱法分离寡糖,并结合Image J 和Sorbfil 图像分析软件检测。对比蜂蜜样品与麦芽糖标准品色谱图发现,天然蜂蜜中没有聚合度五以上的寡糖色谱峰,而掺入果葡糖浆的蜂蜜中可检出五糖以上的寡糖色谱峰。用麦芽七糖标准品溶液建立标准曲线,由两种软件所得相关系数分别为0.9946 和0.9948,在质量分数20%~40%的掺假范围,平均回收率为98.56%和101.20%,说明两种软件均可对掺假蜂蜜准确定量。Image J 和Sorbfil 两种软件所得麦芽七糖的检出限分别为0.037 mg/mL 和0.061 mg/mL,定量限分别为0.11 mg/mL 和0.19 mg/mL。两种方法均具有良好的精密度和稳定性。
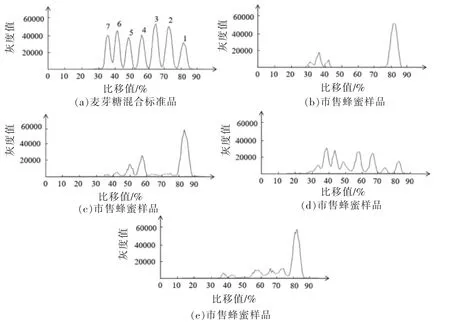
图10 市售蜂蜜样品色谱图(Image J)Fig.10 Chromatogram of honey samples on the market (Image J)
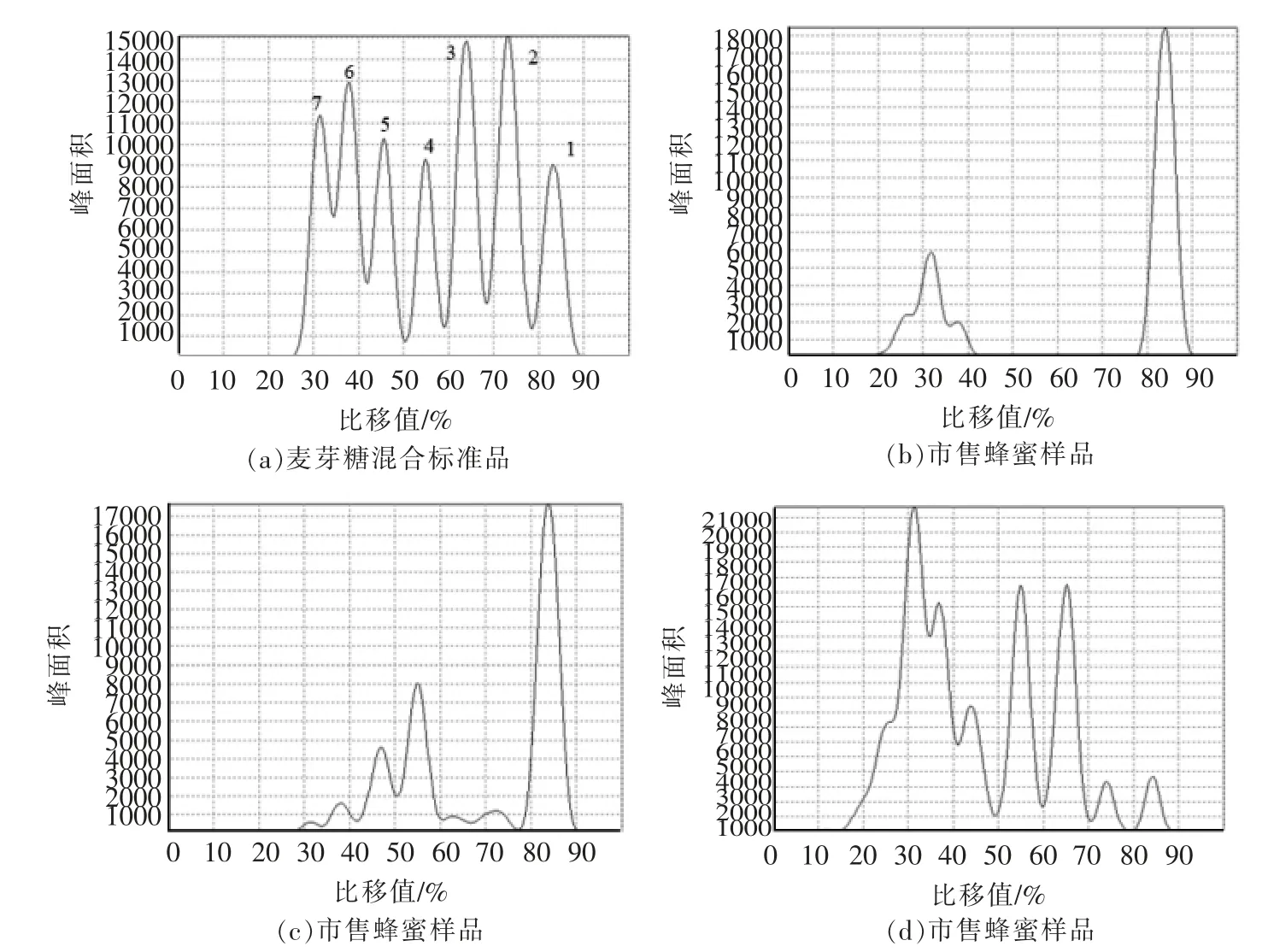
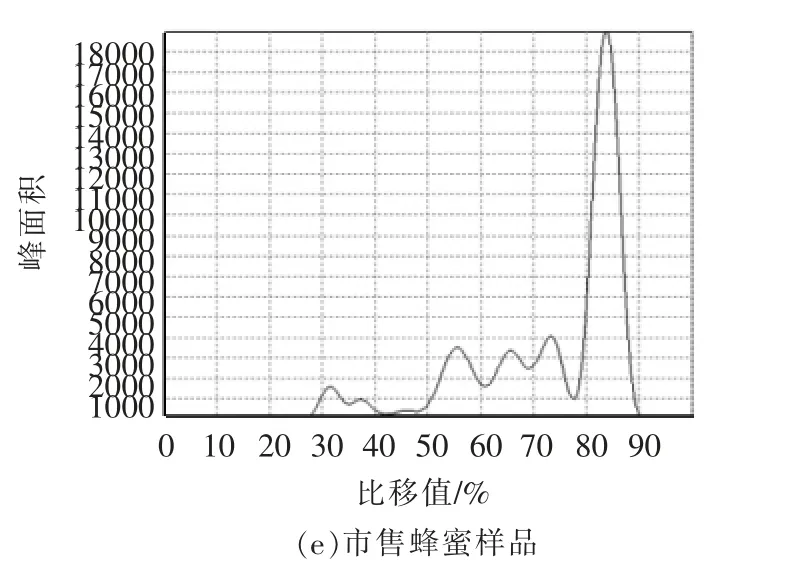
图11 市售蜂蜜样品色谱图(Sorbfil)Fig.11 Chromatogram of honey samples on the market(Sorbfil)
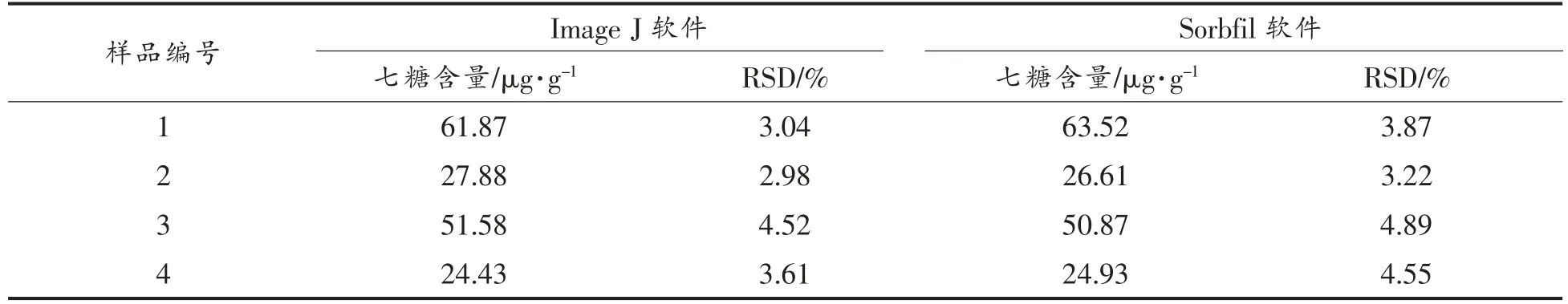
表5 市售蜂蜜中七糖的含量Table 5 Contents of heptasaccharide in honey on the market
本研究以聚合度五以上寡糖为标记物来鉴别蜂蜜真伪,通过优化试验条件提高了薄层色谱法检测蜂蜜的灵敏度,结合图像分析软件实现了对果葡糖浆的定量分析。该方法检测成本低,无需昂贵仪器,适用于小型工厂和地方检测机构。
