桦褐孔菌多糖对糖尿病小鼠的干预作用及机制
2021-04-22王箴言张久亮
夏 晴,王箴言,王 玉,杨 扬,张久亮
(华中农业大学食品科学与技术学院 武汉430070)
糖尿病是以高血糖为主要特征的代谢性疾病,由胰岛素绝对或相对分泌不足所引起。据国际糖尿病联盟(IDF)最新统计显示:2015年全球糖尿病患病人数约为4.15 亿,而我国糖尿病患病人数居世界首位,约有1.1 亿人[1]。α-葡萄糖苷酶抑制剂可有效降低餐后血糖水平,被认为是治疗Ⅱ型糖尿病的关键因素[2]。目前为止,生物活性多糖对α-葡萄糖苷酶的抑制被广泛用于评估其体外降血糖的效果[3]。
桦褐孔菌(Inonotus obliquus)是一种生长在寒带的木腐菌,属担子菌亚门、层菌纲、非褐菌目(无褐菌目)、多孔菌科、褐卧孔菌属,主要分布于北半球北纬45°~50°的地区。自16 世纪以来,桦褐孔菌作为一种民间药物用作治疗胃、肠癌、心血管疾病[4]。有研究表明,桦褐孔菌含有200 多种活性物质,主要是多糖、桦褐孔菌素、三萜类化合物等,具有抗肿瘤、增强免疫、抗氧化、降血糖等功效[5-6]。Liang 等[7]报道桦褐孔菌多糖在高脂血症大鼠中表现出很强的抗氧化和降血脂能力。吕金玲等[8]开展桦褐孔菌各极性部位对四氧嘧啶诱导的糖尿病小鼠的药效学试验,确定桦褐孔菌多糖具有降糖活性。梁丽雅等[9]发现桦褐孔菌60%醇提物具有较好的体内抗氧化和抑制脂质过氧化的活性,并可改善血清的血脂水平。Wang 等[10]研究桦褐孔菌多糖对链脲佐菌素诱导的Ⅱ型糖尿病小鼠抗糖尿病作用及PI3K-Akt 信号通路的可能机制。多糖类活性物质传统上采用水提醇沉,而三萜类化合物通常采用乙醇浸提,实验室前期研究发现桦褐孔菌80%醇提物中三萜得率最高。虽然动物和临床试验显示桦褐孔菌具有降血糖作用,但是未见对桦褐孔菌发挥降血糖作用物质基础的报道。
本试验中采用高脂饮食联合腹腔注射STZ 的方法建立Ⅱ型糖尿病小鼠模型,用不同溶剂提取桦褐孔菌活性物质,探究桦褐孔菌水提物和醇提物对糖尿病小鼠糖脂代谢与抗氧化的影响。通过体外研究水提物对α-葡萄糖苷酶的抑制作用及抑制类型,为明确桦褐孔菌提取物降血糖的物质基础和相关机制提供理论参考。
1 材料与方法
1.1 实验动物及材料
SPF 级昆明雄性小鼠(20±2)g,购自华中农业大学实验动物中心,许可证号为SCXK (鄂)2015-0019。桦褐孔菌,由东莞市神龟生物科技有限公司提供;STZ,美国Sigma 公司;盐酸二甲双胍,中美上海施贵宝制药有限公司;甘油三酯(TG)试剂盒、总胆固醇(TC)试剂盒、高密度脂蛋白(HDL-C)试剂盒、低密度脂蛋白(LDL-C)试剂盒、糖化血清蛋白(GSP)试剂盒、BCA 蛋白浓度试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)以及肝丙二醛(MDA)试剂盒,南京建成生物工程研究所;α-葡萄糖苷酶 (14 U/mg),美国Sigma 公司;阿卡波糖、对硝基苯基-α-D-吡喃葡萄糖苷(pNPG),上海源叶生物科技有限公司;其它试剂均为国产分析纯。
1.2 仪器与设备
DK-98-2 恒温水浴锅,上海科尔仪器设备有限公司;BSA124S 分析天平,赛多利斯科学仪器(北京)有限公司;Eppendorf centrifuge 5804 高速冷冻离心机,德国艾本德股份公司;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;DHG-9240A 恒温培养箱,上海一恒科技有限公司;Thermo Multiskan GO 全自动酶标仪,上海赛默飞世尔科技有限公司。
1.3 方法
1.3.1 桦褐孔菌提取物的制备 子实体经粉碎后过40 目筛,加20 倍80%乙醇,在80 ℃下回流提取2 h,离心取上清液,将2 次提取液合并、浓缩、冷冻干燥得到桦褐孔菌醇提物干粉。醇提后所得残渣于50 ℃烘干,加入20 倍热水在90 ℃下提取2 h,离心取上清,浓缩至适当体积,加入乙醇使其醇含量达80%,4 ℃静置过夜,离心取沉淀,加水复溶,冷冻干燥得到桦褐孔菌水提物。
1.3.2 提取物中活性成分含量测定 总三萜的测定:参考文献[11]进行测定;总多酚的测定:参照T/AHFIA 005-2018 植物提取物及其制品中总多酚含量的测定;总多糖的测定:参照NY/T 1676-2008 食用菌中粗多糖含量的测定。
1.3.3 Ⅱ型糖尿病小鼠模型的构建 雄性昆明小鼠,标准环境中适应性饲养1 周。随机分为正常组(8 只)和糖尿病组(32 只),正常组给予普通饲料,糖尿病组给予高脂饲料喂养4 周。参考文献[12]做适量改动,禁食不禁水12 h 后,糖尿病组小鼠腹腔注射65 mg/kg 的STZ 溶液 (STZ 溶解在0.1 mol/L、pH 4.5 的柠檬酸缓冲液中,现配现用),连续3 d 建立糖尿病模型,正常组注射等剂量的柠檬酸缓冲液。造模7 d 后,禁食不禁水12 h,尾部取血检测空腹血糖 (Fasting blood glucose,FBG)含量,FBG>11.1 mmol/L 的小鼠视为糖尿病造模成功,进行后续试验。
1.3.4 造模后分组与处理 将糖尿病小鼠按照体重和血糖浓度随机分为4 组:分别为糖尿病模型组(DC 组)、阳性对照组(PC 组)、桦褐孔菌水提物组(IOWE 组)和桦褐孔菌醇提物组(IOAE 组),每组8 只。PC 组给予250 mg/kg 盐酸二甲双胍;IOWE 组和IOAE 组小鼠每天分别灌胃600 mg/kg提取物;NC 组和DC 组小鼠按0.1 mL/kg 灌胃蒸馏水;4 周后各组小鼠均禁食12 h,摘眼球取血、处死并解剖,观察其体内肝、肾、胰腺等脏器后取出称重并收集。
1.3.5 测量体重及检测血糖 每周定时测量体重并观察小鼠生长状况,尾静脉取血测空腹血糖值(fasting blood glucose,FBG)。试验结束前1 d进行小鼠葡萄糖耐受量试验 (oral glucose tolerance test,OGTT):小鼠禁食不禁水12 h 后尾静脉取血测定FBG 作为0 h 的血糖值,随后根据体重灌胃给药,15 min 后再灌胃2 g/kg 葡萄糖溶液,于灌胃后15,30,60,120 min 测定小鼠血糖值,使用GraphPad Prism version 7.0 计算血糖曲线下面积(area under the curve,AUC)。
1.3.6 检测血清糖脂代谢相关指标及肝脏抗氧化水平 使用相关试剂盒检测小鼠血清TC、TG、HDL-C、LDL-C、GSP 和肝脏中MDA、SOD、CAT含量。具体检测过程见试剂盒说明书。
1.3.7 桦褐孔菌水提物对α-葡萄糖苷酶IC50值的测定 根据文献[13]略有改动,试验组选用不同浓度的桦褐孔菌水提物溶液 (分别为0,6,8,10,12 μg/mL),在96 孔板中加入40 μL 样品溶液和20 μL 0.25 U/mL 的α-葡萄糖苷酶溶液,在37 ℃培养箱中孵育10 min,再加入40 μL 0.5 mmol/L pNPG 溶液,置于37 ℃孵育20 min,最后加入100 μL 0.1 mol/L Na2CO3溶液终止反应,于波长405 nm 处测定吸光度。以阿卡波糖作为阳性对照,PBS作为空白对照,按公式计算样品对α-葡萄糖苷酶的抑制率:

式中:Asample——样品组的吸光度值;Ablank——样品不加酶的吸光度值;Atest——空白组吸光度值;Acontrol——空白不加酶吸光度值。利用SPSS 计算酶抑制率为50%时对应的样品浓度,即为样品的半数抑制浓度(IC50)。
1.3.8 水提物对α-葡萄糖苷酶抑制可逆性的研究 固定底物pNPG 的浓度(5×10-4mol/L),比较不同质量浓度样品(分别为0,6,8,10,12 μg/mL)随酶浓度(0.5,0.625,0.75,0.875,1 U/mL)的改变,吸光值变化率即ΔOD405nm。
1.3.9 水提物对α-葡萄糖苷酶体外抑制动力学的测定 固定α-葡萄糖苷酶的浓度(0.3 U/mL),比较不同质量浓度样品(分别为0,6,8,10,12 μg/mL)吸光值变化率即ΔOD405nm,探究α-葡萄糖苷酶活力随底物pNPG 浓度 (0.125,0.25,0.5,1 mmol/L)的变化趋势。对米氏方程两边求倒数得到Lineweaver-Burk 双倒数方程。以1/V 对1/[S]作图,计算并判断样品对α-葡萄糖苷酶抑制的作用类型。

式中:Km——米氏常数;[S]——底物浓度,mmol/L;Vmax——最大反应速率,ΔOD/min;V——反应速率,ΔOD/min。
1.4 数据处理
使用SPSS 21.0 软件处理试验结果,单因素方差分析(ANOVA)检验后Duncan 检验,组间统计学显著性差异分析,其中P<0.05 具有统计学意义。结果均以(±s)表示。
2 结果与分析
2.1 2 种组分中活性成分含量的比较
采用80%乙醇对桦褐孔菌进行提取,其醇提物得率为(16.14±1.28)%,将残渣用热水浸提,醇沉冻干后水提物得率为(17.16±1.89)%。

表1 桦褐孔菌提取物的提取率及活性成分含量Table 1 Extraction rate and active ingredient content of Inonotus obliquus extract
由表1可知:桦褐孔菌水提物主要成分为多糖,含量达到(22.54±1.32)%,基本不含有三萜类和多酚类等中等极性物质。而桦褐孔菌醇提物中的活性物质主要是弱极性、中极性的小分子,三萜和多酚类物质是其主要成分,共占21.04%。
2.2 桦褐孔菌提取物对糖尿病小鼠体重、脏器指数的影响
由图1可知,连续3 d 腹腔注射STZ 后,DC组小鼠体重较NC 组有极显著下降(P<0.01),且肝脏和肾脏指数极显著上升(P<0.01)。体重的下降和脏器指数的上升被认为是糖尿病的典型特征,这与葡萄糖代谢缺陷和组织蛋白过度分解有关[14]。经过4 周的治疗,各治疗组小鼠体重较DC 组有所增长,其中PC 和IOWE 组小鼠体重与DC 组相比差异显著(P<0.05);肝脏指数有所恢复,肾脏指数IOWE 组较模型组显著下降(P<0.05),但胰腺指数各组无显著差异。数据表明桦褐孔菌水提物和醇提物可减缓糖尿病小鼠体重的下降,且水提物效果优于醇提物。
2.3 桦褐孔菌提取物对糖尿病小鼠空腹血糖的影响
图2可以看出,与NC 组相比,STZ 诱导的糖尿病小鼠显现出较高的FBG 水平,在4 周的试验期间,DC 组FBG 在持续增加,这表明成功地建立了Ⅱ型糖尿病小鼠模型。4 周治疗后,IOWE 组小鼠的FBG 较第1 周的下降17.57%,恢复至原始水平,与DC 组小鼠相比FBG 显著下降(P<0.05),效果与PC 组(较第1 周下降24.4%)相当。这与桦褐孔菌铬复合物(600 mg/kg)可显著降低糖尿病的空腹血糖值结果相一致[12]。IOAE 组小鼠FBG 水平较DC 组有所下降,但无统计学差异。
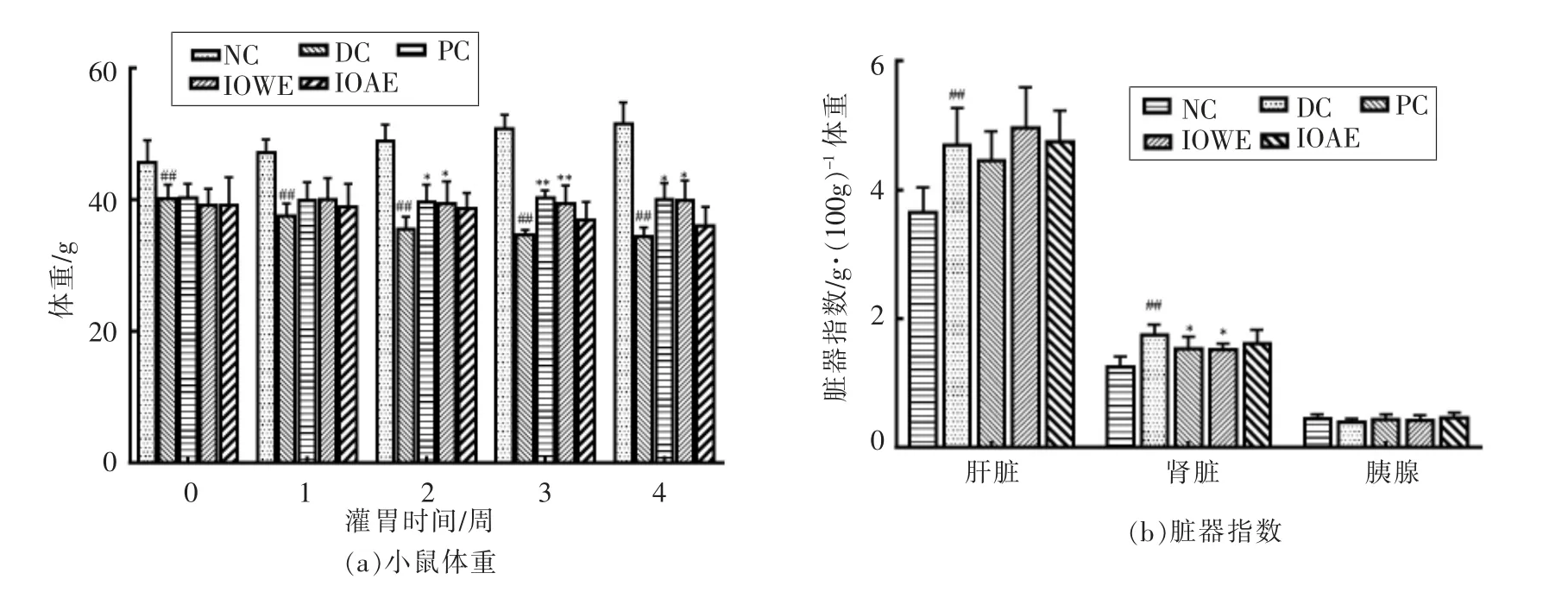
图1 桦褐孔菌提取物对STZ 诱导的糖尿病小鼠体重和脏器指数的影响Fig.1 Effect of extract of Inonotus obliquus on body weight and organ index in STZ-induced diabetic mice
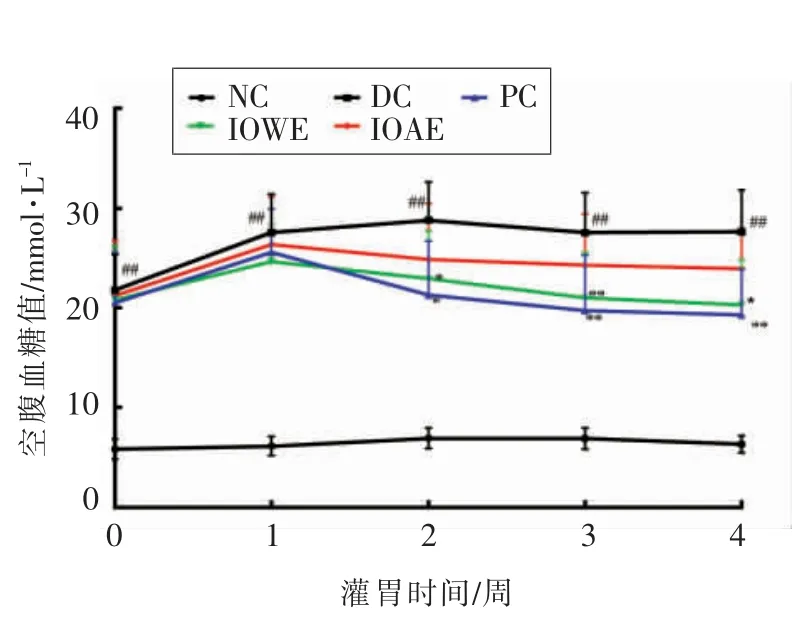
图2 桦褐孔菌提取物对糖尿病小鼠空腹血糖值的影响Fig.2 Effect of extract of Inonotus obliquus on fasting blood glucose in diabetic mice
2.4 桦褐孔菌提取物对糖尿病小鼠口服葡萄糖耐受量的影响
口服葡萄糖耐受量试验中血糖如图3a 所示,口服葡萄糖导致小鼠血糖值在30 min 达到顶峰,糖尿病小鼠血糖值在接下来的90 min 仍处于一个较高水平,与NC 组相比差异极显著(P<0.01)。NC组小鼠血糖值30 min 达到最大,随后逐渐下降,120 min 后恢复至原始水平。与DC 组相比,各治疗组血糖峰值有所降低,且PC 和IOWE 组血糖值在接下来的90 min 有所改善。图3b 表明DC 组AUC较NC 组极显著升高 (P<0.01),120 min 后PC 组AUC 较DC 组极显著下降 (P<0.01),IOWE 组较DC 显著下降(P<0.05),IOAE 组虽有减小,但差异不显著。上述结果表明桦褐孔菌水提物及醇提物均可提高糖尿病小鼠的葡萄糖耐受能力,阻止糖尿病的进一步恶化,且水提物效果远优于醇提物。
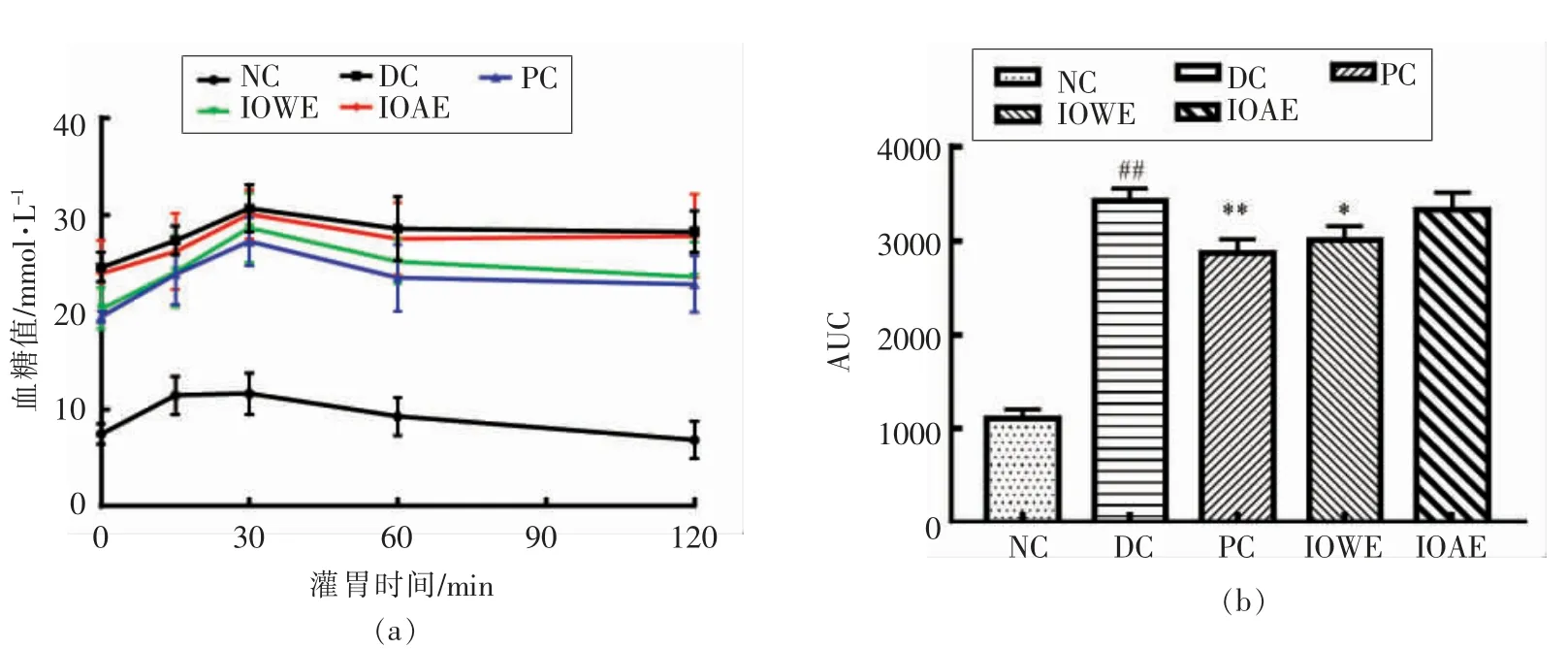
图3 桦褐孔菌提取物对糖尿病小鼠口服葡萄糖耐受量的影响Fig.3 Effect of extract of Inonotus obliquus on oral glucose tolerance in diabetic mice
2.5 桦褐孔菌提取物对糖尿病小鼠血清中血脂水平的影响
血脂异常被认为是心血管疾病发展的主要危险因素[15]。因此,旨在预防血脂异常的策略对于糖尿病的治疗是必不可少的。一般来说,血脂异常的特征是血清中TC、TG、LDL-C 水平升高和HDL-C水平降低[16]。本研究中在STZ 诱导的糖尿病小鼠中观察到极显著的脂质水平紊乱(图4)。经过4周的IOWE 治疗后,与DC 组相比,血清中TG 含量下降28.81%,TC、LDL-C 水平显著降低,降低率分别为24%,25.12%(P<0.05)。这与桦褐孔菌发酵液的干物质有助于糖尿病小鼠脂质水平趋于正常化的研究结果一致[17]。经IOAE 治疗的小鼠血清中TG、TC、LDL-C 较DC 组分别下降28.8%,15.3%,16.24%。与DC 组相比,各治疗组的HDL-C 水平有所增加,其中IOWE 和IOAE 组分别增加27.51%,19.46%。已经证明HDL-C 可以促进TC和TG 从外周组织流出到肝脏,在循环期间分解代谢,本研究中TC 和TG 水平降低,可能部分是由于HDL-C 水平的增加引起[18]。经过4 周的治疗后,PC 和IOWE 组小鼠血清中GSP 含量显著降低(P<0.05),IOAE 组GSP 与DC 组无统计学差异,仅下降8.37%。脂质水平的变化表明桦褐孔菌水提物具有调节糖尿病小鼠脂质代谢的潜力。
2.6 桦褐孔菌提取物对小鼠氧化应激水平的影响
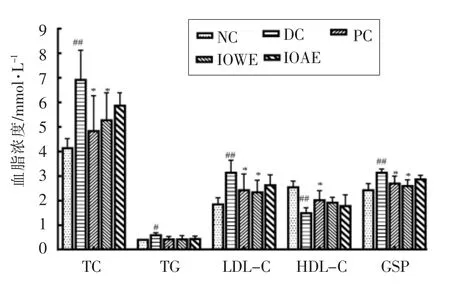
图4 桦褐孔菌提取物对糖尿病小鼠血清中血脂水平的影响Fig.4 Effect of extract of Inonotus obliquus on serum lipid levels in diabetic mice
在慢性高血糖环境下,由于蛋白质的非酶糖化和脂质过氧化等几种生化途径,自氧化产生的自由基会增加[19]。氧化应激在糖尿病特别是Ⅱ型糖尿病引起的血管并发症的发展中起着重要作用[20]。SOD、CAT 是哺乳动物中常见的抗氧化酶,在减轻体内氧化应激方面发挥重要作用[21]。因此,抗氧化酶活性的提高是抗高血糖症的标志。如表2所示,DC 组小鼠的SOD,CAT 活性极显著下降,肝脏中MDA 水平极显著升高(P<0.01),说明肝脏和肾脏中的氧化应激增强。各治疗组与DC 组相比较抗氧化水平有所改善,其中经IOWE 治疗后糖尿病小鼠肝脏中CAT、SOD 活力显著升高 (P<0.05),MDA 水平显著降低(P<0.05);IOAE 治疗后的糖尿病小鼠CAT 活力极显著增加(P<0.01)。结果表明,桦褐孔菌提取物可通过促进SOD、CAT 活性和降低MDA 水平来提高糖尿病小鼠的抗氧化能力以减轻由高血糖引起的氧化应激。
2.7 桦褐孔菌水提物对α-葡萄糖苷酶的抑制作用及抑制动力学
2.7.1 桦褐孔菌水提物对α-葡萄糖苷酶IC50值的测定 α-葡萄糖苷酶是一种存在于小肠绒毛黏膜细胞刷状缘的酶类,通过水解α-1,4 糖苷键,可以使淀粉和其它有关多糖的非还原端水解形成葡萄糖。α-葡萄糖苷酶抑制剂通过抑制α-葡萄糖苷酶的活性,延缓或抑制葡萄糖在肠道内的吸收,可以有效降低餐后血糖峰值。体内降血糖数据显示桦褐孔菌水提物可降低糖尿病小鼠血糖,调节脂质代谢,减缓氧化应激损伤,且水提物效果远优于醇提物。故选择桦褐孔菌水提物进行体外α-葡萄糖苷酶的抑制试验。
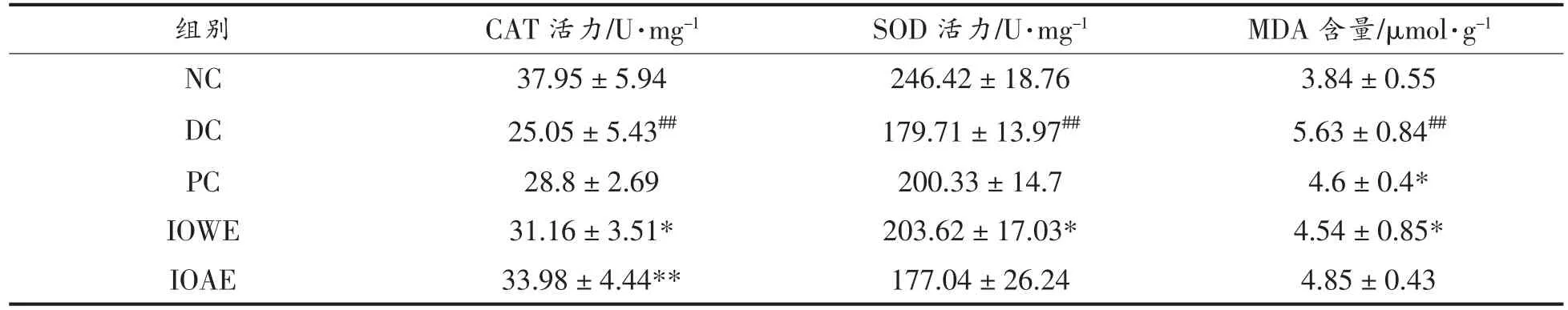
表2 各组小鼠肝组织中抗氧化指标的测定Table 2 Determination of antioxidant indexes in liver tissues of mice in each group
如图5所示,水提物浓度与α-葡萄糖苷酶的抑制率呈正相关,随着水提物浓度的增加抑制率增加。且水提物的IC50值(8.6 μg/mL±0.44 μg/mL)远低于阿卡波糖(1.02 mg/mL±0.23 mg/mL),水提物的α-葡萄糖苷酶抑制能力比阿卡波糖高约118倍,这与沈心怡等[22]的研究结果相似。结果表明桦褐孔菌水提物可以强烈抑制α-葡萄糖苷酶活性。
2.7.2 桦褐孔菌水提物对α-葡萄糖苷酶可逆性的研究 以桦褐孔菌水提物为研究材料,通过探究其对α-葡萄糖苷酶酶促反应速度与酶浓度的关系,系统判断其对α-葡萄糖苷酶的抑制类型。如图6所示,在底物浓度不变的情况下,α-葡萄糖苷酶的量与反应速率成正比,且不同浓度的水提物溶液反应速率直线均经过原点,斜率随着水提物浓度的增大而变小。其斜率特点表明水提物对α-葡萄糖苷酶的抑制为可逆性抑制,即桦褐孔菌水提物与α-葡萄糖苷酶以非共价键结合,样品作为可逆性抑制剂,只减小反应速率,不影响反应进程和酶的结构。
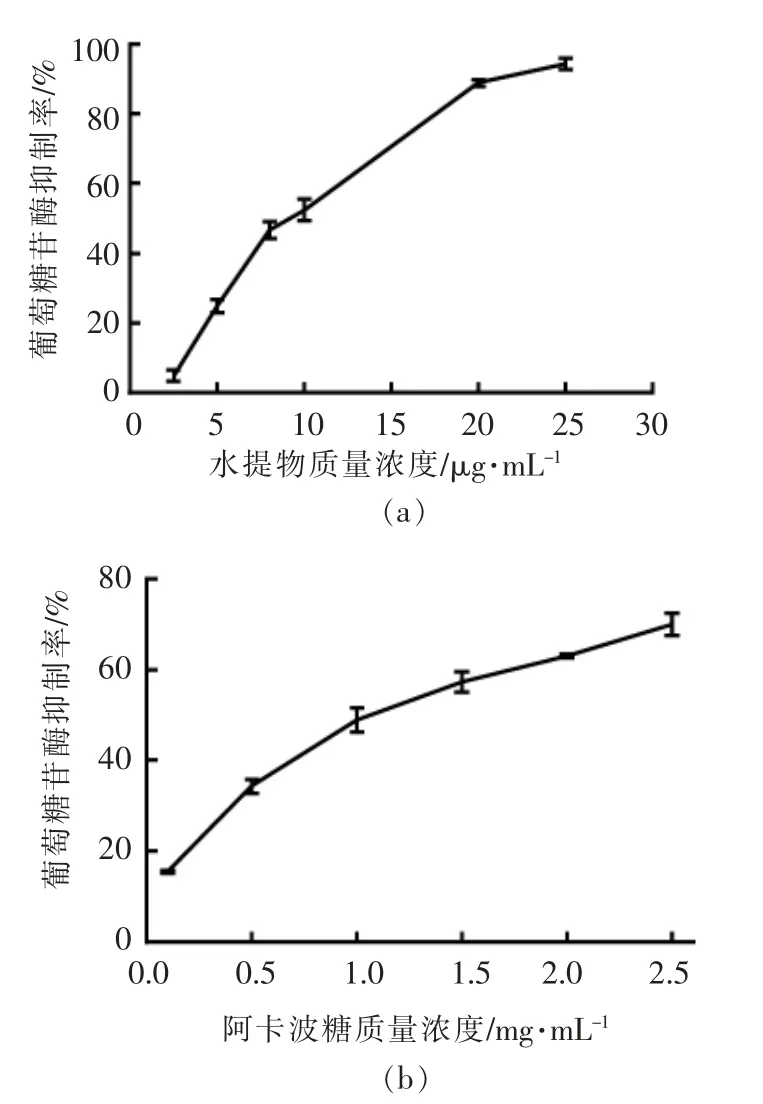
图5 水提物及阿卡波糖对α-葡萄糖苷酶的抑制作用Fig.5 Inhibition of α-glucosidase by water extracts and acarbose
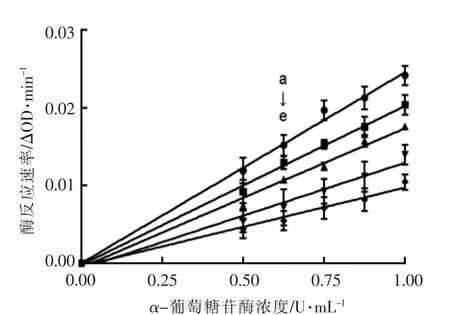
图6 桦褐孔菌水提物对α-葡萄糖苷酶的体外抑制可逆性Fig.6 In vitro inhibition of α-glucosidase by water extracts of Inonotus obliquus
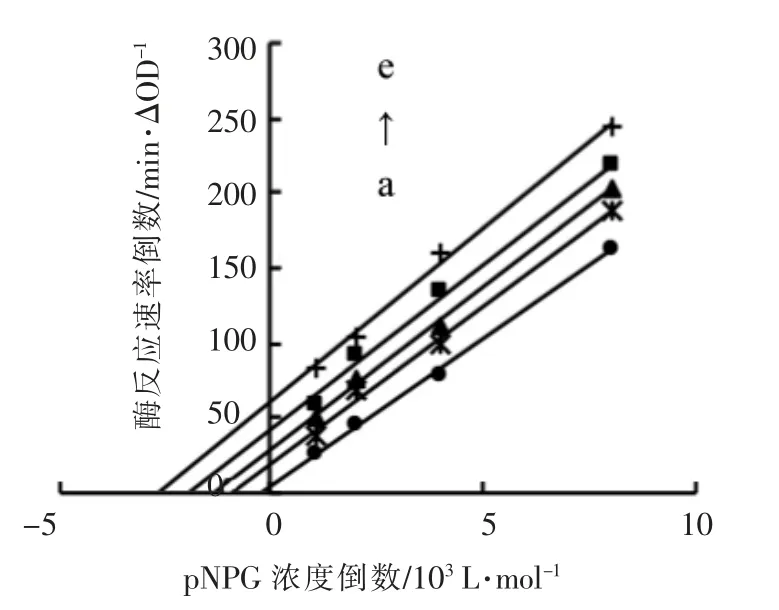
图7 水提物对α-葡萄糖苷酶的体外抑制动力学Fig.7 In vitro inhibition kinetics of α-glucosidase by water extracts
2.7.3 水提物对α-葡萄糖苷酶的体外抑制动力学 图7为水提物对α-葡萄糖苷酶抑制类型的双倒数Lineweaver-Burk 图。随着水提物浓度的增大,直线在纵轴的截距依次增大即1/V 增大,即Vmax 随水提物浓度增大而减小;在横轴的截距依次减小,即-1/Km减小,即Km随水提物浓度增大而减小。动力学参数表明桦褐孔菌水提物对α-葡萄糖苷酶抑制为反竞争性抑制。已有研究表明,非竞争性抑制剂与竞争性抑制剂之间,甚至与非竞争性抑制剂之间可协同抑制α-葡萄糖苷酶的活性[23-25]。阿卡波糖作为一种竞争性和可逆的α-葡萄糖苷酶抑制剂,可以阻止淀粉和其它碳水化合物的降解,延缓小肠中葡萄糖的吸收,已被用于控制餐后血糖[26]。因此,作为非竞争性抑制剂,桦褐孔菌水提物与阿卡波糖等一线药物的联用也非常具有潜力。
3 结论
体内动物试验结果表明桦褐孔菌水提物及醇提物均可缓解STZ 诱导的糖尿病小鼠体重的下降,降低小鼠空腹血糖值,提高糖尿病小鼠的葡萄糖耐受能力,改善糖尿病小鼠血脂水平,促进肝脏中SOD 和CAT 活性,降低MDA 水平,且水提物效果优于醇提物。体外降血糖试验数据显示水提物对α-葡萄糖苷酶有较强的抑制作用,且水提物对α-葡萄糖苷酶抑制类型表现为反竞争性抑制,结果表明桦褐孔菌水提物是一种有效的α-葡萄糖苷酶抑制剂。体内外试验一致证明桦褐孔菌水提物具有较佳的降血糖功效,其降血糖的可能机制是对α-葡萄糖苷酶的良好抑制效果。本研究可为桦褐孔菌在保健品和功能食品中的开发与应用提供一定的理论参考。
