黑木耳胞外多糖对小鼠肠道微生态及免疫调节的影响
2021-04-22李殿龙徐俊亭蔺洁茹施治臣郝利民刘振兴
郝 敏,李殿龙,徐俊亭,蔺洁茹,王 旭,施治臣,郝利民,刘振兴*
(1 天津科技大学生物工程学院 天津300457 2 军事科学院军需工程技术研究所 北京100010)
黑木耳作为一种珍贵的传统食用真菌,不仅能为人体提供氨基酸、蛋白质、膳食纤维等营养物质,还具有抗氧化、抗肿瘤、降血糖和预防心血管疾病等多种活性功能[1]。黑木耳含有多种营养成分,其中所含多糖成分的作用研究较为广泛,尤其是在食品和保健品开发方面具有应用价值,如黑木耳饮料、黑木耳口服液等[2-4]。研究发现,黑木耳多糖能够显著提高机体免疫力,抑制小鼠脾淋巴细胞转化增殖能力,增强其巨噬细胞吞噬能力和自然杀伤细胞活性[5-7]。
肠道微生物是人体的重要代谢“器官”,在消化吸收、新陈代谢和免疫反应等生命活动中发挥关键性作用。随着对肠道微生物与机体健康研究的深入,发现正常生理条件下人体肠道菌群处于动态平衡状态,当内环境变化或受到外界刺激时,会导致肠道内菌群紊乱,对机体健康产生影响。例如,抗生素滥用会破坏肠道微生物种群平衡,增加炎症性疾病风险。益生菌通过分泌一系列抗菌物质(有机酸、过氧化氢和细菌素等)降低肠内pH,增加短链脂肪酸(Short chain fatty acid,SCFA)含量来减少病原体活菌数[8-9]。研究发现,多糖可以促进肠道优势菌增殖和调节肠道内分泌物[10-11],从而促进肠道内环境稳态和机体健康。
尽管黑木耳具有较高的营养价值和广阔的应用前景,但是其多糖成分对肠道微生物的调控作用与机制仍不清楚。为了明晰黑木耳多糖对肠道菌群变化的调控效应及其生物功能,本研究利用小鼠模型,分析黑木耳胞外多糖对小鼠肠道菌群多样性、SCFA 含量变化及血清细胞因子的影响,为黑木耳多糖益生菌微生态制剂和新型健康食品的开发提供理论基础。
1 材料与方法
1.1 原料与试剂
黑木耳菌株(GenBank:KF297975.1,天津科技大学生物医药与分子生物学实验室保存)。
无水乙醇(分析级)、葡萄糖(分析级)、浓硫酸(分析级)、二甲苯(分析级),天津北方天医化学试剂厂;三氯甲烷(分析级)、异戊醇(分析级)、二氯甲烷(色谱级),上海生工生物工程有限公司;乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸,上海源叶生物科技有限公司;柠檬酸钠抗原修复液,上海碧云天生物技术有限公司;牛血清白蛋白,北京索莱宝科技有限公司;GPR43 抗体,圣克鲁斯生物技术(上海)有限公司;FITC 标记的荧光二抗,赛默飞世尔科技(中国)有限公司;酶联免疫吸附(ELISA)试剂盒,上海茁彩生物科技有限公司。
1.2 实验动物
SPF 级近交系CD-1 雌鼠18 只,体重(20±3)g,实验动物许可证号:SCXK(京)2016-0006,购于北京维通利华实验动物技术有限公司。
1.3 仪器设备
AB204-S 型分析天平,梅特勒-托利多仪器上海公司;GH-6000 型电热恒温培养箱,天津市泰斯特仪器有限公司;ALPHA2-4/LD 型冷冻干燥机,德国CHRIS 公司;722 型紫外分光光度计,上海精科仪器公司;7890A 气相色谱仪,美国安捷伦科技有限公司;BX53 正置荧光显微镜,日本Olympus公司。
1.4 黑木耳胞外多糖提取
黑木耳发酵培养参照肖彩霞[12]的方法。发酵液经3 000 r/min 离心20 min 弃沉淀,上清液直接进行真空蒸发,浓缩至原体积的1/4,加入无水乙醇(体积分数30%),4 ℃过夜。3 000 r/min 离心20 min 后,向上清溶液加入去蛋白试剂(三氯甲烷-异戊醇=1∶4)并磁力搅拌10 min,3 500 r/min 离心15 min 弃沉淀,上清液加入无水乙醇(体积分数75%)4 ℃过夜。4 000 r/min 离心15 min 取得沉淀物即为粗多糖,将多糖沉淀用水复溶后透析12 h,每2 h 换1 次水,随后冷冻干燥,得到黑木耳胞外多糖。
1.5 多糖的鉴定及单糖组成分析
1.5.1 多糖的红外光谱解析 称取黑木耳胞外多糖1 mg,加入适量溴化钾(KBr)粉末于研钵中,充分研磨后压成透明薄片,随后用Nicolet IS10 FTIR 光谱仪(Thermo Scientific,美国)在400~4 000 cm-1波数范围内扫描,记录IR 光谱。
1.5.2 多糖的单糖组成分析 本试验利用高效液相色谱仪,结合PMP (1-苯基-3-甲基-5 吡唑啉酮)柱前衍生化法对黑木耳胞外多糖样品进行了单糖组成分析。多糖的水解和衍生化方法参照王媛媛等[13]研究。高效液相检测条件如下:C18 色谱柱;流动相为0.1 mol/L pH 6.5 磷酸缓冲盐∶乙腈(V/V)=85∶15;流速1 mL/min;柱温40 ℃;检测波长250 nm;进样量20 μL。
1.6 动物试验
1.6.1 实验动物分组及处理 将购买的18 只健康CD-1 雌性小鼠饲养在20~22℃、45%~55% RH的无菌洁净环境中,让其自由进食(市售普通饲料),适应性喂养7 d。将其随机分为2 组(每组9只)即试验对照组(Control),黑木耳胞外多糖组(Fermentation-exopolysaccharide,F-P)。将黑木耳胞外多糖用生理盐水配置,然后按照1.5 g·kg-1BW-1进行灌胃处理 (每只小鼠每次给药体积为0.2 mL),连续灌胃21 d;对照组给予等体积的生理盐水处理。
1.6.2 小鼠体重及脏器系数 试验期间每7 d 记录1 次小鼠体重,将两组体重平均值做趋势分析。第21 天,脱臼法处死小鼠后,快速分离肝、脾、心、肺、肾等脏器,脏器用吸水纸吸干后,进行称量和数据采集,最后对脏器系数及安全性进行评估。脏器系数=(脏器质量/体重)×100%
1.6.3 小鼠肠道菌群分析鉴定 灌胃试验结束后(第21 天),无菌采集新鲜粪便0.1 g,放入灭菌管,将待测样品交派森诺生物科技有限公司进行菌群鉴定分析。流程如下:首先提取样品细菌总DNA,然后以微生物核糖体RNA 目标序列为靶点,设计16S rRNA V3-V4 区的特异性引物,等温扩增构建文库。构建好的文库经梯度稀释,利用Illumina MiSeq 测序平台高通量测序。测序结果通过生物信息学方法进行亚基因组分析和肠道微生物区系分析。
1.6.4 小鼠粪便中SCFAs 含量分析 冷冻干燥粪便样品,准确称取50 mg 样品,加入1.2 mL 磷酸盐缓冲液(pH 7.3)混匀,4 ℃14 000 r/min 离心20 min,吸取上清液至5 mL 离心管中。每200 μL 上清加入0.1 mL 的稀释后硫酸(体积分数50%),充分混匀3 min,用2 mL 二氯甲烷(色谱级)进行萃取,4 ℃静置2 h,然后用0.22 μm 有机滤膜过滤。采用气相色谱(GC)检测样品中短链脂肪酸的含量,样品提取方法参照Zhao 等[14]并做部分修改。GC 分析采用常规HP-FFAP (25 m×0.32 mm,0.5 μm)配置柱,程序设定参照贾益群等[15]在生物样品脂肪酸提取与分析的研究结果,并调整其分流比为20∶1。SCFA 标准品溶液的配置以及标准曲线绘制参照孟拓等[16]对气相色谱-质谱联用法分析肠道炎小鼠短链脂肪酸代谢研究结果。
1.6.5 小鼠结肠GPR43 检测 小鼠灌胃21 d 后,脱臼法处死小鼠快速分离肠道交武汉谷歌生物科技有限公司制作石蜡切片。取结肠石蜡切片用二甲苯脱蜡处理,经不同浓度梯度乙醇进行水化处理后用柠檬酸钠抗原修复液95 ℃温育15 min 进行抗原修复,并将其冷却到室温,经3% BSA 室温封闭处理30 min 后用GPR43 抗体4 ℃孵育12 h,之后用FITC 标记的荧光二抗室温避光孵育1.5 h,再用DAPI 室温避光孵育30 min,实施封片并过夜风干,于暗室条件下进行荧光显微镜观察。
1.6.6 小鼠血清细胞因子测定 小鼠灌胃21 d后,通过摘眼球取血,并将血液保存在含有乙二胺四乙酸络合剂(EDTA)的收集管中,4 ℃存放3 h。待自然沉降后,用无菌枪头吸取血清,利用酶联免疫法 (ELISA)测定小鼠血清中IL-6、IL-10 和TNF-α 的含量。试验步骤参照上海茁彩生物科技有限公司ELISA 试剂盒操作说明书。
1.7 统计学分析
试验结果采用Graphpad 5.0 分析软件统计分析,t 检验分析各组间显著性差异,数据以±s 表示,当*P<0.05 时,认为具有显著性差异。
2 结果与分析
2.1 黑木耳胞外多糖红外光谱鉴定
每升黑木耳发酵液能提取多糖244 mg,纯度为85.3%,FT-IR 光谱显示,黑木耳胞外多糖为具有典型β-吡喃糖结构的复杂多糖(图1),官能团分析表明[17],在3 419 cm-1处的宽峰是-OH 伸缩振动吸收峰,2 973 cm-1和2 918 cm-1处的弱吸收带是-CH 伸缩振动吸收峰,1 735 cm-1和1 638 cm-1处的吸收峰表明含有糖醛酸,1 383 cm-1是-CH 弯曲振动吸收峰,1 078 cm-1和1 048 cm-1处的吸收峰是C-O-H 和C-O-C 中的C-O 引起的振动吸收;880 cm-1是β-糖苷键的特征吸收峰。
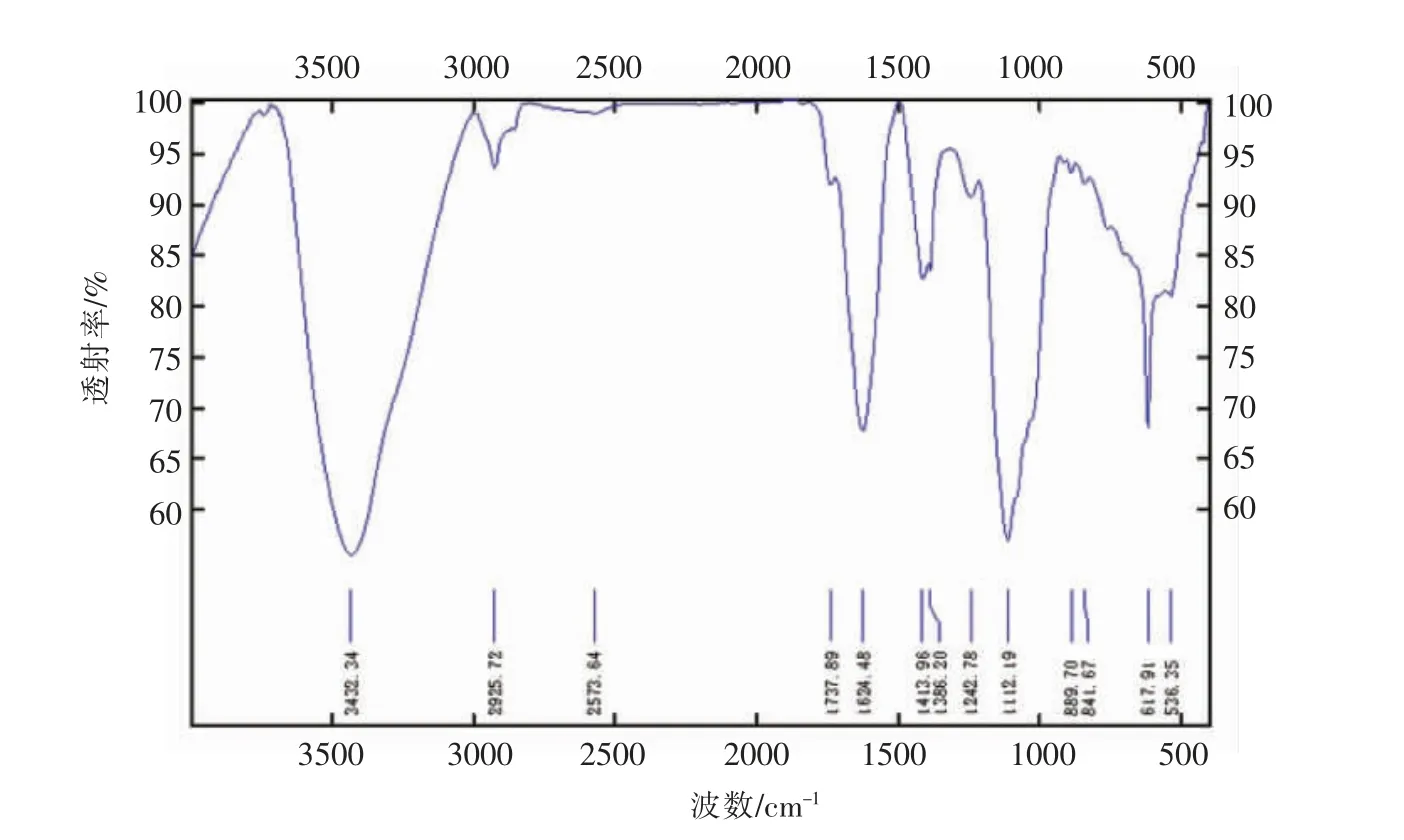
图1 黑木耳胞外多糖在400~4 000 cm-1 FT-IR 光谱图Fig.1 FT-IR analysis of exopolysaccharides from Auricularia auricula-judae fermentation at the range of 400-4 000 cm-1
2.2 黑木耳胞外多糖的单糖组成分析
黑木耳胞外多糖经过酸水解和衍生化后,利用HPLC 分析其单糖组成。结果显示,葡萄糖和木糖为其主要的单糖组分(物质的量比为53.85%和25.05%),还有少量的甘露糖、果糖、岩藻糖、阿拉伯糖和葡萄糖醛酸(表1)。与红外光谱分析结果一致,黑木耳胞外多糖是由多种单糖组分构成的杂合多糖。
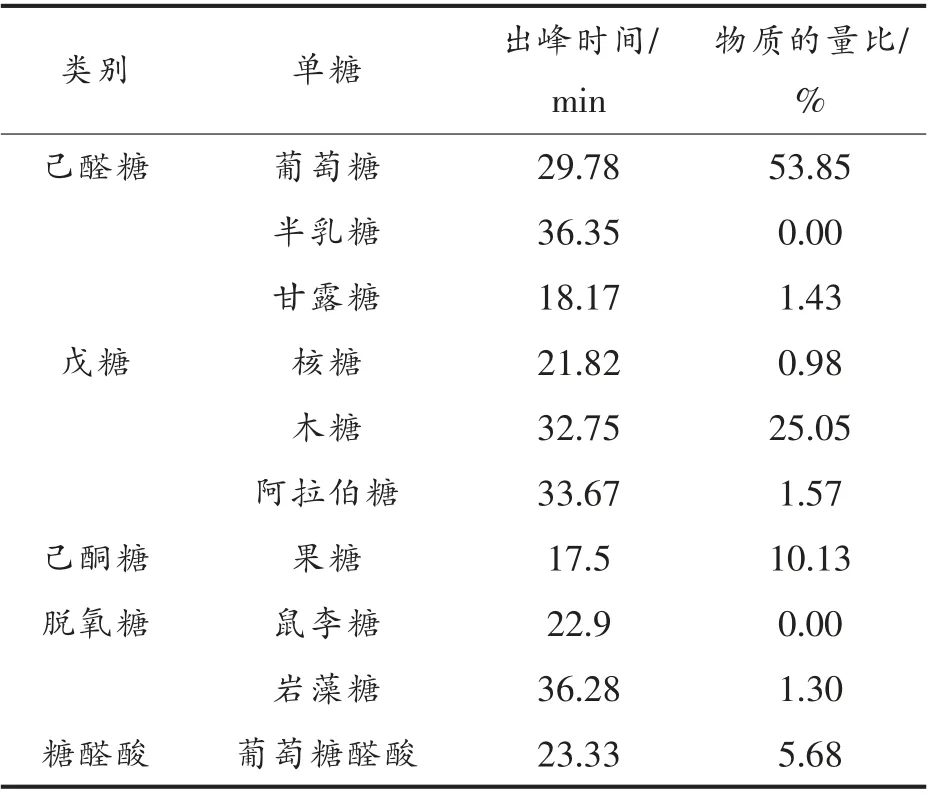
表1 黑木耳胞外多糖的单糖组成分析Table 1 Monosaccharide composition analysis of Auricularia auricula-judae exopolysaccharides
2.3 黑木耳胞外多糖对小鼠体重及脏体比的影响
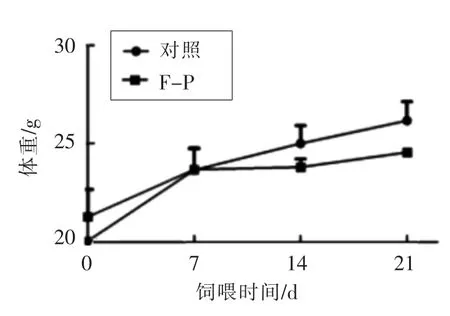
图2 黑木耳胞外多糖饲喂小鼠体重变化趋势图Fig.2 Effects of Auricularia auricula-judae exopolysaccharides on the weight increasing of mice
与对照组相比,灌胃黑木耳胞外多糖后小鼠体重无明显变化(图2)。脏器系数是反映动物器官发育的重要指标,可直观反映受试物对动物存在的毒害作用[18]。本研究通过称量小鼠各脏器组织质量,计算其脏器系数。黑木耳胞外多糖对小鼠脏器系数的影响见表2,统计分析显示,样品组与对照结果无显著性差异(P>0.05)。上述试验表明,灌胃黑木耳胞外多糖不会引起小鼠脏器发生病理性异常。
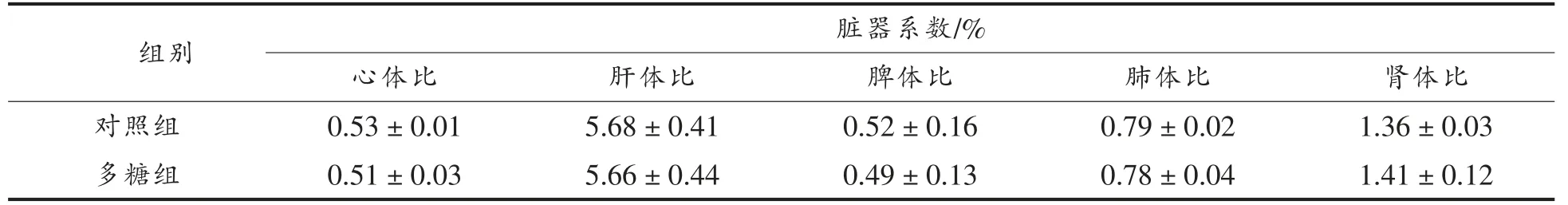
表2 黑木耳胞外多糖对小鼠脏器系数的影响Table 2 Effects of auricularia Auricula-judae exopolysaccharides on the organ coefficients of mice
2.4 黑木耳胞外多糖对小鼠肠道菌群的影响
本试验利用微生物16S rRNA 基因测序技术,探索了灌胃黑木耳胞外多糖小鼠肠道菌群的变化情况。测序所得原始数据经筛选过滤后,对获得的序列进行可操作单元分析(OTU)归并划分,采用Greengenes 数据库进行注释,通过多种多变量统计学分析工具对不同样本(组)微生物群落结构差异进行分析,得到了小鼠肠道微生物16S rRNA 在属水平OTU 序列的相对丰度(图3)。通过Metastats 对样本组间序列量差异的比较检验发现,与对照组相比,拟杆菌属和罗氏菌属显著增加(P<0.05),拟杆菌属在多糖组肠道微生物群中占(10.31±1.5)%,而对照组为(5.4±1.38)%;罗氏菌属在多糖组中占(0.17±0.07)%,而在对照组中未检测到。
2.5 黑木耳胞外多糖对小鼠肠道短链脂肪酸含量的影响
肠道微生物通过膳食纤维的发酵和短链脂肪酸(SCFAs)的产生来提高能量利用率,从而提高宿主代谢效率[19]。本试验将小鼠粪便样品按照1.6.4 节方法进行处理和检测,测定值代入SCFAs标准曲线方程进行含量计算。结果显示,灌胃黑木耳胞外多糖后小鼠粪便中丙酸和丁酸含量显著升高,其中丙酸含量为对照组的3.3 倍(P<0.01),丁酸是对照组的1.4 倍(P<0.05)(图4)。
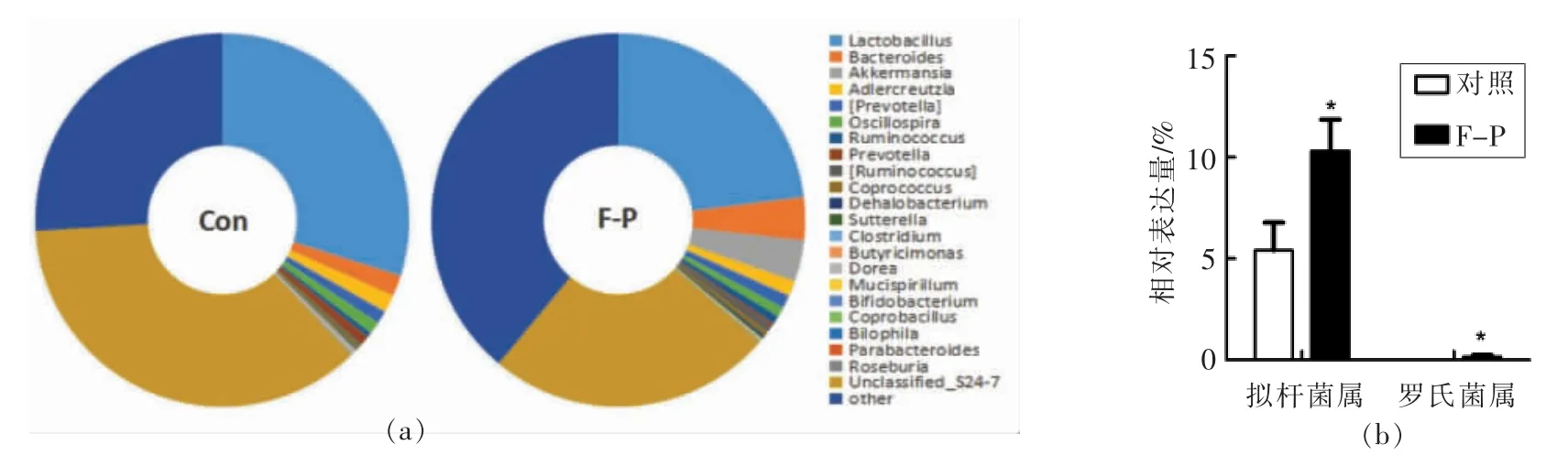
图3 黑木耳胞外多糖饲喂小鼠肠道微生物群落组成情况(属水平)Fig.3 Effects of Auricularia auricula-judae exopolysaccharides on the taxonomic composition abundance of gut microbiota at genus level in mice
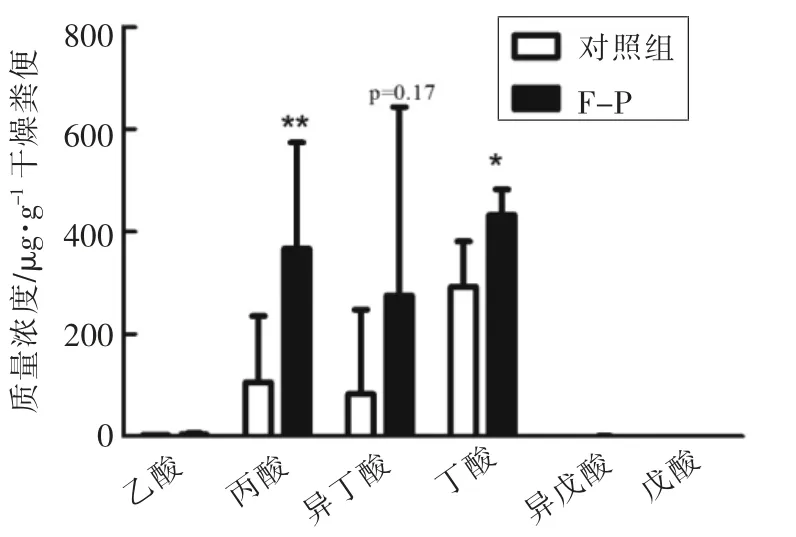
图4 气相色谱法分析小鼠粪便中SCFAs 含量变化情况Fig.4 Quantification of short chain fatty acids (SCFAs)in the fecal samples of mice using gas chromatography
2.6 黑木耳胞外多糖对小鼠肠道GPR43 表达的影响
GPR43 是一种特异性短链脂肪酸受体,它可以通过介导短链脂肪酸,在调控脂类代谢和免疫反应等生物学过程以及在动物肠道对营养物质的吸收中发挥重要作用[20]。本试验对小鼠结肠石蜡切片进行GPR43 免疫荧光检测,结果显示胞外多糖组小鼠结肠GPR43 的表达明显高于对照组。
2.7 黑木耳胞外多糖对小鼠血清细胞因子含量的影响
细胞免疫因子参与了炎症的发生、维持和消退,在机体免疫中起到重要作用[21]。为了探索黑木耳胞外多糖对小鼠免疫调节作用的影响,利用ELISA 试验分析了小鼠血清中的相关细胞因子水平。结果如图6所示,胞外多糖组小鼠血清中白介素-10(IL-10)的含量显著升高,是对照组的1.3 倍(P<0.05),而其对肿瘤坏死因子(TNF-α)和白介素-6(IL-6)的水平没有明显影响(P>0.05)。
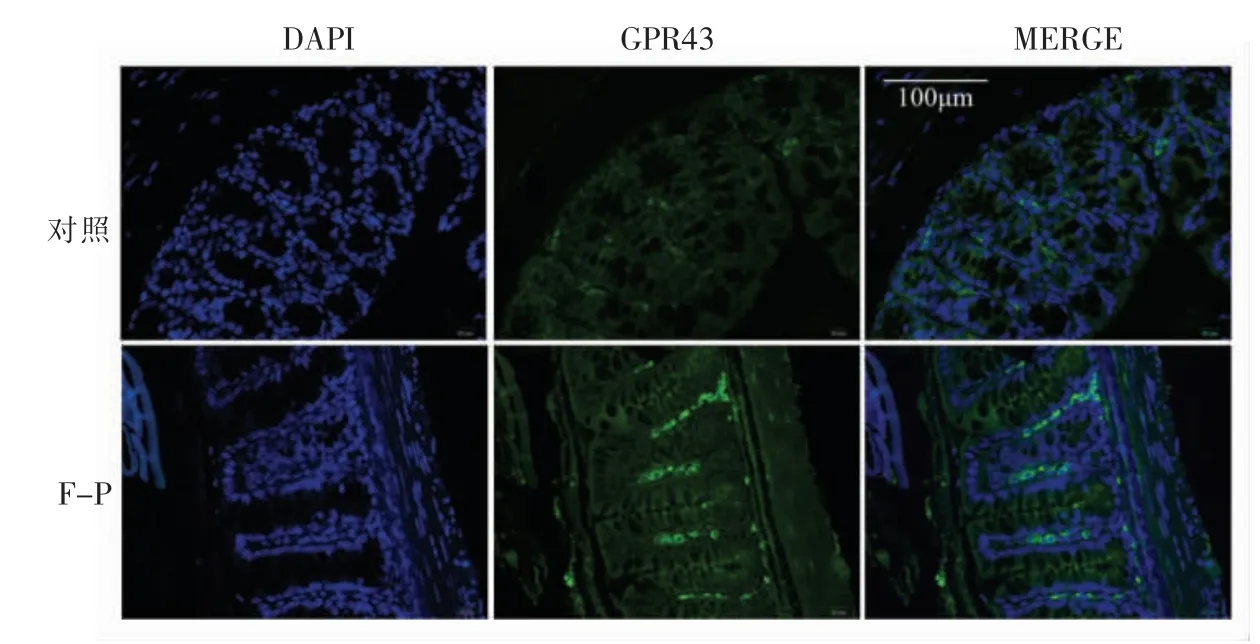
图5 黑木耳胞外多糖对小鼠结肠GPR43 表达水平的影响Fig.5 Expression of GPR43 in colon of mice fed with Auricularia auricula-judae exopolysaccharides
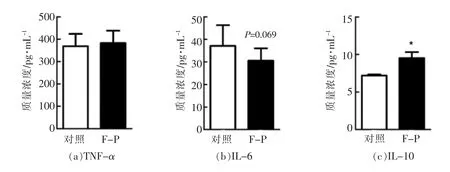
图6 黑木耳胞外多糖对小鼠血清相关细胞因子水平的影响Fig.6 Effects of Auricularia auricula-judae exopolysaccharides on the serum cytokines in mice
3 讨论
黑木耳中的多种生物活性成分对人体健康具有重要调节作用[22]。本研究利用红外光谱和高效液相定性分析了黑木耳胞外多糖的组分;通过小鼠灌胃试验发现黑木耳胞外多糖可以提高小鼠肠道内益生菌拟杆菌属和罗氏菌属水平,增加丙酸和丁酸含量,提升血清免疫因子IL-10 水平。
肠道微生物不仅参与人体能量代谢,还与众多疾病相关,使其成为当前研究热点。随着研究的深入,人们更能清楚地认识到维持肠道菌群平衡对人体健康的重要性[23]。近年,抗生素滥用逐渐引起人们的重视,其破坏肠道正常微生物组成,导致肠道菌群失调,致使耐药性细菌产生和传播[24]。研究发现,多糖具有改善机体肠道微生态的作用,具有益生元作用,是理想的微生态调节剂[25]。本研究结果表明,黑木耳胞外多糖具有促进小鼠肠道内拟杆菌属和罗氏菌属菌群增殖的功能。拟杆菌属能对宿主饮食、宿主肠黏膜层和其它微生物表面的复合多糖进行转运和分解[26];罗氏菌属能够产生短链脂肪酸,尤其是丁酸,不仅具有影响结肠代谢、调节免疫和抗炎等作用,还可用作症状病理学(如胆结石形成)生物标志物或恢复有益菌群的益生菌[27]。因此,作为一种微生态调节剂,黑木耳胞外多糖可以在调控肠道菌群结构方面发挥作用,具有取代抗生素治疗的潜在应用价值。
肠道微生物菌群产生的SCFAs 作为膳食纤维的发酵产物,参与宿主免疫调节[28]。在淋巴B 细胞中,SCFAs 增加乙酰辅酶A 并调节代谢传感器以增加氧化磷酸化、糖酵解和脂肪酸合成,从而产生能量和物质促进抗体产生。此外,SCFAs 可以通过调节相关基因的表达来调控血浆中B 细胞的分化[29]。有研究表明,多糖类物质不被消化道的胃酸和酶类消化,进入肠道后为微生物提供营养源,使其迅速增殖并产生大量SCFAs 和一些抗菌物质,降低肠道内pH 值,抑制肠道内氨和吲哚等有害物质生成,抑制有害菌生长,从而改善肠道微生态[8-9]。本研究发现黑木耳胞外多糖能提高小鼠肠道内丙酸和丁酸含量,具有调节肠道物质能量代谢的作用。
Kang 等[30]研究了枸杞多糖对自发性结肠炎的有益作用及其在IL-10 缺失小鼠中的益生作用,发现枸杞多糖可以提高丁酸盐产生菌罗氏菌属的丰度。IL-10 是一种抗炎细胞因子,在控制免疫反应中起关键作用。在缺失IL-10 的结肠炎和炎性肠病小鼠模型中,巨噬细胞中受损线粒体积累,导致NLRP3 炎性小体激活和IL-1β 产生,引发炎性反应[31]。本研究显示,黑木耳胞外多糖能够提升小鼠血清中免疫因子IL-10 水平,具有抗炎作用。然而,黑木耳胞外多糖对IL-10 的调控机制还不清楚,需要进一步研究阐明。
综上所述,黑木耳胞外多糖能够促进小鼠肠道内有益菌增殖,提高菌群代谢产物SCFAs 含量,增加机体抗炎因子水平,在调节肠道微生态平衡及免疫反应方面具有重要作用。本研究为黑木耳胞外多糖益生菌微生态制剂和新型健康食品的开发提供了理论基础。
