基于分子对接的副溶血弧菌外膜蛋白OmpW天然抑制剂的筛选
2021-04-22刘雪飞吴晓芳张德福牟伟丽李学鹏励建荣
刘雪飞,吴晓芳,祁 悦,张德福,谢 晶,牟伟丽,李学鹏*,励建荣
(1 渤海大学食品科学与工程学院 辽宁省食品安全重点实验室生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州121013 2 上海海洋大学食品学院 上海201306 3 蓬莱京鲁渔业有限公司 山东烟台265600)
副溶血弧菌(Vibrio parahaemolyticus,Vp)是一种革兰氏阴性嗜盐菌,广泛存在于近海岸的海水、海底沉积物和鱼贝类等海洋生物中,不仅引起水生动物的弧菌病,还是我国食源性疾病的首要致病菌之一[1-2]。在一些沿海城市,60%以上的细菌性食物中毒都是由该菌引起[3]。由于一些水产品经高温处理会失去其特有的风味,往往不经热处理直接生食,极大地增加引发食源性疾病的风险,因此研究以非加热方式抑制副溶血弧菌是控制生食水产品引起食物中毒的关键[4]。目前,人们为了减少和防止该菌在水产品中的污染,采取的主要措施是使用消毒剂与抗生素,这种做法存在明显的弊端,例如:抗生素药物残留,细菌耐药性的产生,破坏水生动物体内微平衡以及免疫力[5]。研究发现,多种天然防腐剂具有显著的抑菌活性,可代替化学合成的抑菌剂应用于食品工业中[6]。寻找并开发天然、绿色、高效的抑菌物质越来越受到关注。
革兰氏阴性细菌细胞结构复杂,除了细胞质膜,还有一层参与构成细胞壁的外膜(Outer Membrane)。外膜蛋白(Outer Membrane Protein,OMP)是外膜的主要成分之一,由反向平行的β-折叠通过相邻的氢键结合形成具有长而窄的疏水性通道的β-桶状结构,这些结构可促使外膜蛋白具有很强的稳定性[7]。跨膜的β-桶状结构蛋白通常作为转运蛋白、通道蛋白,协助小分子物质的进出[8]。有研究证实鲍曼不动杆菌外膜蛋白OmpW 是有效的药物靶标[9]。副溶血弧菌外膜蛋白OmpC 是凡尔滨对虾血蓝蛋白LH75 产生抑菌作用的靶点之一[10]。张丹凤[11]经耐药分析等试验,证明大肠杆菌K-12 外膜蛋白TolC 不仅参与药物的外排过程,还参与对外界抗生素的感应。
柠檬酸与咖啡酸均为天然小分子有机物,被广泛应用在食品和医药工业上。柠檬酸对包括雷氏普罗维登菌[12]、嗜水气单胞菌[13]和荧光假单胞菌[13]在内的多种革兰氏阴性菌有抑制作用。咖啡酸及其酯类衍生物除具有抗氧化、抗突变作用外,还可抑制大肠杆菌的生长[14]。国内现有文献多数是从抑制现象上筛选副溶血弧菌的抑菌剂,而很少从分子水平研究抑制作用发生的机理。开发作用于新靶点、具有抑菌新机制且绿色、安全的食源性致病菌抑菌剂迫在眉睫。
分子对接(Molecular Docking)是在Fisher 的受体学说的基础上发展而来的一种利用计算机进行分子模拟的技术,对接时将小分子配体放入受体的活性位点,之后按照能量互补、几何匹配及化学环境互补的原则,对配体与受体相互作用的好坏进行实时评价,找到配体与受体分子间最佳的结合模式(包括合理的位置与构象),这在药物设计上有非常重要的意义[15-16]。分子对接的基础在于已知受体的三维结构,然而,要获得膜结合蛋白的晶体结构十分困难,通过试验方式获得其三维结构具有很大的局限性。现阶段科研领域广泛使用的同源建模(Homology Modeling)是一种重要的预测蛋白质结构和功能的方法,该方法的基本原理即蛋白质的序列同源性决定了蛋白质三维结构的同源性,利用蛋白序列同源的已知结构的蛋白作为模板可以构建一个结构未知的目标蛋白。
本文在上述理论基础上,利用同源建模与分子对接构建副溶血弧菌外膜蛋白OmpW 的三维结构,确定活性部位作为靶标,与柠檬酸和咖啡酸等小分子天然物质对接获得相应的分数,并通过试验研究两种小分子对正常、去外膜、去壁(即原生质体)这3 种状态的副溶血弧菌的抑制效果,分析外膜蛋白OmpW 是否为柠檬酸和咖啡酸的作用位点,为筛选无毒、高效、绿色的抑菌剂用于水产养殖或生食海鲜新型调味品的开发提供参考,同时为寻找新的药物靶点提供一定的理论依据。

表1 耐药株的耐药谱Table 1 Resistant spectrum of drug-resistant strains
1 材料与方法
1.1 试验菌株与试剂
副溶血弧菌(V.parahaemolyticus)ATCC17802、ATCC33847、分离株1(分离自白蛤)、分离株2(分离自鲍鱼)、耐药株1(耐药谱见表1)均为本实验室保存。
3% NaCl APW 培养基、TCBS 培养基购于北京奥博星生物技术有限责任公司。以上培养基均121 ℃灭菌20 min。
Tris、柠檬酸、咖啡酸、EDTA、甘油,购于生工生物工程(上海)股份有限公司;蔗糖、MgCl2、马来酸盐、NaOH,购于天津市风船化学试剂科技有限公司;磷酸盐缓冲液(pH 7.2~7.4),购于武汉普赛诺生命科技有限公司;溶菌酶,购于合肥博美生物科技有限责任公司。
1.2 仪器与设备
PL303 电子天平,梅特勒-托利多仪器(上海)有限公司;PHBJ-206 pH 计,上海仪电科学仪器股份有限公司;GI54DS 高压蒸汽灭菌锅,南京智德丰科学仪器有限公司;ZD-85A 气浴恒温振荡器,金坛市科技仪器有限公司;SPX-250 生化培养箱,宁波海曙赛福实验仪器厂;5804R 高速离心分离机,Eppendorf 中国有限公司;VICTORTM X3 微孔板读数仪,珀金埃尔默仪器(上海)有限公司。
1.3 试验方法
1.3.1 构建副溶血弧菌外膜蛋白OmpW 的同源模型 副溶血弧菌外膜蛋白OmpW 的晶体结构尚未有报道,其氨基酸序列(214aa,GI:1050211542)可以通过NCBI(https://www.ncbi.nlm.nih.gov/)获得,利用该序列在PDB 数据库(http.//www.crsb.org)高级检索的BLAST 找到与之序列相似度最高的蛋白质,以该蛋白为模板,用SWISS MODEL(https://www.swissmodel.expasy.org/)构建模拟的三维模型,建模结果用ULCA(http://servicesn.mbi.ucla.edu/)进行评估。
1.3.2 靶标的确定与分子对接 以模拟的外膜蛋白OmpW 模型作为靶标,用分子模拟软件Discovery Studio 2017R2 处理该蛋白质晶体结构,包括去除水分子、加极性氢原子、能量最小化、构象最优化等。根据之前报道过的蛋白活性位点信息确定活性位点,为后续分子对接做准备。自Pubchem(https://pubchem.ncbi.nlm.nih.gov/)下载小分 子结构,利用DS 软件进行分子对接,得出相应的能量信息和打分函数。打分越高说明受体与配体的相互作用可能越强,可能产生的抑制作用也就越强。
1.3.3 菌种活化及处理 将试验菌株分别接种于3% NaCl APW 中,振荡培养12~18 h,重复传代2次。
参考Xu 等[17]的方法进行菌种处理。将活化的菌液于4 ℃4 000 g 离心10 min 收获菌体,弃上清液,沉淀用0.01 mol/L 的Tris-HCl 缓冲液(pH 7.0)离心洗涤,重复2 次,弃上清液,加入高渗Tris-HCl 缓冲液(pH 7.0)30 mL 使细胞重悬,再加入EDTA 溶液(pH 8.0),使其终浓度为0.01 mol/L,注意滴加的速度,让整个滴加时间控制在20 min 左右。将离心管放入恒温振荡器中于37 ℃100 r/min 振荡20 min,除去副溶血弧菌的外膜层,将1 支离心管置于4 ℃冰箱中,待用。
另一支离心管置于4 ℃ 3 000 g 离心10 min,弃上清液,沉淀用SMM 缓冲液 (包含0.5 mol/L 蔗糖、20 mmol/L 马来酸盐、20 mmol/L Mg-Cl2,pH 6.5)离心洗涤2 次,弃上清液,将沉淀重悬于含1 mg/mL 溶菌酶的SMM 缓冲液中,混匀后置于37 ℃100 r/min 振荡30 min,消化肽聚糖层,再加入3.33 mL EDTA 溶液,摇匀后置于37 ℃温育15 min,制得已除去细胞壁的副溶血弧菌原生质体,将该离心管置于4 ℃冰箱中,待用。
1.3.4 最小抑菌浓度测定 采用二倍稀释法测定最小抑菌浓度(MIC),每支试管依次加入药物溶液500 μL(0.008~32.000 mg/mL),新鲜APW 培养基490 μL 和10 μL 菌液 (包括正常菌:normal bacteria,NB;去外膜菌:Outer membrane deficient bacteria,OMDB;去壁菌:Cell wall deficient bacteria,CWDB)混匀,同时做不含药物的阴性对照以及不含药物和菌液的空白对照。将上述试管在37℃培养24 h,肉眼观察菌体生长情况,不出现浑浊的最小药物浓度即为MIC。
1.3.5 杀菌曲线的测定 采用96 孔板法,每孔加入250 μL 含有不同浓度药物的培养基和2.5 μL菌液(NB/OMDB/CWDB),混匀。同时做不含药物的空白对照,将所有96 孔板于37 ℃静置培养,每隔2 h 测定其在600 nm 处的OD 值。每块96 孔板只测定1 次,以减少杂菌污染的可能。
1.3.6 抑菌作用有效性验证 为了验证药物对副溶血弧菌不同菌株的有效性,测定药物对副溶血弧菌ATCC33847、2 株食品分离株和1 株抗药株的抑制效果。具体操作方法同1.3.4 节。
1.3.7 数据统计分析 采用Excel 2007 处理数据并绘制图表,采用SPSS 19.0 进行差异显著性分析,数据表示方式为平均数±标准差,每个测定项目做3 个平行。
2 结果与分析
2.1 同源建模
目标蛋白在PDB 中的序列对比结果如图1所示,此图只截取同源性大于50%的蛋白,其中2MHL、2F1T 的序列一致性较高。通常情况下,当目标蛋白的氨基酸序列与模板蛋白的氨基酸序列同源性达到30%及以上时,就可以利用此模板来构建目标蛋白的三维结构,且结果具有较高的可信性[18]。图1结果显示,来自于大肠杆菌(Escherichia coli)的外膜蛋白OmpW(PDB ID:2MHL)与目标蛋白序列的一致性达58%以上,这表明二者的同源性很高。另外,其全局模型质量评估(GMQE)分数最高,且蛋白质氨基酸残基的完整性也较高,因此选择2MHL 作为目标蛋白同源建模的模板。以PDB 中2MHL 的三维结构为模板,通过SWISS MODEL 模拟出目标蛋白的三维结构,结果显示目标蛋白同样具有β-桶状结构,用于控制物质的进出。许多抗生素及抑菌分子与孔道蛋白特异性结合,或通过孔道进入膜内发挥抑菌作用[19-20]。
OmpW 的建模结果中有78.0%的残基落入最佳区域(Favoured region),16.8%的残基落入许可区域(Allowed region),这说明该模型是较为合理的。残基中GLN24、ASN39、LYS44、LEU46、GLU50、THR58、PRO115、PHE137 落入异常区域(Outlier region),但这些残基多位于蛋白的外表面,距活性中心较远,对后续的分子对接无直接影响。

图1 副溶血弧菌OmpW 同源模板的搜寻结果Fig.1 Search of homologous sequences of OmpW of V.parahaemolyticus
2.2 分子对接
根据文献报道选择5 种具有抑菌作用的小分子作为筛选对象,从Pubchem 下载这些小分子的结构,并作为配体进行对接,最佳构象的打分结果如表2所示。结果表明,在这5 种天然植物源小分子中,咖啡酸和柠檬酸的打分较高,这说明咖啡酸和柠檬酸与副溶血弧菌OmpW 的相互作用较强,可能产生的抑制作用也更强。
DS 软件搜寻的潜在活性位点共有6 个,如图2所示。据Soojhawon 等[9]的研究结果,靠近周质空间且位于桶状结构内侧的位点(Site2)是最有可能的活性位点。在该位点与咖啡酸对接时,咖啡酸的O 和受体蛋白中ASP26 的O 产生了一个不利的相互作用(Unfavorable interaction),因此选用同样位于桶状结构内侧的Site1 作为与咖啡酸对接位点,Site2 作为与柠檬酸对接的位点,且结果较为理想。
图3显示的是柠檬酸与外膜蛋白OmpW 模型的对接结果及产生的相互作用。图3a 显示了柠檬酸在与受体蛋白结合时的状态与位置,显然两个小分子处在相对疏水的桶状结构内侧。如图3b所示,柠檬酸与外膜蛋白OmpW 中的氨基酸残基TYR111、ASN174、ARG30、VAL28 形成了5条经典氢键(Conventional hydrogen bond),这些氢键的氢供体和受体之间的距离均小于或接近于3Å,且DHA 和HAY 角均落在90°~180°之间,表明很可能形成了强氢键[21-22]。而柠檬酸与GLY65、SER73 形成2 条非经典的CH...O 氢键(Carbon hydrogen bond),尽管比经典氢键作用弱,但在蛋白质-配体的结合中也起到一定作用[23]。除了氢键,ARG30 侧链的NH2还与柠檬酸的O 产生静电相互作用(Attractive charges)。此外,图3b 显示出配体与TYR122、ASP164 等8 个氨基酸残基产生了范德华相互作用。

表2 分子对接打分结果Table 2 Results of molecular docking scoring
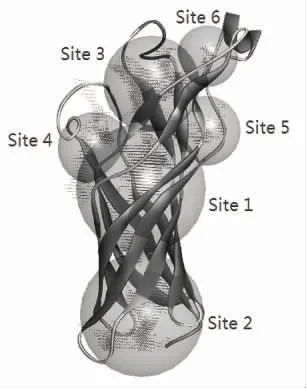
图2 DS 软件定义的OmpW 潜在活性位点Fig.2 Potential OmpW active sites defined by DS software
咖啡酸与受体蛋白产生的相互作用主要有氢键、疏水相互作用和范德华相互作用,见图4。咖啡酸中酚羟基的H 与THR105 侧链上-OH 的O、羧基的O 与MET207 形成强氢键,同时羧基上的另2 个O 分别与蛋白的ALA177 和TRP178 形成弱氢键。咖啡酸的苯环与TRP178 的两个π 环(包括但不仅仅包括芳香环)均有相互作用,π 轨道产生堆叠效应(Pi-Pi T-shaped)。此外咖啡酸还与两个非极性的氨基酸残基ALA34 和VAL205 产生另一种类型的疏水相互作用(Pi-Alkyl)。疏水相互作用以及疏水与亲水的平衡是维持蛋白质-配体结构稳定的主要作用力之一[24]。此外,咖啡酸还与SER35、PHE82 等8 个氨基酸残基之间存在范德华力。
上述提及的均为非键相互作用,与共价键相比,非键相互作用非常弱,但是它们的累积和堆叠效应是巨大的,对配体与蛋白的结合以及蛋白质-配体的构象稳定起到至关重要的作用[24]。
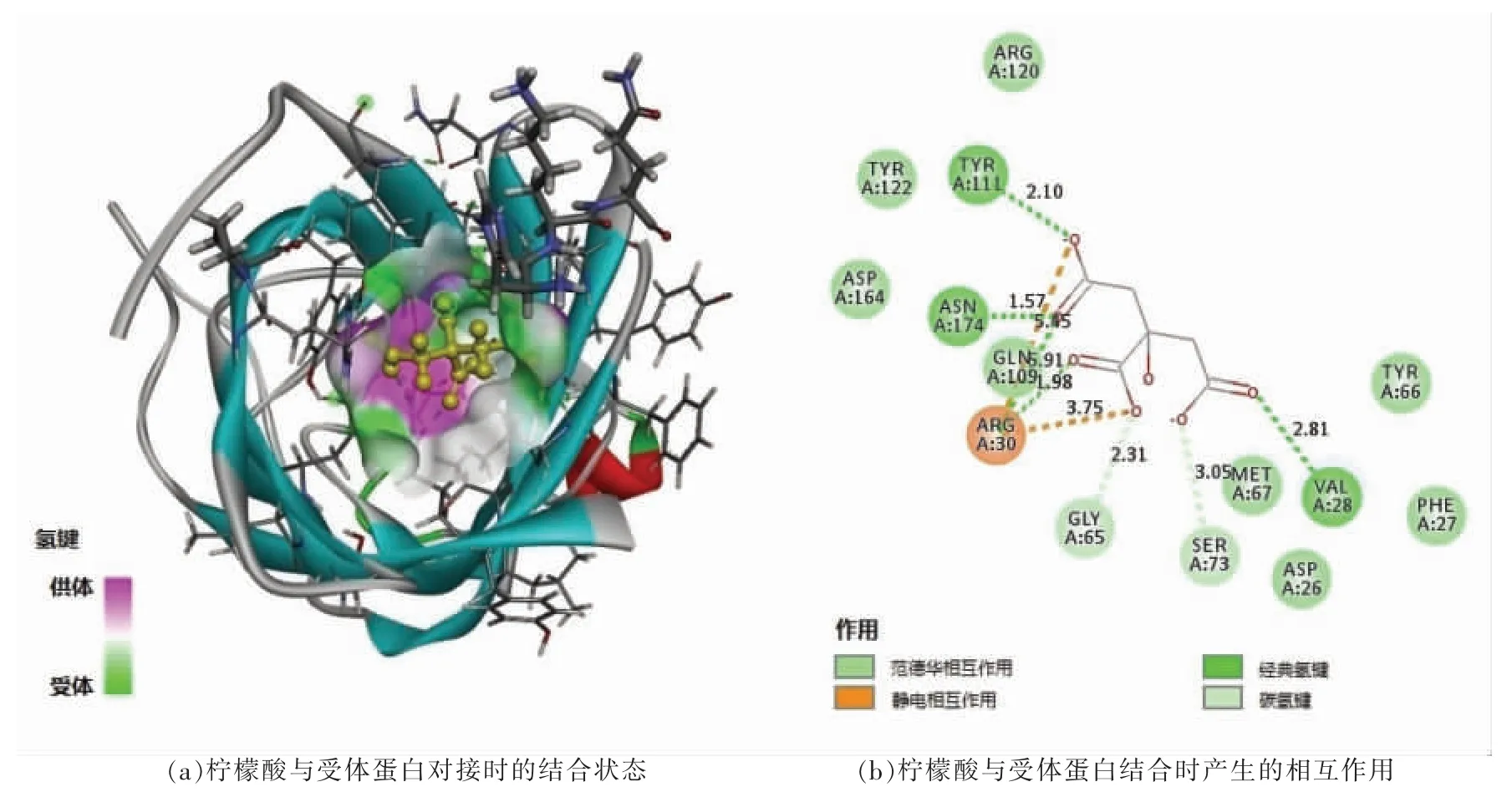
图3 柠檬酸与OmpW 模型对接结果Fig.3 Docking results of citric acid with OmpW model
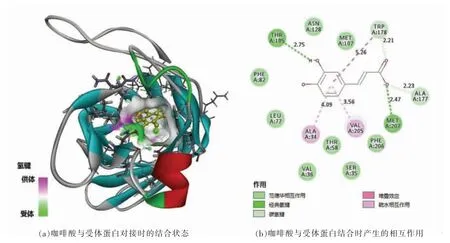
图4 咖啡酸与OmpW 模型对接结果Fig.4 Docking results of caffeic acid with OmpW model
2.3 最小抑菌浓度
由表3结果可知,柠檬酸与咖啡酸对副溶血弧菌ATCC17802 均有抑制作用。去外膜和去壁处理增加了副溶血弧菌ATCC17802 对柠檬酸与咖啡酸的敏感性,其MIC 分别减小为原来的1/16 和1/64,这说明抑制剂确实与外膜蛋白OmpW 产生了相互作用,并可能使之失去原有的生理功能(控制物质进出等)。另外,有研究表明外膜蛋白与周质空间和内膜的蛋白形成复合物体系,这一体系可能对药物进行外排,而失去了外膜甚至细胞壁后,没有体系的外排作用,敏感性明显增强[25]。
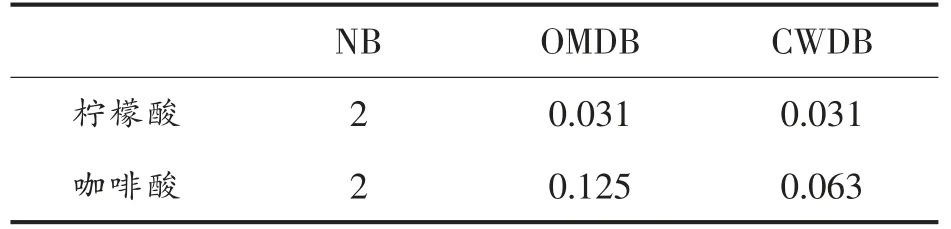
表3 柠檬酸与咖啡酸对副溶血弧菌ATCC17802 的MIC(mg/mL)Table 3 MIC of citric acid and caffeic acid on V.parahaemolyticus ATCC17802 (mg/mL)
2.4 杀菌曲线
不同浓度的柠檬酸与咖啡酸对副溶血弧菌ATCC17802 3 种状态菌体的抑制情况通过杀菌曲线的形式加以分析。图5结果表明,当柠檬酸浓度为副溶血弧菌ATCC17802 正常菌体MIC 的1/64和1/32 时,对于正常菌体几乎没有抑制作用,而对于去外膜和去壁的菌体却能够完全抑制其生长,24 h 内OD600nm的上下波动均不超过0.2,这与柠檬酸对不同菌体MIC 测定结果相一致。当柠檬酸浓度达到MIC 和2 MIC 时,3 种状态的菌体均受到很大程度的抑制,只有未加柠檬酸的空白组呈现出正常的生长曲线。Ye 等[26]发现,在浓度为1/2 MIC 的硫酸新霉素的作用下,阪崎肠杆菌ΔOmpW 缺失株的存活率明显低于野生型菌株,且缺失株生物膜形成率的下降幅度大于野生型菌株。彭志锋等[27]通过微量稀释法测定多种抗菌药物对鸭源鸡杆菌亲本菌株RU 和突变株ΔOmpW的MIC,结果显示,相对于RU,土霉素和四环素对ΔOmpW 的MIC 值分别降低到1/8 和1/32,这些结果说明,外膜β-桶状蛋白很可能就是抑菌剂作用的位点。
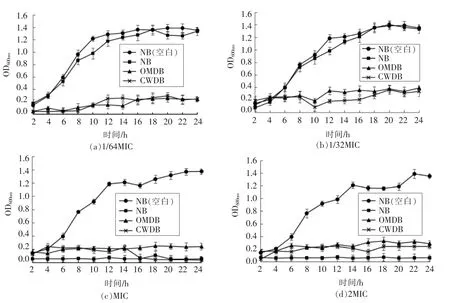
图5 不同浓度的柠檬酸对副溶血弧菌ATCC17802 的杀菌曲线Fig.5 Killing curves of V.parahaemolyticus ATCC17802 under different concentrations of citric acid
图6结果表明,当咖啡酸浓度为副溶血弧菌ATCC17802 正常菌体MIC 的1/16 或1/8 时,正常菌体几乎没有受到任何抑制作用,与空白对照相比OD600nm相差不大(P>0.05),曲线呈S 型。而去外膜和去壁的菌体却几乎完全被抑制,这同样与咖啡酸对不同菌体MIC 测定结果相一致。当咖啡酸浓度增加到MIC 或2MIC 时,3 种状态的菌体均受到抑制,只有未加咖啡酸的空白组呈现出正常的生长曲线。有研究表明对茶多酚具抑菌活性起重要作用的是茶多酚分子内的多个酚羟基。酚羟基可与蛋白质分子中的氨基或羧基发生结合反应,其疏水性的苯环也可以与蛋白质发生疏水结合反应,而茶多酚与蛋白质之间的结合作用阻断了细菌的侵染路径,故而能够抑菌[28]。而咖啡酸有2 个相邻的酚羟基,这2 个酚羟基可能是咖啡酸的2个活性基团,与副溶血弧菌外膜β-桶状蛋白通道中的疏水基团相互作用,起到抑菌作用,这在分子对接时已经体现。
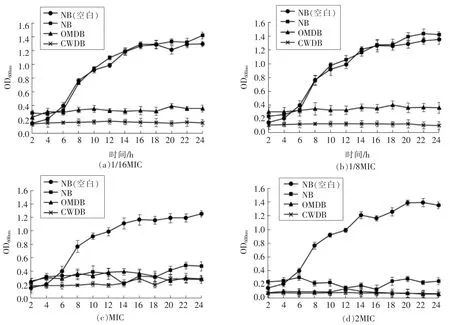
图6 不同浓度的咖啡酸对副溶血弧菌ATCC17802 的杀菌曲线Fig.6 Killing curves of V.parahaemolyticus ATCC17802 under different concentrations of caffeic acid
2.5 有效性验证
表4结果显示,柠檬酸和咖啡酸对副溶血弧菌ATCC33847、分离株1(白蛤)、分离株2(鲍鱼)以及耐药株均有抑制作用。且去外膜和去壁之后,MIC 均显著减小,该结果与测定的副溶血弧菌ATCC17802 的MIC 规律一致。Lin 等[29]的研究结果也表明,从大肠杆菌中删除OmpW 引起几种抗生素的MIC 降低,OmpW 可能是革兰氏阴性细菌的潜在药物靶标[30],柠檬酸和咖啡酸的作用位点极可能是副溶血弧菌OmpW。
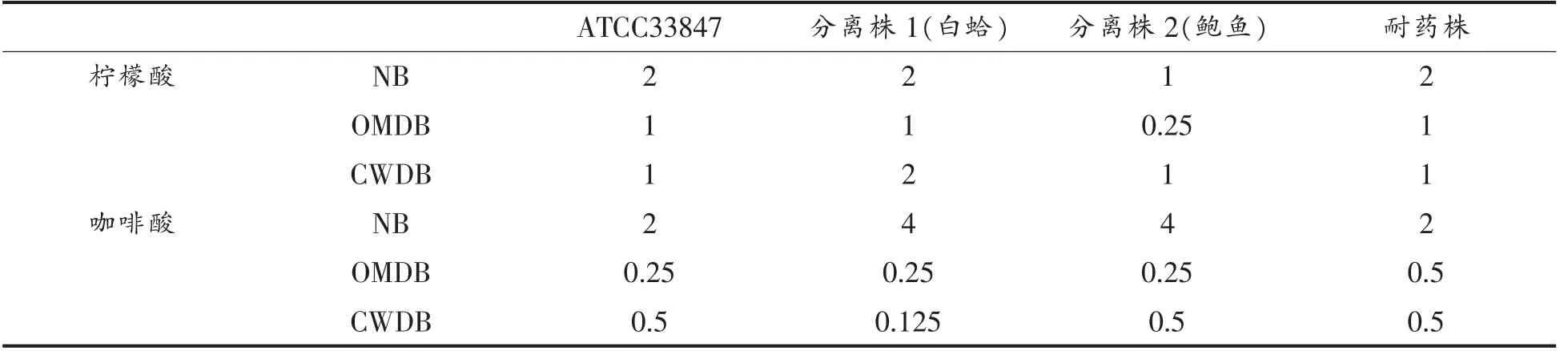
表4 柠檬酸和咖啡酸对4 种菌株类型的副溶血弧菌的MIC(mg/mL)Table 4 MIC of citric acid and caffeic acid against four kinds of strains of V.parahaemolyticus (mg/mL)
3 结论
本研究结果表明,以分子对接技术为基础筛选副溶血弧菌抑菌剂的方法可行。柠檬酸和咖啡酸对副溶血弧菌的抑菌效果较理想,MIC 均为2 mg/mL。此外,柠檬酸和咖啡酸的作用靶点位于副溶血弧菌外膜上β-桶状蛋白OmpW 的可能性很高,去外膜和去壁菌体的MIC 和杀菌曲线测定结果均证实了外膜对于菌体对抗小分子抑菌剂的重要作用。但还需要更深入地对抑菌剂与外膜蛋白OmpW 的相互作用进行生物物理表征,以证实其作为潜在药物靶标的作用。
