掺锶磷酸钙骨水泥材料生物学性能的动物实验
2021-04-22王京旗
王京旗,王 霄
(1.北京大学第三医院口腔科, 北京 100191; 2.海南医学院第二附属医院口腔科, 海口 570311)
牙周病是口腔两大类主要疾病之一,在世界范围有较高的患病率。重度牙周炎已成为全球第6大疾病,是导致成年人牙齿丧失的主要原因。牙周病的特征性损害是牙齿周围牙槽骨的吸收,从而进一步导致牙齿松动、移位,甚至脱落。牙周病治疗的重要目标是使被牙周病破坏的牙周附着再生,形成新的牙槽骨、牙骨质及功能性排列的牙周韧带,更好地恢复牙齿的生理功能。而在上述牙周组织重建过程中,牙槽骨再生是最重要的,因为牙槽骨的高度决定了牙齿的松动程度。目前所使用的引导组织再生技术是在缺损的牙槽骨部位填充骨粉或相应的骨替代材料,引导骨组织的再生以及牙周组织的再生。常用的牙槽骨缺损修复材料(如骨粉)大多为颗粒状或块状,而牙周炎形成的骨缺损形态极为复杂,一旦形成水平缺损则很难以颗粒状的材料修复,并且大多数人工合成材料抗水性能不足,从而导致引导组织再生术的手术适应证很有限,限制了骨粉的应用。
传统的磷酸钙骨水泥(calcium phosphate cement,CPC)具有一定的可塑性,通过两种或两种以上磷酸钙粉末加上调和剂,调成糊状后置入修复部位,最终可自行转化为与人体骨结构相似的羟基磷灰石,但在临床使用中CPC存在一些缺点,主要表现在抗水性能不足,抗压性能差(固化反应后可达到最大的抗压强度只有30~40 MPa,有的仅为5 MPa),且固化时间长,一般需要30 min才能固化成型,不便于手术操作。
本研究研发的骨替代材料是一种新型的掺锶磷酸钙骨水泥,通过改良材料的粉剂、液剂的成分与分布,以提高传统CPC的物理机械性能,其中固化体抗压强度拟提高至35 MPa及以上,凝固时间缩短(15~20 min),同时提高抗溃散性流动性及可注射性。锶(Sr)是人体中存在的一种微量元素,Sr与Ca同族,具有许多相似的性质,已有研究表明[1-2],锶同时具有抑制骨吸收和促进骨形成的双重作用。将锶掺入磷酸钙骨水泥中,获得含锶磷灰石产物,既可保持骨水泥诸多优点,又可充分发挥锶的生物学性能,抗压强度高,稳定性好,同时具有良好的生物相容性,可引导骨的再生。
本课题组前期已通过体外实验证实本材料无细胞毒性[3],具有良好的生物相容性。同时,材料的抗压强度高,稳定性好,可以在手术中短时间内成型、固化,使材料可以稳固地存在于所需骨缺损位置,形成所需要的形态,并保持稳定,具有良好的空间维持能力和机械稳定性。本研究通过构建兔后腿股骨外侧髁骨缺损动物模型,对新型磷酸钙骨水泥CPC的生物相容性以及成骨效果进行组织学评价,从而为临床的进一步应用提供实验数据。
1 材料与方法
1.1 实验动物
新西兰大白兔,雄性,6月龄,体质量3.0~3.5 kg,共30只,由北京芳缘动物养殖场提供。
1.2 主要实验试剂
4%(体积分数)多聚甲醛购自北京索莱宝有限公司,磷酸盐缓冲液购自福州迈新生物技术开发有限公司,山羊血清购自北京金杉中桥生物技术有限公司,COL-Ⅰ和BMP-2单克隆抗体均购自美国Abcam公司,DAB显色试剂盒购自北京索莱宝有限公司,胰蛋白酶、胃蛋白酶和鼠兔通用型二抗均购自福州迈新生物技术开发有限公司,Bio-Oss骨粉购自瑞士Geistlich公司。
1.3 主要仪器设备
ASP200 自动脱水机、石蜡切片刀片和石蜡组织切片机均购自德国Leica公司,电烤箱购自上海福玛实验设备有限公司,光学显微镜(BX61)和体视显微镜均购自日本OLYMPUS公司,电热恒温干燥箱购自天津泰斯特仪器有限公司,生物组织包埋机购自孝感宏业医用仪器有限公司。
1.4 实验设计和分组
实验动物为新西兰大白兔,共30只。以其双后腿外侧髁(60个)为实验对象,随机分为CPC组、CPC+Bio-Oss组、Bio-Oss组、空白对照组4组。在兔双侧后腿外侧髁制造骨缺损模型,按组别分别植入CPC、Bio-Oss骨粉、CPC+Bio-Oss混合物(CPC与Bio-Oss质量比为4 ∶1)。实验动物分别在手术第4周、第12周、第24周处死。
1.5 材料制备
CPC组:将新型磷酸钙骨水泥材料按粉液质量比2 ∶1调配,注入直径6 mm,深7 mm的圆柱形模具中(材料、模具均由北京安泰生物医用材料有限公司提供), 固化20 min后取出,紫外线灭菌2 min后无菌存放。
CPC+Bio-Oss组:方法同上,其中CPC与Bio-Oss质量比为4 ∶1。
Bio-Oss组:手术中Bio-Oss骨粉直接植入骨缺损。
1.6 手术方法
0.5%(质量分数)戊巴比妥耳缘静脉注射全身麻醉,剂量0.1 mg/kg。取股骨下端外侧髁为术区,待麻醉药生效后,备皮消毒。将兔后腿弯曲,于髌骨下端1 cm处做3 cm长纵向切口,切开皮肤、皮下筋膜,分离骨膜,生理盐水冲洗,用直径5 mm的轮状车针制备直径6 mm、深7 mm圆形骨缺损,按照分组植入相应材料,与骨面平齐。分层严密缝合骨膜及软组织。肌肉注射40万U青霉素G 1 mL。
术后第4周、第12周、第24周各处死动物10只,取材(缺损植入区及周围5 mm骨组织)进行相关检测。
1.7 观察指标
1.7.1组织形态学观察 将动物处死后,剥离骨缺损区周围软组织,切锯股骨下端3 cm骨组织,4%(体积分数)多聚甲醛溶液4 ℃固定1周。从固定液中取出固定组织,EDTA脱钙液脱钙8周后将组织分切(保留缺损植入区及周围5 mm骨组织),继续脱钙8周,进行30%~100%梯度乙醇溶液(酒精)脱水,二甲苯透明,浸蜡,石蜡包埋,制作4 μm连续组织切片, HE染色。各组各时间点光学显微镜下观察切片,并在每一个切片内选择10个区域。利用图像分析软件Image-Pro Plus(Media Cyber-netics,美国)分析测量新骨生成率(bone ingrowth fracion, BIF,BIF=新骨面积/骨缺损面积×100%)。
1.7.2免疫组织化学染色观察 取术后4周标本常规石蜡切片,脱蜡水化后PBS(pH=7.4)洗5 min,共3次。滴加胃酶修复液,37 ℃烤箱修复15 min,PBS洗5 min,共3次。滴加 3%(质量分数)过氧化氢,室温下避光孵育15 min,PBS洗5 min,共3次。10%(体积分数)山羊血清37 ℃封闭30 min,擦干周围血清。滴加BMP-2单克隆抗体(1 ∶250),4 ℃过夜,PBS洗5 min,共3次。滴加二抗,37 ℃下孵育30 min,PBS 洗5 min,共3次。滴加新鲜配置的DAB溶液显色,光镜下控制显色时间。苏木素复染,冲洗,梯度乙醇溶液脱水,透明,中性树胶封片。于光学显微镜下观察,每一个切片内选择10个区域,以细胞质或细胞间质出现黄染为阳性标记,利用图像分析软件Image-Pro Plus测定免疫组织化学染色图像阳性区域的平均光密度(mean optical density,MOD)。
1.8 统计学分析
应用SPSS19.0统计软件,计量资料采用单因素方差分析,组间差异多重比较采用LSD检验,P<0.05认为差异有统计学意义。
2 结果
2.1 大体标本观察
术后定期观察动物饮水、进食、活动,注意伤口有无肿胀、化脓、积液等炎性反应。实验动物术后1 h苏醒,1 d后饮水进食活动及情况正常,伤口均一期愈合,无意外死亡,未见骨折。
第4周时,肉眼观察植骨部位未见材料暴露,软组织未见积液、脓肿等免疫排斥及感染迹象。骨缺损边界可辨认,有纤维包膜覆盖,植骨处较周围骨质略凹陷。CPC组、CPC+Bio-Oss组、Bio-Oss组均可见材料开始降解,少量新生骨覆盖;空白对照组骨缺损区纤维包膜下尚无骨质形成。第12周时,CPC组、CPC+Bio-Oss组、Bio-Oss组材料大部分降解,大量新生骨长入;空白对照组骨缺损处肉芽组织覆盖,周围少量皮质骨形成,仍较周围骨质凹陷。第24周时,CPC+Bio-Oss组、Bio-Oss组股骨外侧髁骨缺损区被新生骨质完全覆盖;CPC组骨缺损处大部分新生骨质覆盖,骨缺损边界模糊;空白对照组骨缺损处较周围骨质略凹陷。
2.2 组织形态学观察
第4周(图1):CPC组可见植入物与原有骨组织的交界处有少量新骨形成,残留材料被新生骨包绕,成骨细胞活跃,呈极性成排排列,成骨细胞旁可看到粉染的类骨质;Bio-Oss组可见较多新生骨小梁向骨缺损中心区长入,Bio-Oss颗粒孔隙周围可见新生骨,里侧为胶原纤维结构,钙盐逐渐向外沉积,形成骨基质;CPC+Bio-Oss组骨缺损自边界至中心可见不规则的骨小梁长入,稀疏,部分连接,骨小梁间可见骨髓细胞与脂肪细胞,植入物孔隙周围出现活跃的成骨细胞,并有骨陷窝形成,骨陷窝内见骨细胞;空白对照组骨缺损边界清晰,胶原纤维沿边界束状排列,可见大量纤维细胞。
第12周(图1):CPC组骨缺损周边部材料降解吸收明显,可见较多新生骨小梁,并向骨缺损中心区长入,由内向外可见纤维结缔组织逐渐转化为骨基质;Bio-Oss组可见骨粉孔隙已长入新骨,呈纤维编织状,大量骨陷窝分布,骨陷窝内见骨细胞;CPC+Bio-Oss组骨缺损中心见更多新生骨小梁生长延伸,类骨质向成熟骨组织转化;空白对照组骨缺损周边可见少量无序的新生骨形成。
第24周(图1):CPC组缺损周边部可见更多新生骨小梁,并向骨缺损中心区长入,新生骨组织进一步增多,但中心区仍可见小范围的空白区;Bio-Oss组和CPC+Bio-Oss组骨缺损区已完全被新生骨组织充满,新骨、旧骨结合线模糊,可见编织骨转变为板层骨,骨小梁塑形改建有序排列;空白对照组骨缺损处边界仍清晰,少量新生骨在骨缺损边缘形成。
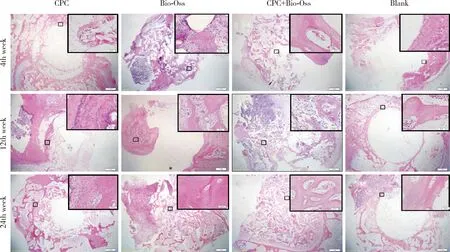
图1 各组标本HE染色结果(×12.5,×200)Figure 1 Histological sections at different time points of each group bone ingrowth fraction(×12.5,×200)
整个植入期CPC组、CPC+Bio-Oss组、Bio-Oss组3组植入物与周围骨组织结合紧密,未引起骨缺损区的炎性反应,未见骨组织坏死。
在不同时间点,CPC组、Bio-Oss组、CPC+Bio-Oss组及空白对照组的新骨生成率不同(P<0.01),其中,CPC组、Bio-Oss组、CPC+Bio-Oss组的BIF均高于空白对照组(P<0.01); CPC组BIF低于Bio-Oss组(P<0.01),也低于CPC+Bio-Oss组(P<0.01);CPC+Bio-Oss组与Bio-Oss组相比差异无统计学意义(图2)。

*P<0.01.图2 各组不同时间点新骨生成率比较Figure 2 Bone ingrowth fraction (BIF) at different time points of each group
2.3 免疫组织化学染色结果
免疫组织化学染色发现(图3),第4周CPC组、Bio-Oss组、CPC+Bio-Oss组的MOD均高于空白对照组(P<0.01);CPC组MOD低于Bio-Oss组(P<0.01), 也低于CPC+Bio-Oss组(P<0.01),CPC+Bio-Oss组与Bio-Oss组相比差异无统计学意义(表1)。

表1 第4周各组BMP-2与 COL-Ⅰ免疫组织化学染色平均光密度Table 1 MOD of BMP-2 and col-Ⅰ immunohistochemical staining of histological sections at the 4th week
3 讨论
骨替代材料的成骨能力表现为骨生成性、骨诱导性和骨传导性3种特性。常用的骨替代材料包括自体骨、同种异体骨、异种骨和人工合成材料等。自体骨兼有骨诱导性和骨传导性,并且携有成骨作用的骨髓细胞,成骨效果最好,但是自体骨来源有限,且取骨可能增加术后感染的风险。异体骨移植存在难以成形及可能传播疾病等问题。异种骨主要是牛松质骨,由于其结构与人类松质骨非常类似,有着很好的生物相容性和骨传导性[4-5]。

A, immunohistochemical staining of each group at 4th week(×40,×200); B, MOD of BMP-2 in each group; C. MOD of COL-Ⅰ in each group. *P<0.01.图3 第4周时各组BMP-2和COL-Ⅰ蛋白表达情况Figure 3 BMP-2 and COL-Ⅰ immunohistochemical staining of histological sections and at 4th week
近年来Bio-Oss骨粉作为异种骨在临床中应用广泛,它多取自于牛骨,为天然骨无机材料,它的化学成为碳酸盐磷灰石结晶体,可被吸收,颗粒直径0.25~1.00 mm,与人体骨的结构几乎相同,能够在各个方向上引导骨再生,具有良好的骨引导性和成骨能力[6-7]。作为国际认可的骨替代材料,很多动物实验和临床研究证明Bio-Oss完全符合骨引导材料的标准[8-10],因此本实验选择设立Bio-Oss骨粉组,对于新型磷酸钙骨水泥的生物学性能检测具有重要的参考意义。但是Bio-Oss骨粉在临床操作中也存在一些缺陷,由于其形态为颗粒状所导致的不可塑性,难以配合牙周手术中骨缺损的不规则性,导致手术难度增加。本课题研发的新型磷酸钙骨水泥材料CPC具有可注射性[3],并可在一定时间内固化成形,加入一定量的Bio-Oss骨粉后依然可以保持这种材料学特性,充分发挥了骨水泥的可塑性能,可有效改善Bio-Oss骨粉在临床操作中不便等缺陷。
本研究发现,CPC在整个植入期与周围骨组织结合紧密,无纤维组织间隔,同时均未引起骨缺损区的炎性反应,提示CPC具有良好的生物相容性。新骨形成率即新生骨占骨缺损的面积比,是一种常用的新骨半定量分析的指标[11-12]。研究表明生物学因素在新骨形成早期起主要作用,在骨缺损愈合中,骨形成早期的调控作用影响着骨缺损的整个修复过程,进而决定着骨缺损愈合的速度与质量[13-14]。BMP-2和COL-Ⅰ与新骨形成密切相关,在新骨形成早期,BMP-2 主要在骨髓腔基质、增生的骨膜和骨缺损部位的软组织内活性表达最高[15]。COL-Ⅰ是骨基质中最主要的纤维胶原成分,可为钙盐沉积与细胞附着提供支架[16]。当骨缺损出现后,BMP-2会在前3周表达逐渐增强,第3周达到峰值,第4~5周时仍保持此高度,第5周后明显下降,直至正常水平[17-18]。而COL-Ⅰ在第2周时表达增强,在第4周时仍保持一个明显的表达高度,第4周后明显下降。故本研究采用此两项指标在第4周时的表达情况反映不同组之间骨组织的新生情况。本研究发现,术后第4周、第12周、第24周CPC组、CPC+Bio-Oss组BIF均高于空白对照组(P<0.01),且第4周时CPC组、CPC+Bio-Oss组BMP-2和COL-Ⅰ表达均高于空白对照组(P<0.01), 提示CPC、CPC+Bio-Oss组可以促进早期成骨,成骨效果稳定,长期有效。
本研究发现CPC组BIF低于Bio-Oss组(P<0.01),也低于CPC+Bio-Oss组(P<0.01),提示CPC成骨效果和Bio-Oss骨粉相比仍有一些差距,这可能与二者的孔隙不同有关。材料中孔隙的存在为成骨提供了适宜的空间,材料的孔隙大小应满足骨单位和骨细胞生长所需的空间。Dahl等[19]发现当材料孔径为5~40 μm时,允许纤维组织长入;孔径为40~100 μm时,允许非矿化的骨样组织长入;孔径在150 μm以上时,可为骨组织的长入提供理想场所。孔隙率是另一个影响材料成骨效果的重要因素,孔隙率越大,材料的比表面积越大,与周围骨的接触面积也越大,有利于细胞的黏附和生长。本课题组研发的新型磷酸钙骨水泥材料的孔径为 80~150 μm,孔隙率为40%,而Bio-Oss骨粉的孔径约750 μm,孔隙率约65%,这两个指标的差异可能是造成CPC组BIF低于Bio-Oss组的原因。CPC+Bio-Oss组和Bio-Oss组BIF差异无统计学意义,提示加入CPC可能不会改变Bio-Oss的成骨能力,同时却可改善Bio-Oss的理化特性,增加抗压强度,提高可塑性与抗溃散性,适应不规则形态的骨缺损,进而提高临床操作性能。
综上所述,本研究通过构建兔后腿外侧髁骨缺损动物模型,检测CPC、Bio-Oss、CPC+Bio-Oss不同时期的新骨形成与第4周 BMP-2、COL-Ⅰ的表达,发现CPC与CPC+Bio-Oss具有良好的生物相容性,可以促进早期成骨,成骨效果稳定,长期有效。CPC+Bio-Oss操作简单,可塑性强,保证材料成骨性能的同时优化了操作性能,从而为CPC在临床中的进一步应用提供实验依据。
