超细颗粒物对大鼠离体灌注心脏功能的影响
2021-04-22何倚帆牛亚楠杨若娟
白 枫,何倚帆,牛亚楠,杨若娟,曹 静
(山西医科大学附属第一医院心内科,山西医科大学基础医学院药理教研室,太原 030001)
超细颗粒物(ultrafine particulates,UFPs)是指空气动力学直径<0.1μm的微粒,占所有颗粒物的84%[1]。UFPs体积小且表面积大,在空气中停留时间长,携带更多有毒物质,对健康危害更大。近年来,超细颗粒物对心血管疾病的危害受到广泛关注。研究表明,超细颗粒物短期暴露可引起心率变异性降低[2-3],ST段压低,缺血负担显著增加[4],动脉顺应性和内皮依赖性血管舒张功能降低等血管舒缩性变化[5-6],同时机体氧化应激标志物增加[6],凝血风险增高和血小板活化增强[7],血浆纤维蛋白原和调节性淋巴细胞升高[8],增加冠心病患者的发病率和病死率[9]。然而,UFPs对心脏毒性的作用及其机制尚不明确。本研究采用Langendorff离体心脏灌流技术,在离体心脏水平研究UFPs短期暴露对心功能的影响,并探讨其产生机制。
1 材料与方法
1.1 实验动物及材料
1.1.1实验动物 成年雄性Sprague-Dawley(SD)大鼠(3~4月龄,体质量200~220 g),由山西医科大学实验动物中心提供(许可证号SCXK晋2009-0001)。所有用于研究的动物遵照《国家实验室动物健康管理与使用指南》,所有施与动物的操作都经过山西医科大学生物医学伦理委员会审批批准。将20只大鼠随机分为2组,分别用含或不含UFPs成分的台式液灌注离体心脏。
1.1.2主要材料与仪器 颗粒物标准品SRM 2975购自美国国家标准技术研究院(National Institute of Standards and Technology,NIST),4 ℃保存;GL-2 Langendorff 离体心脏灌流装置、PT-100 生物压力传感器、BL-420E 生物信号采集分析系统购自成都泰盟科技有限公司;微量丙二醛、超氧化物歧化酶、总抗氧化物能力试剂盒购自南京建成生物工程有限公司;一抗p38 MAPK(D13E1)XP® Rabbit mAb #8690、一抗Phospho-p38 MAPK(Thr180/Tyr182)(D3F9)XP® Rabbit mAb #4511、一抗p44/42 MAPK(ERKs)、一抗Phospho-p44/42 MAPK(ERKs)(Thr202/Tyr204)(D13.14.4E)XP® Rabbit mAb #4370均购自美国cellsignal公司;一抗JNKs sc-572和一抗p-JNKs sc-135642均购自美国Santa Cruz公司;二抗HRP标记的anti-Rabbit IgG购自北京中杉金桥有限公司。
1.2 方法
1.2.1超细颗粒物的准备 研究方案参照Sun等[10]的实验过程,并在其基础上加以改进,购买的SRM 2975 12.5 mg溶于100 mL台式液,室温搅拌60 min,充分超声震荡,先后用1 μm孔径的玻璃纤维过滤器和0.1 μm圆柱形孔隙聚碳酸酯膜过滤,所得滤液稀释至1 L台式液即终(质量)浓度为12.5 mg/L,用于灌注大鼠离体心脏。
1.2.2离体心脏灌流模型的制备 经腹腔注射戊巴比妥钠40 mg/kg麻醉SD大鼠,打开胸腔,沿脊柱胸主动脉分离心脏,取出心脏后立即置于预冷的台式液,轻轻挤压心脏和动脉内残留的血液,迅速在Langendorff装置上经过主动脉根部插管[10],逆行灌注预先加温且充氧气的台式液。灌流数秒,待心脏恢复节律性跳动,打开左心耳,剪一小切口,将聚氯乙烯膜制成的扁球囊经此切口插入左心室;球囊提前排净空气,连接充满水的不锈钢导管,通过连接在导管上的活塞注射器向球囊注入液体,使球囊与液体均匀接触,连接压力传感器;操作活塞注射器使球囊充水,舒张压保持在8~12 mmHg,各项血流动力学参数通过BL-420E生物信号采集分析系统进行记录和分析,记录生理参数包括心率、左心室舒张压(left ventricular developed pressure,LVDP)、+dp/dtmax、-dp/dtmax。LVDP等于左心室收缩压(left ventricular systolic pressure,LVSP)和左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)的差值。基线水平LVDP≥70 mmHg的心脏方可入组进行研究[10]。分离肺动脉,剪开肺动脉口,以收集心脏稳定跳动时每分肺动脉的流出物来计算冠脉流量(coronary flow, CF)。
1.2.3大鼠离体心脏血流动力学参数及CF测定 心脏平稳跳动约15 min,各项指标相对平稳后,通过外接电极将心率固定在高于固有心率约10%的水平[10],开始实验。正常组记录给予正常台式液时心脏血流动力学参数LVDP、+dp/dtmax、-dp/dtmax及CF的数值,观察约40 min。UFPs灌流组待离体心脏各项生理指标稳定且记录后,改用含有12.5 mg/L UFPs的台式液灌流心脏,观察UFPs干预后心脏血流动力学各参数及CF的变化,各项指标每10 min记录1次。
1.2.4肺动脉流出液氧化应激水平的测定 收集两组肺动脉流出液,采用硫代巴比妥酸TBA法测定丙二醛(malondialdetioxidant, MDA), 水溶性四唑盐WST-1法测定超氧化物歧化酶(superoxide dismatase, SOD), 比色法测定总抗氧化能力(total antioxidant capacity, TAOC), 所有检测重复3次,操作步骤严格按试剂盒说明书进行。
1.2.5大鼠心脏组织病理学改变 灌流结束,取部分心肌组织,4%(体积分数)中性甲醛溶液固定,石蜡包埋,切片,HE染色,乙醇脱水,烘干,中性树胶封片。
1.2.6免疫组织化学法检测大鼠离体心脏p-p38 MAPK、p-ERKs、p-JNKs的表达 采用Envision法对心脏离体组织进行免疫学检测,将两组石蜡包埋的心脏组织切成5 μm厚切片,放置于多聚赖氨酸覆盖的切片上,二甲苯脱蜡,梯度乙醇水化。组织切片在pH 6.0的柠檬酸盐缓冲液95~100℃孵育20 min,水浴恢复抗原。组织切片和p-p38 MAPK、p-ERKs、p-JNKs一抗(1 ∶500)孵育,湿盒4 ℃过夜,二抗孵育,苏木素复染,乙醇脱水,二甲苯清洗,以中性树胶封片。
1.2.7Western blots检测大鼠离体心脏p-p38 MAPK、p-ERKs、p-JNKs的表达 灌流结束,取心肌组织100 mg,常规提取总蛋白,BCA法测定蛋白浓度。在12%(质量分数)的SDS-PAGE中每孔加入20 μL蛋白溶液,以80 V、30 min及120 V、1 h进行电泳分离;电泳结束,将蛋白转移至PVDF膜上,以含5%(质量分数)脱脂奶粉的TBST(Tris-buffered saline and Tween 20)溶液摇床上室温封闭2 h,加入兔抗大鼠p-p38 MAPK及p38 MAPK一抗(1 ∶1 000)、p-ERKs 及ERKs一抗(1 ∶1 000)、p-JNKs及JNKs一抗(1 ∶200)4 ℃孵育过夜。TBST漂洗3次,每次10 min,加入羊抗兔二抗(1 ∶2 000)孵育1 h,再以TBST漂洗3次,每次10 min,加入增强型化学发光液750 μL,室温孵育2 min,美国Bio-Rad全自动曝光仪扫描,Alpha View生物电泳图象分析软件测定Western blots图像中各条带的光密度值,以目的蛋白条带与相应内参蛋白条带灰度值的比值作为目的蛋白的相对表达量。
1.3 统计学分析
采用GraphPad Prism Software Version 6.0和SAS软件进行作图和统计学分析,计量资料以均数±标准差表示,离体心脏心功能指标采用具有一个重复测量的两因素设计的方差分析;两组氧化应激和MAPK表达数据的比较采用成组设计t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 UFPs灌注恶化大鼠离体心脏功能
正常台式液灌流组大鼠离体心脏血流动力学参数各指标及CF无明显变化;含UFPs的台式液灌流大鼠离体心脏,血流动力学参数包括LVDP、+dp/dtmax、-dp/dtmax及CF明显恶化,分别从初始值(82.6 ± 2.1) mmHg、(1 624 ± 113) mmHg/s、(1 565 ± 116) mmHg/s、(12.0 ± 0.2) mL/min降至灌流结束时(56.8 ± 4.4) mmHg、(1 066 ± 177) mmHg/s、(1 082 ± 134) mmHg/s、(8.7 ± 0.3) mL/min,各指标下降相比初始值差异均有统计学意义(P<0.05),下降率分别约31.2%、34.5%、30.8%、27.5%。组间比较提示UFPs组灌注30、40 min,较正常组相应时间点心脏功能各指标下降,差异有统计学意义(P<0.05),以正常组初始值各指标为100%,计算两组灌注时不同时间点各指标变化的百分比,灌注结束时,正常组LVDP、+dp/dtmax、-dp/dtmax、CF分别为99%、106%、105%、100%,UFPs组分别为69%、65%、73%、72%(图1)。
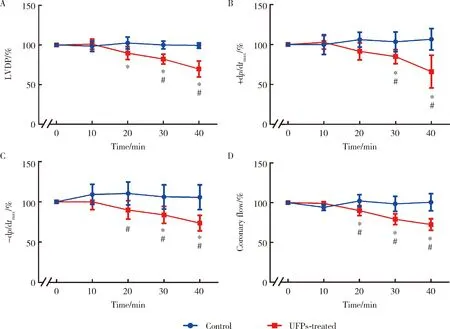
n=10、 A, LVDP; B, +dp/dtmax; C,-dp/dtmax; D, CF. *P<0.05 vs. UFPs-treated group at 0 min, # P<0.05 vs. control group at the same time point.图1 UFPs(12.5 mg/L)灌注对大鼠离体心脏的影响Figure 1 Effect of UFPs (12.5 mg/L) perfusion on isolated rat heart
2.2 UFPs灌注激活氧化应激系统
测定收集的肺动脉流出液氧化应激指标的变化,发现正常对照组MDA明显低于UFPs组(P<0.001), UFPs组SOD、TAOC低于对照组(P<0.001,表1), 提示UFPs组处于氧化应激状态,抗氧化系统受损,抗氧化能力明显下降。

表1 两组肺动脉流出液MDA、TAC、SOD的比较Table 1 The comparison of MDA, TAC and SOD in the outflow of pulmonary artery between the two groups
2.3 UFPs灌注损伤大鼠心脏组织
灌流结束,肉眼可见对照组大鼠心脏颜色红润,UFPs处理组大鼠心脏局部可见组织颜色发白;光镜下对照组大鼠心脏可见心肌细胞排列整齐,结构正常,UFPs处理组见局部心肌细胞结构紊乱,间质水肿(图2)。
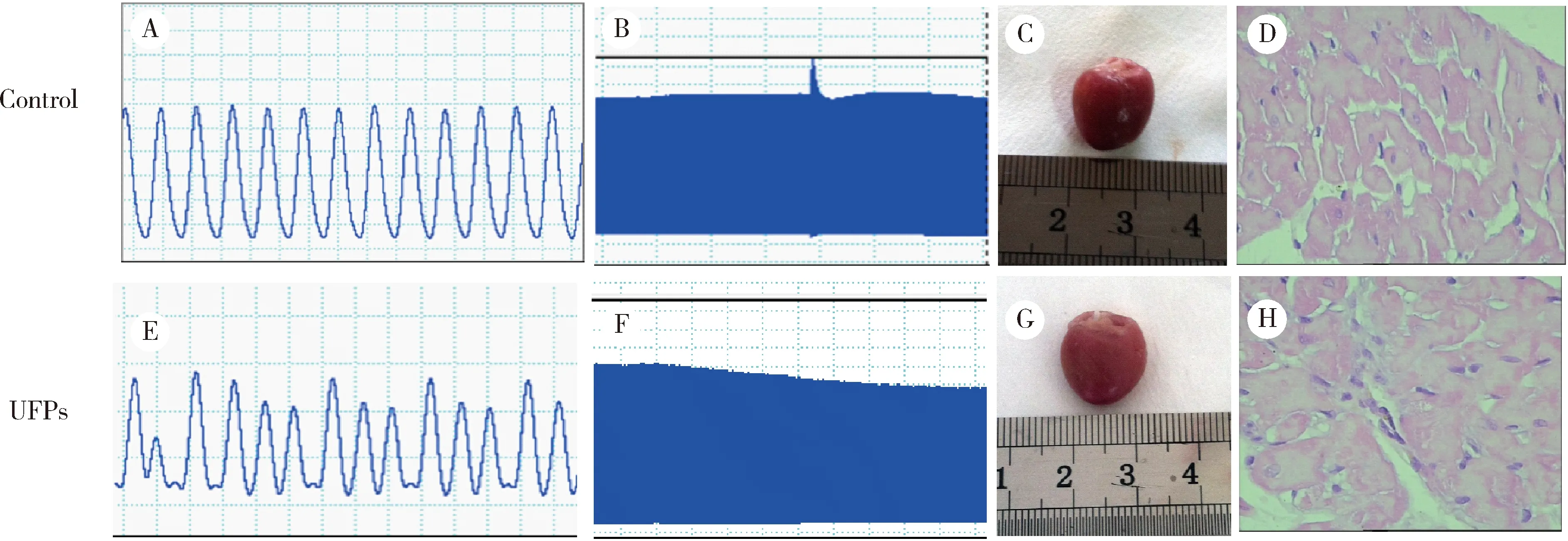
A and B, control group perfusion map and perfusion trend graph; E and F, UFPs group perfusion map and perfusion trend graph. C and G, control group and UFPs group perfusion end heart. D and H, the pathological changes of myocardium in control group and UFPs group (HE staining ×400).图2 UFPs干预引起心脏功能恶化Figure 2 UFPs intervention caused deterioration of cardiac function
2.4 UFPs上调MAPK家族蛋白的表达
大鼠离体心脏组织石蜡标本行免疫组织化学检测,发现与正常对照组相比,UFPs组p-p38 MAPK、p-ERKs和p-JNKs均呈高表达:p-p38 MAPK定位在细胞核,可见棕色的阳性核增加,p-ERKs和p-JNKs定位在细胞质,可见细胞质内棕色表达增强(图3)。Western blots结果也提示UFPs灌注大鼠心脏后,p-p38 MAPK、p-ERKs、p-JNKs表达上调,两组比较各指标差异有统计学意义(P<0.05),提示UFPs激活了MAPK信号通路(图4)。

Immunohistochemical images showed the expression of p-p38 MAPK, p-ERKs and p-JNKs in the myocardium of normal control group and UFPs-treated group (×400). The UFPs treatment group showed high expression of p-p38 MAPK, p-ERKs and p-JNKs (indicated by arrows).图3 大鼠心肌病理学变化(IHC ×400)Figure 3 Pathological changes of rat myocardium (IHC ×400)

The levels of phosphorylated p38 MAPK, ERKs and JNKs were determined by Western blots assay. Values are given as n=6 for each group. *P<0.05, UFPs-treated group vs. normal control group.图4 UFPs灌流30 min诱导MAPK家族成员的磷酸化Figure 4 UFPs perfused for 30 minutes, induced the phosphorylation of MAPK family members
3 讨论
本研究采用美国NIST的颗粒物标准品[11-12],研究UFPs对大鼠离体心脏血流动力学指标及CF的影响,发现UFPs灌注引起大鼠心脏功能直接、急性恶化,且该损伤作用不依赖于肺部的间接效应。UFPs对血管有直接的抑制效应,引起CF的下降。
氧化应激是颗粒物损伤机体的重要机制之一[10]。Kim等[13]的研究发现,内燃机排放微粒(12.5~50.0 mg/L)灌注增加了离体心脏心律失常的发生率,其机制为氧化应激和钙调蛋白激酶的激活。研究报道[14],机体氧化应激的程度随着周围环境微粒水平的上升而增加。本课题组前期研究也发现随着细颗粒物浓度的升高,浓度依赖引起心肌细胞内活性氧水平增高,导致了细胞氧化应激损伤,最终导致细胞凋亡[15]。体内抗氧化系统包括SOD及TAOC等,对于保护细胞免受氧化应激损伤至关重要。本研究发现UFPs组灌流液中氧化应激指标MDA较正常组升高,而SOD及TAOC均下降,提示氧化应激参与了UFPs诱导的心脏损伤。
MAPK家族作为活性氧的下游信号之一,具有调节细胞生长、生存和凋亡的功能。MAPK家族参与多种心脏疾病的信号转导,JNKs和p38 MAPK被认为是心肌细胞应激信号通路中促进凋亡的主要调节因子,ERKs则在心肌细胞受到应激时被激活发挥抗凋亡效应[16-17]。近来的研究显示,细胞暴露于颗粒物时,MAPK信号通路被激活,调节应激反应及黏附分子的表达[18-19]。本课题组前期研究结果表明,细颗粒物干预大鼠心肌细胞引起p38 MAPK、ERKs、JNKs的迅速激活[15]。本研究在离体心脏水平再次证实,UFPs暴露后MAPK家族成员迅速激活,提示MAPK信号通路可能在UFPs诱导的心脏损伤中起重要作用,颗粒物导致的心脏损伤至少部分是通过MAPK信号通路介导的。
综上所述,UFPs有直接、急性的心脏毒性,降低大鼠离体心脏心肌收缩力和冠脉血流量,导致氧化/抗氧化失衡,激活MAPK信号通路。由于离体实验未能模拟颗粒物的吸入后效应,因此颗粒物体内效应的确切机制需进一步深入研究。
