基因沉默肽基精氨酸脱亚胺酶4的表达对胶原诱导关节炎小鼠肺间质病变的影响
2021-04-22常志芳王志华庞春艳王永福
赵 凯,常志芳,王志华,庞春艳,王永福
(内蒙古科技大学包头医学院第一附属医院风湿免疫科,内蒙古自治区自体免疫学重点实验室, 内蒙古包头 014010)
类风湿关节炎(rheumatoid anhritis,RA)是一种累及免疫系统的疾病,通常以滑膜炎为主要病理改变,以慢性关节炎为主要临床特点[1]。RA患者的血清中包含多种自身抗体,瓜氨酸存在与这些抗体识别的表位[2]。肽基精氨酸脱亚胺酶4(peptidyl arginine deaminase 4,PAD4)可以在钙离子存在的环境中使精氨酸残基脱去亚氨基,从而生成瓜氨酸化蛋白[3],该蛋白与RA发病机制有关。研究显示,PAD4的活性失调与 RA 疾病的发生与发展存在一定的联系[4]。人体的免疫系统又将瓜氨酸化蛋白定义为外来物质,最终发生自身免疫反应,引起 RA 的发生与发展。RA 患者体内的自身抗体可以识别瓜氨酸化蛋白,人体内瓜氨酸化蛋白的程度与RA 的疾病进展直接相关,而PAD4则被认为是RA治疗药物研究的一个新靶酶。
RA患者体内免疫调节功能紊乱,可导致多种并发症的出现,而肺最容易受累。间质性肺病(interstitial lung disease,ILD)是RA关节外并发症中最常见的疾病,可有肺实质的弥漫性改变、肺泡炎症,以及间质纤维化的病理改变,经常导致较高的发病率和病死率。当RA患者肺部出现并发症时常会产生瓜氨酸化蛋白,从而引起免疫反应生成相应的抗瓜氨酸化蛋白抗体。而PAD4可催化瓜氨酸化,导致RA的进展,可能与ILD的发病有一定的相关性。瓜氨酸化,在RA细胞内和细胞外均呈现的是失调状态,在嗜中性粒细胞中,穿孔素、膜攻击复合物、细菌产生的毒素可诱导PAD的钙离子内流、细胞溶解和过度活化。这些因素可能分别驱动RA关节外脏器的过度纤维化[5]。因此,本研究旨在针对基因PAD4设计3段 siRNA序列,同时建立CIA小鼠模型,将3段siRNA尾静脉注射入小鼠体内,观察其对CIA小鼠肺间质病变的治疗作用及其机制,为PAD4-siRNA对RA的治疗提供实验基础数据。
1 材料与方法
1.1 实验研究对象
6~8周龄的DBA/1小鼠,雄性,购于南京大学动物模式研究所,动物批号为N000219。
1.2 试剂及仪器
反转录试剂盒购自ThermoFisher(中国)公司,磷酸缓冲液购自美国Gibco公司,红细胞裂解液购自日本Takara公司,澳洲源优级胎牛血清购自美国Gibco公司,RPMI-1640培养基购自生工生物工程(上海)股份有限公司,完全弗氏佐剂、牛 Ⅱ 型胶原购自美国Chondrex公司,APC-Foxp3、PE-CXCR5、FITC-CD4购自美国Abcam公司,荧光定量PCR仪购自中国BIOER公司,流式细胞仪购自美国BD公司。
1.3 实验方法
1.3.1针对基因PAD4设计3段 siRNA序列并构建腺病毒载体 使用siRNA在线设计软件根据其设计原则,依据小鼠基因 PAD4 cDNA序列设计3段 siRNA序列,送上海吉凯公司合成并构建腺病毒载体,经基因测序鉴定,转染293细胞制备病毒,流式细胞仪鉴定病毒滴度。
1.3.2建立胶原诱导的关节炎小鼠模型 6~8周龄的DBA/1小鼠,雄性,40只,将牛Ⅱ型胶原与完全弗氏佐剂混和并充分乳化,牛Ⅱ型胶原(质量)浓度为2 g/L(mg/mL),完全弗氏佐剂的(质量)浓度为5 g/L,于DBA/l小鼠尾根部皮内注射上述乳化好的胶原进行初次免疫。21 d后使用同样方法进行再次免疫。35 d后DBA/1小鼠的爪出现红肿,即CIA小鼠的模型已经建立。
1.3.3腺病毒尾静脉注射 实验分6组,每组4只。(1)空白组:没有进行任何处理的小鼠;(2)模型组:CIA造模成功后没有进行任何治疗;(3)阴性对照组:CIA造模成功后注射感染阴性病毒液;(4)PAD4-siRNA1组:CIA造模成功后注射PAD4-siRNA1病毒液;(5)PAD4-siRNA2组:CIA造模成功后,注射PADA4-siRNA2病毒液;(6)PAD4-siRNA3组:CIA造模成功后,注射PAD4-siRNA3病毒液。(3)~(6)组小鼠注射100 μL/只,每周1次,共8次。实验结束后处死小鼠。
1.3.4小鼠肺PAD4 mRNA和蛋白表达水平检测 取肺,使用Trizol提取肺中RNA,用反转录试剂盒将RNA逆转录合成cDNA,采用实时荧光定量RT-PCR(qRT-PCR)检测PAD4 mRNA的表达水平,对切片进行免疫组织化学检测PAD4 蛋白的表达位置和表达水平。
1.3.5小鼠脾细胞中Tfh细胞和Tfr细胞的检测 实验结束,处死小鼠,无菌条件下取脾,PBS洗涤,研磨,细胞筛过滤,1 000 r/min 离心5 min,将细胞悬液移至细胞培养皿中,加5 mL含10%(体积分数)胎牛血清(fetal calf serum,FCS)的完全培养基RPMI-1640,加PMA/Ionomycin混合物和BFA/ Monensin混合物,放入细胞培养箱,5% (体积分数)CO2,37 ℃培养,流式细胞术检测。
1.3.6小鼠肺PAD4病理学观察 小鼠肺组织切片进行HE染色后,光学显微镜下观察肺组织的病理学变化。
1.4 统计学分析
采用SPSS20.0统计软件,计量资料数据采用均数±标准差表示,多组间比较采用单因素方差分析,Levene法检验,方差齐的数据采用LSD法,方差不齐的数据采用Tamhane’s法;两组间比较采用t检验。所有数据采用双侧检验,P<0.05认为差异有统计学意义。
2 结果
2.1 PAD4-siRNA治疗后小鼠肺中PAD4 mRNA的表达
模型组与空白对照组小鼠比较,PAD4 mRNA的表达增加,差异有统计学意义(3.97±1.47vs. 1.00±0.00,P<0.05);PAD4-siRNA治疗后CIA小鼠肺PAD4 mRNA的表达水平较模型组和阴性对照组明显减少,差异有统计学意义(P<0.05)。
2.2 PAD4-siRNA治疗后小鼠肺PAD4蛋白的表达
空白组小鼠肺组织中红色荧光较少,而模型组和阴性对照组小鼠肺组织的炎细胞浸润区和气管周围可见较多的红色荧光,PAD4-siRNA治疗后3组的红色荧光明显减少,即CIA小鼠的肺组织可见PAD4的高表达,并且PAD4蛋白多表达于炎性细胞浸润区和气管周围,而采用PAD4-siRNA治疗后小鼠肺中PAD4的表达水平降低(图1)。

A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.图1 小鼠肺中PAD4蛋白的表达Figure 1 The PAD4 protein expression in the lungs of CIA mouse
2.3 PAD4-siRNA治疗后小鼠脾细胞中Tfh细胞的比例
模型组小鼠脾细胞中的Tfh细胞比例明显增加,与空白组比较差异有统计学意义 (P<0.05);而治疗后的小鼠脾细胞中的Tfh细胞比例较模型组和阴性对照组明显降低(P<0.05,图2)。
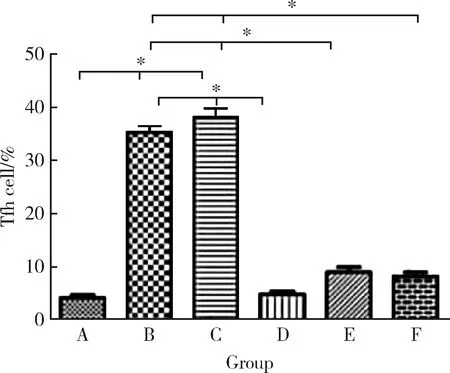
A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.*P<0.05.图2 小鼠脾细胞中Tfh细胞的比例Figure 2 The proportion of Tfh cells in splenocytes of CIA mouse
2.4 PAD4-siRNA治疗后小鼠脾细胞中Tfr细胞的比例
模型组小鼠脾细胞中的Tfr细胞比例明显降低,与对照组比较差异有统计学意义 (P<0.05);治疗后小鼠脾细胞中的Tfr细胞比例较模型组和阴性对照组明显增加,但只有PAD4-siRNA2组差异有统计学意义(P<0.05,图3)。

A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.*P<0.05.图3 小鼠脾细胞中Tfr细胞的比例Figure 3 The proportion of Tfr cells in splenocytes of CIA mouse
2.5 PAD4-siRNA治疗后小鼠脾细胞中Tfh/Tfr值的变化
模型组小鼠脾细胞中的Tfh/Tfr值明显增高,与对照组比较差异有统计学意义(P<0.05);PAD4-siRNA治疗后小鼠脾细胞中的Tfh/Tfr值较模型组和阴性对照组明显降低(P<0.05,图4)。

A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.*P<0.05.图4 小鼠脾细胞中Tfh/Tfr值的变化Figure 4 The changes of Tfh/Tfr cells in splenocytes of CIA mouse
2.6 PAD4-siRNA治疗后小鼠肺的病理改变
空白组小鼠肺的肺泡壁及气管结构形态正常,未见炎性细胞浸润,未见间质纤维组织形成;而模型组小鼠肺中可见肺结构紊乱,正常肺泡明显减少,肺泡变形及间隔增宽,血管壁可见炎性细胞浸润,肺组织广泛纤维化;而治疗后的3组小鼠与模型组和阴性对照组比较,可见肺结构紊乱减少,炎性细胞浸润降低,肺泡壁破坏减少,以及间质纤维化程度降低(图5)。

A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.图5 小鼠肺的组织病理学改变Figure 5 The pathological changes in the lungs of CIA mouse
3 讨论
RA是一种慢性炎症性关节病,通常可引起软骨和骨损伤,RA又是全身慢性自身免疫性疾病,全身多脏器都可累及,以肺累及最明显。
肺部受累是RA的常见关节外特征,累及肺时临床表现多样,包括胸膜炎、胸腔积液以及气道疾病,常见的临床表现有闭塞性细支气管炎、类风湿结节以及ILD[6]。研究者在观察CIA大鼠模型肺不同时间的病理变化时发现CIA大鼠肺受累经历了从肺泡炎至间质性肺病的过程,证明RA发展过程中肺受累可导致其肺泡和肺间质的改变[7]。Darrah等[8]研究发现PAD4是RA发病机制中的关键酶,并且抗PAD4抗体与严重的关节病变和肺病变相关。PAD4的活性失调与 RA 疾病的发生与发展存在一定的联系,抗PAD4自身抗体可能是RA中重要的生物标志物。本课题组前期的研究(另文发表)中也发现CIA小鼠除了有明显的关节病变外,肺会出现间质病变。因此,本实验设计了3段PAD4-siRNA尾静脉注射CIA小鼠,结果发现CIA小鼠的肺中PAD4 mRNA和蛋白的表达水平升高,且PAD4蛋白多表达于炎性细胞浸润区和气管周围,采用siRNA技术沉默PAD4的表达后,CIA小鼠肺组织中PAD4 mRNA和蛋白的表达水平降低。CIA小鼠肺组织可见肺结构紊乱,正常肺泡明显减少,肺泡变形及间隔增宽,血管壁可见炎性细胞浸润,肺组织广泛纤维化,PAD4-siRNA治疗后CIA小鼠肺组织的病理改变减轻,炎性细胞浸润降低,肺泡壁破坏减少以及间质纤维化程度降低,提示PAD4确实参与了CIA小鼠肺间质病变的发生,CIA小鼠引起关节病变的同时确实可导致肺间质病变的发生,而PAD4-siRNA可以减轻这种肺间质病变的程度。
RA疾病的进展是免疫细胞相互作用的结果,Tfr与Tfh这两种细胞在RA的发生发展中也起到了重要的作用[9]。Tfh细胞辅助 B淋巴细胞在自身免疫疾病中发挥核心作用,而Tfr控制生发中心中Tfh和B细胞的过度活化[10],Tfh和Tfr自身的改变以及二者比例的失衡都会导致RA的发展。Wang等[11]发现,RA患者的Tfh和Tfr细胞比健康人群均增加。更重要的是,Tfr / Tfh值降低,表明Tfh和Tfr之间的平衡被破坏[12]。本研究发现CIA小鼠脾细胞中Tfh细胞的比例升高、Tfr细胞的比例明显降低、Tfh/Tfr值明显增高,而经过PAD4-siRNA治疗后的小鼠Tfh细胞比例下降、Tfr含量升高、Tfh/Tfr值明显降低,这些结果表明Tfh和Tfr细胞均参与了CIA小鼠的发病,而PAD4-siRNA沉默PAD4的表达后,可抑制Tfh细胞的产生、促进Tfr细胞的生成、逆转Tfh/Tfr的比例,进而发挥治疗CIA小鼠肺间质病变的作用。
综上所述,CIA小鼠发病的过程会导致肺的病理改变,PAD4-siRNA沉默其mRNA和蛋白的表达后,可以通过调节Tfh和Tfr细胞的比例(平衡)而发挥治疗肺间质病变的作用。
