HPLC法测定广东紫珠干浸膏中咖啡酸的含量
2021-04-20谭永健王江梅吉安市青原区卫生健康委员会江西吉安343000山东省潍坊市生态环境监测中心站山东潍坊604
★谭永健 王江梅(.吉安市青原区卫生健康委员会 江西 吉安 343000;.山东省潍坊市生态环境监测中心站 山东 潍坊 604)
广东紫珠为马鞭草科植物广东紫珠(Callicarpa kwangtungensis Chun)的干燥茎枝及叶,主要分布在广东、江西、福建、湖南等地[1];全株可入药,具通经活血、清热解毒等功效。临床上常用于呕血、咯血、尿血、便血、痈疽热毒等症[2]。其主要有效成分为咖啡酸、连翘酯苷B和金石蚕苷等[3]。咖啡酸(caffeic acid)别名3, 4-二羟基肉桂酸,具有抗菌、抗病毒、中枢兴奋、解毒、凝血作用等[4-5]。
广东紫珠干浸膏为广东紫珠经提取制成的固体,收载于2015年版《中国药典》一部抗宫炎片项下[6]。广东紫珠干浸膏作为抗宫炎片、抗宫炎胶囊和抗宫炎颗粒的主要成分之一,现标准仅对连翘酯苷B和金石蚕苷进行了质量控制,目前尚未见报道广东紫珠干浸膏中咖啡酸含量的研究。因此本文建立了广东紫珠干浸膏中咖啡酸的HPLC含量测定方法,以期为控制和提高广东紫珠干浸膏及其它含广东紫珠干浸膏中药复方制剂的质量提供科学依据。
1 设备与试剂
高效液相色谱仪为美国Agilent 1200型,配置有柱温箱、可变波长检测器和Chemstation工作 站(Ohio, USA)。精 密 天 平 包 括ME-204型(METTLER-TOLEDO,上海)和CP225D型(Satorius,Germany)。PB10型 酸 度 计(Satorius, Germany)。咖啡酸对照品(批号110885-201703)购自中国食品药品检定研究院,标示纯度为99.7 %;色谱纯的甲醇与乙腈购自北京百灵威科技有限公司;其他均为分析纯试剂。流动相中的水相为娃哈哈纯净水。
2 方法与结果
2.1 对照品溶液的制备 精密称取咖啡酸对照品适量,加50 %甲醇制成每1 mL含40 μg的标准储备溶液。
2.2 供试品溶液的制备 精密称定研细后的广东紫珠干浸膏1 g,置具塞锥形瓶中,加25 mL甲醇(50 %,V/V),超声30 min(500 W,40 kHz),放冷,补足减重,摇匀,滤过,取续滤液,冷藏于冰箱(4 ℃)备用。
2.3 色谱条件 色谱柱为Agilent 5 TC -C18柱(250 mm×4.6 mm,5μm),以乙腈-0.5 %磷酸(18∶82)为流动相,检测流速为1.0 mL·min-1,波长323 nm,柱温30 ℃,进样量10 μL。对照品及样品色谱图见图1。

图1 咖啡酸对照品、供试品和空白溶剂HPLC图
2.4 方法学考察
2.4.1 线性关系考察 分别精密吸取上述对照品溶液1 μL、2 μL、4 μL、6 μL、8 μL、10 μL、20 μL按按“2.3”项下色谱条件测定峰面积。以色谱峰峰面积对进样量(μg)进行线性回归(不逼零),得咖啡酸的标准曲线:Y=31.656X+ 45.352,R2= 0.995 3。结果表明,咖啡酸的进样量在0.04~0.80 μg范围内线性关系良好(R2>0.99)。
2.4.2 分析精密度 取6份咖啡酸对照品溶液,按上述色谱条件进样检测。结果显示,咖啡酸峰面积的相对标准偏差(RSD)为0.10 %(n=6),表明分析精密度符合要求。
2.4.3 样品稳定性 按“2.2”项方法制备供试品溶液,按“2.3”项下色谱条件,于0,2,4,6,8,10,12,24 h等时刻点分别取样检测。测得化合物峰面积在该时段内的RSD为0.95 %,表明所制备的咖啡酸溶液在24 h内(室温下)是稳定的。
2.4.4 分析重复性 取六份同一批号(T190307)的样品,每份约1 g,研细,精密称定,按“2.2”项方法制备供试品溶液,色谱条件同“2.3”项,进样测定,计算咖啡酸的含量(mg/g)。结果计算得咖啡酸含量的平均值为0.64 mg/g,RSD为0.15 %。表明该方法重现性良好。
2.4.5 加样回收率试验 精密称取已知咖啡酸含量(0.64 mg/g)的广东紫珠干浸膏粉末(批次:T190307)6份,研细,每份取约0.5 g,精密称定,置具塞锥形瓶中,每份精密加入含咖啡酸0.047 mg/mL的对照品溶液7 mL,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件测定含量,计算加样回收率(n=6),结果表明咖啡酸的平均回收率分别为95.93 %,RSD分别为1.02 %,结果见表1。
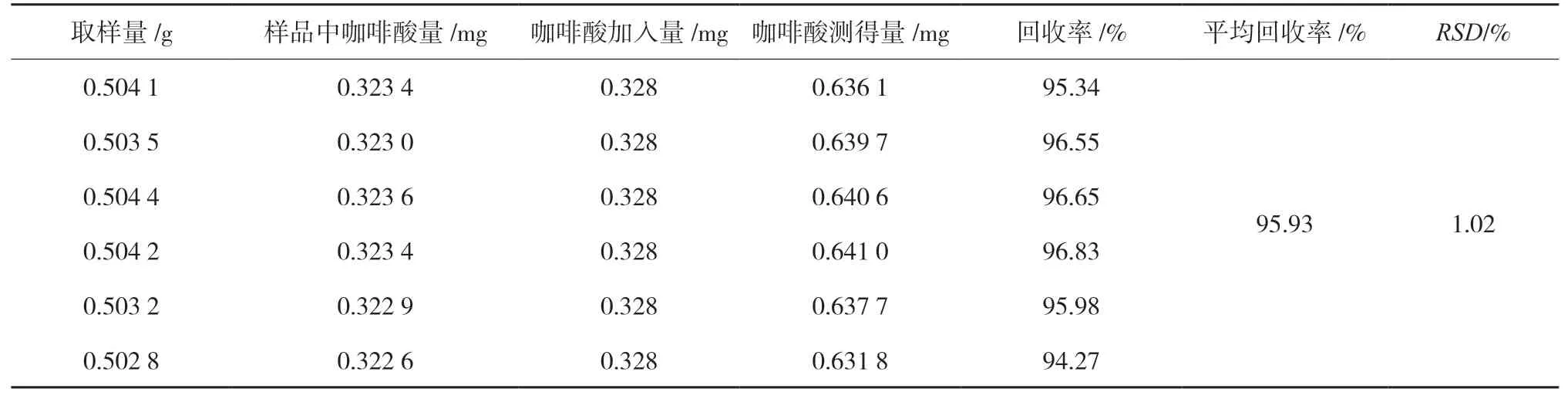
表1 咖啡酸回收率试验结果(n = 6)
2.4.6 系统耐用性分析 本实验采用Welch Ultimate XB-C18柱(150 mm×4.6 mm,5 μm)、Agilent 5 TCC18柱(250 mm×4.6 mm,5 μm)和ZORBAX SBC18柱(250 mm × 4.6 mm,5 μm)3种品牌的色谱柱,按标准操作规程进行分析,结果无明显差别,表明本法适用性良好。
2.5 样品分析 本实验采用上述经验证的条件、参数,对三个厂家共10批次送检的广东紫珠干浸膏样品进行了分析测试,其样品信息、含量结果见表2。

表2 广东紫珠干浸膏样品中咖啡酸含量测定结果(n=3)
3 讨论
3.1 检测波长的确定 经DAD检测器扫描咖啡酸对照品,结果显示咖啡酸的最大吸收波长为323 nm,由于323 nm杂峰对目标峰干扰少且稳定,故选择323 nm作为检测波长。
3.2 流动相的选择 在流动相的选择中,由于广东紫珠干浸膏中成分复杂,本文尝试甲醇-水(20∶80)、乙腈-水(20∶80)、乙腈-0.1%磷酸(19∶81),结果显示上述流动相条件下咖啡酸的色谱行为不够好,未能达到基线分离。进而加大磷酸比例,发现乙腈-0.5 %磷酸溶液(18∶82)系统分离效果好,故优选的流动相为乙腈-0.5 %磷酸溶液(18∶82)。
3.3 提取条件的考察 本文首先采用超声提取法,考察了乙醇溶液、稀乙醇溶液、甲醇溶液、30%甲醇溶液、50 %甲醇溶液和70 %甲醇溶液六种提取溶剂,结果发现50 %甲醇对咖啡酸的提取效率最高。接着比较了超声和回流2种提取方式,发现在同样的提取溶剂、时间等条件下,两者的提取效率相当,而超声提取因其简单方便成为优选。此外,实验也考察了溶剂用量(10 mL、25 mL、50 mL、75 mL)和超声时间(15 min、30 min,1 h),最后确定优化的提取条件如下:50 %甲醇、25 mL、超声30 min。
3.4 小结 从对10批广东紫珠干浸膏样品中咖啡酸的含量测定结果来看,不同厂家、不同批次样品中咖啡酸含量相差较大,提示这种差别可能来源于原药材和加工工艺等环节。为保障人民用药安全,避免由原药材、加工工艺引起的疗效差异,有必要对干浸膏中的咖啡酸进行含量限定。
本文建立了测定广东紫珠干浸膏中咖啡酸含量的HPLC方法。方法学验证结果表明,本法快速,简便,准确可靠,专属性强,适用性好,可用于广东紫珠干浸膏及相关产品的质量控制。
