不同球孢白僵菌菌株对家蚕的致病力分析
2021-04-19吴灵芝余天成李保珍樊金华
吴灵芝,宋 璐,余天成,李保珍,樊金华
(1.山西农业大学林学院,山西太谷030801;2.山西中医药大学基础医学院,山西太原030000)
球孢白僵菌(Beauveria bassiana)属于子囊菌门(Ascomycota)肉座菌目(Hypocreales)虫草菌科(Cordycipitaceae)白僵菌属(Beauveria),能寄生于700 多种昆虫[1],是一种广谱性的昆虫病原真菌[2]。虽然球孢白僵菌能引起家蚕白僵病,但使用得当,也将是最有前景的生防菌种之一[3-5],能够广泛应用于农林害虫防治[6-7]。现阶段,白僵菌制剂已经应用于防治亚洲玉米螟(Ostrinia furnacalis)[8]、油松毛虫(Dendrolimus tabulaeformis)[9]、烟粉虱(Bemisia tabaci)[10]、草地贪夜蛾(Spodoptera frugiperda)[11]、蚜虫(Aphidoidea)[12]、蝗虫[13]等众多农林害虫[14]。但白僵菌菌株种类众多,筛选出具有更高致病力的菌株,并且在最佳用药时期以最佳浓度应用于生防,仍然是需要探索的问题[15]。
球孢白僵菌的分生孢子在接触昆虫后,容易在高温高湿的环境下萌发,萌发的菌丝通过表皮侵入寄主昆虫的体内并生长、繁殖,产生大量的菌丝和有毒代谢产物[1,16]。白僵菌以体壁侵染的方式感染家蚕时,发现其分生孢子接触家蚕表皮后10 h 内萌发,菌丝能在家蚕体内快速生长繁殖致使养分和水分被迅速消耗,表皮开始出现黑色斑点,最终僵硬死亡[17]。白僵菌侵染寄主昆虫,除了体表侵染外,还采用口服和背部注射等方法,背部注射法可使白僵菌更快地进入家蚕体内引发免疫反应。
昆虫病原菌侵染昆虫后,能够引起其食量下降、排便异常、呕吐等行为变化[18-19],最终影响其生长发育。白耀宇等[20]研究表明,大肠杆菌对草地贪夜蛾幼虫体质量具有抑制作用。TEFERA 等[21]研究了白僵菌感染二化螟(Chilo partellus)幼虫,证明菌株在处理后1~4 d 显著影响其取食。MOORE 等[22]研究表明,沙漠蝗(Schistocerca gregaria)取食量的减少与绿僵菌的浓度和剂量密切相关。
家蚕(Bombyx mori)是国内外公认的并且研究广泛的鳞翅目模式昆虫,是易于实验室饲养的重要经济昆虫。本研究将球孢白僵菌以背部平行注射的方法侵染家蚕,探讨球孢白僵菌菌株TST、FDB 和BF 对家蚕卵和幼虫的致病力及对家蚕幼虫生长发育的影响,为揭示球孢白僵菌对家蚕的致病机理及更多高效生防真菌制剂的开发提供理论依据[23]。
1 材料和方法
1.1 试验材料
1.1.1 供试昆虫 试验所用家蚕为Nistari 品系,西北农林科技大学植保学院赠送。
1.1.2 供试菌株 球孢白僵菌菌株TST,分离自桃小食心虫(Carposina sasakii)越冬虫尸上[24];球孢白僵菌菌株BF,分离自光肩星天牛(Anoplophora glabripennis)虫尸上[25];球孢白僵菌菌株FDB,分离自帕克阿扁松叶蜂(Acantholyda)虫尸上[26],均保存在山西农业大学林学院森林生物显微技术实验室。
1.1.3 仪器 GDN-300E-4 型光照培养箱(宁波乐电仪器制造有限公司)、DL-CJ-IND 型超净工作台(北京东联哈尔仪器制造有限责任公司)、78-2 型磁力搅拌器(江苏省金坛市荣华仪器制造有限公司)、LS-35HD 型立式压力蒸汽灭菌器(江阴滨江医疗设备有限公司)、SB-20002 型电子天平(海宁市盛博衡器有限公司)、ZEISS 型光学显微镜(上海永汇实业发展有限公司)、徕卡M205C 型超景深体视显微镜(北京中显恒业仪器仪表有限公司)。
1.2 试验方法
1.2.1 家蚕饲养 家蚕用食品级塑料盒(1 500 mL)饲养在光照培养箱中,温度为(25±1)℃,5 龄家蚕的相对湿度控制在70%,光照周期12L∶12D。越年蚕卵在4 ℃冰箱保存,最长不超过60 d。家蚕饲养所用桑叶采自山西农业大学林业站,用自封袋密闭保存于4 ℃备用。
1.2.2 球孢白僵菌分生孢子悬液制备 在无菌条件下,用接种环刮取少量球孢白僵菌孢子,以平板划线法接种到新的PDA 培养基上[27],然后用封口膜密封,在(25±1)℃恒温培养箱中,光周期12L∶12D,倒置培养10 d 采收。将培养好的球孢白僵菌在无菌条件下刮取适量孢子,置于盛有0.05%吐温-80 的三角瓶中,磁力搅拌器上搅拌10 min,使孢子均匀分散,后用2 层纱布过滤除去菌丝,即为待测孢子悬液。采用血球计数法计数悬液孢子数备用。
1.2.3 球孢白僵菌对家蚕卵的致病力测定 家蚕产卵当天,分别取10 μL 浓度为1×107个/mL 的TST、FDB、BF 菌株的孢子悬浮液滴到产卵纸上有卵的地方,并将其周围浸湿,每组处理30 粒卵,设3 个重复。将处理后的卵放置在培养箱中正常培养,统计卵的孵化数,直至全部孵化。对照组用等量的0.05%吐温-80 处理。
1.2.4 球孢白僵菌对家蚕幼虫的致病力测定 挑取健康的5 龄第3 天家蚕幼虫,先用75%酒精将注射处体壁消毒,然后置于铺有保鲜膜的冰盒中10 min后利用微量注射器将5 μL 不同菌株孢子悬液从背部注射家蚕体内。新鲜桑叶饲养,每隔24 h 观察并记录虫体死亡情况,计算累计死亡率和半数致死时间(LT50)。每个处理设置3 个重复,每组10 头试虫。将死亡的家蚕转移到无菌的培养皿中,当球孢白僵菌菌丝长满体表时,记录时间、并用体视显微镜拍照。
1.2.5 家蚕生长指标的测定 选取发育正常、体质量相近的5 龄第2 天的家蚕,饥饿处理2 h 后进行体质量和体长测量,记录初始值。用微量注射器将5 μL 不同孢子悬液(浓度1×107个/mL)从背部注射家蚕。设置TST 菌株孢子悬液、BF 菌株孢子悬液、FDB 菌株孢子悬液和吐温-80 无菌水(对照组)共4 组处理。每个处理设置3 个重复,每组10 头试虫。在直径为9 cm 的无菌培养皿里正常饲养,每隔24 h 逐条进行体质量和体长测量,计算每24 h 平均相对增长量和72 h 的平均相对增长量[28]。
1.2.6 TST 菌株对家蚕的毒力测定 将球孢白僵菌TST 菌株参照1.2.2 的方法配制成孢子悬液,最终浓度梯度为1×105、1×106、1×107个/mL,对照组(CK)为加有0.05%吐温-80 的无菌水,注射剂量为5 μL。每处理3 个重复,每个重复10 头试虫。采用新鲜桑叶饲养,每隔24 h 进行1 次观察,记录死亡虫数,计算致死中浓度(LC50)和致死中时(LT50)。
1.3 数据分析
用SPSS13.0 软件进行方差齐性检验,满足P>0.05 再进行方差分析和多重比较,并用GraphPad Prism 7 软件作图。
2 结果与分析
2.1 球孢白僵菌菌株对家蚕卵的致病力
从表1 可以看出,与对照组相比,各处理组孵化天数无显著差异(P>0.05),孵化天数基本保持在7 d 左右,这与正常家蚕无差别[29]。

表1 球孢白僵菌菌株侵染后卵的孵化天数
2.2 球孢白僵菌菌株对家蚕幼虫的致病力
从表2 可以看出,TST 和BF 菌株具有较高的致病力,对家蚕幼虫的累计死亡率均超过50%,TST菌株的累计死亡率最高,达到了96.67%±5.77%。TST 菌株的LT50最短,为3.08 d,表明其对家蚕幼虫的毒力最强;FDB 菌株的LT50最长,为6.41 d,表明其对家蚕幼虫的毒力最弱。综上所述,TST 菌株对家蚕的致病力最强。
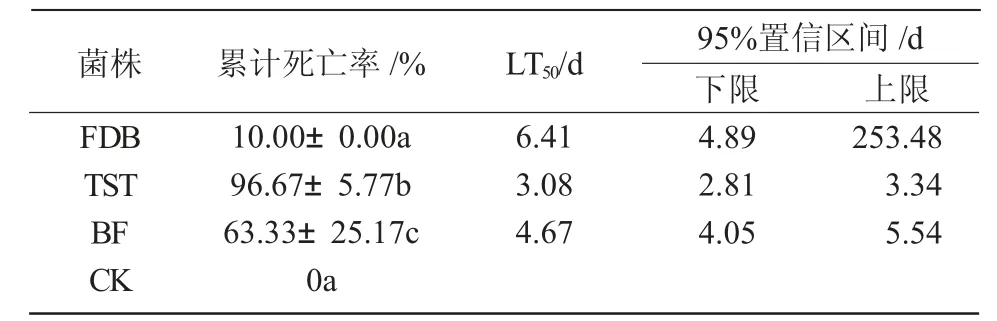
表2 球孢白僵菌菌株对家蚕幼虫的致病力
由表3 可知,TST 菌株的菌丝覆盖家蚕表皮的时间为5.29 d,比FDB 和BF 菌株的时间更短,但这3 个菌株间没有显著差异。

表3 球孢白僵菌菌丝覆盖家蚕表皮的时间
由图1 可知,对照组家蚕体表形态正常,而TST、BF、FDB 菌株侵染后的家蚕体表与对照组相比,明显被大量菌丝覆盖、呈白色,家蚕体长变短且僵直。

2.3 球孢白僵菌菌株对家蚕幼虫体质量变化的影响
由图2 可知,对照组的增长量比其他3 个处理组都快,且体质量增加比较平稳,没有较大起伏;FDB 菌株处理的家蚕体质量增长量较对照稍慢,与对照组无显著差异(P>0.05);BF 菌株处理的家蚕体质量在后期(72 h)的增长量与对照相比显著减少(P<0.001);TST 菌株处理后家蚕的体质量增量与对照相比差异极显著,它的增长量最少。所以,相比其他处理,TST 菌株对家蚕体质量的影响最显著,它能明显抑制家蚕的生长发育。
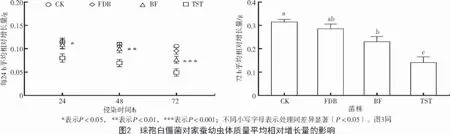
从图2 可以看出,4 个处理间72 h 平均相对增长量有极显著差异(P<0.001)。BF 和TST 菌株处理家蚕后72 h,家蚕幼虫的体质量增长量显著低于对照组和FDB 菌株处理组(P<0.05),而FDB 菌株处理组与对照组间并没有显著差异(P>0.05)。
2.4 球孢白僵菌菌株对家蚕幼虫体长变化的影响
球孢白僵菌侵染家蚕在一定程度上也会对家蚕幼虫的体长造成影响,从图3 可以看出,所有处理的家蚕幼虫体长增长量随着感染时间的增加都有所减少。处理24 h 后,所有处理的家蚕体长增长量没有明显的规律,但是在48、72 h 对照组体长增长量比其他3 个处理组多,并且与TST 菌株处理间差异极显著,说明在3 种球孢白僵菌中TST 菌株的毒力最强,对家蚕幼虫体长增长的抑制作用最大。
由图3 可知,4 个处理间72 h 平均相对增长量有显著差异(P<0.01)。在BF 和TST菌株处理后72 h内,家蚕幼虫的体长增长量显著低于对照组(P<0.05),而FDB 菌株处理与对照组间无显著差异(P>0.05)。
2.5 TST 菌株对家蚕的毒力测定
从表4 可以看出,TST 菌株的LC50为2.25×106个/mL[30]。孢子悬液的浓度越高,LT50越短,浓度为1×105、1×106、1×107个/mL 的球孢白僵菌侵染家蚕的LT50分别为6.20、5.12、3.36 d,表明孢子悬液的浓度越高,对家蚕的毒力越强。

表4 TST 菌株对家蚕的毒力测定
3 结论与讨论
有研究表明,绿僵菌菌株对草地贪夜蛾的卵有高达80%的致病力,而球孢白僵菌对其卵没有显著影响[31]。本研究中,3 株球孢白僵菌同样对家蚕卵的孵化都无显著影响,这可能是因为家蚕的卵壳厚而坚硬,白僵菌的分生孢子难以入侵;当卵孵化后,卵壳表面黏附的分生孢子可能会再次侵染幼虫,甚至造成多代传播。球孢白僵菌对虫卵的致病力小,因此,在利用白僵菌生物防治时要选择适当的时期。
致死中时(LT50)是目前高毒力菌株筛选的主要指标[32-33]。目标昆虫的累计死亡率越高,LT50越短,表明其有更强的致病力[34]。本研究中,球孢白僵菌对家蚕幼虫有明显的致病力,TST 菌株毒力最强,对家蚕的累计死亡率可达96.67%,致死中时为3.08 d,其菌丝覆盖表皮的时间为5.29 d,表明其具有开发成生物防治剂的潜力。
本研究表明,对照组形态正常,而其他3 组球孢白僵菌侵染的家蚕体表都长满了白色的菌丝,但菌丝的颜色、生长密度稍有差异,可能是因为这3 种白僵菌的特性和致病力强弱不同。并且白僵菌侵染的家蚕死亡后虫体大小比对照组要小很多,这也与前人的研究结果一致[19]。在本研究中,白僵菌侵染的初期,家蚕背部注射菌液的部位就开始出现黑色斑点,幼虫活动能力减弱,待家蚕死亡后,侵染部位的黑色斑点变大,体表其他部分也出现了大小不一的黑斑,称为入侵斑[35],之后菌丝首先从侵染部位长出,在培养皿中潮湿培养后口器、节间膜被菌丝覆盖,最后长满全身。
球孢白僵菌注射家蚕,家蚕幼虫的体质量增长量明显低于对照组,并且TST 菌株在72 h 内显著抑制其体质量的增长。在处理后24 h 体长增长量没有明显的规律,这可能是由于球孢白僵菌处理的家蚕幼虫在前期取食桑叶的量较多,可提供更多的营养和能量去应对球孢白僵菌的攻击;后期TST 菌株感染的家蚕体长增长量显著减少,可能是由于球孢白僵菌在寄主体内大量繁殖,致使营养大量消耗,机体抵抗力降低。通过研究球孢白僵菌对家蚕体质量体长的影响,印证了球孢白僵菌侵染能引起昆虫取食量减少[36],在一定程度上能够对球孢白僵菌在林业病虫害防治中具有指导意义。
GARCÍA 等[37]报道了浓度为1.0×109个/mL 的球孢白僵菌菌株Bb42 侵染鳞翅目昆虫草地贪夜蛾2 龄幼虫的LT50为3.6 d,死亡率为96.6%。而本研究1×107个/mL 的球孢白僵菌菌株TST 对家蚕的LT50仅需3.36 d,相比之下,较前者的致死速度快,其对家蚕的累计死亡率高达96.67%。因此,TST 菌株致病力更强,未来在农林害虫的生物防治方面具有更高的研究和应用价值。本研究通过背部注射的方式初步探索了3 种球孢白僵菌菌株对家蚕的致病力,但球孢白僵菌感染家蚕的方式还包括体表侵染和口服等,对于不同侵染方式对家蚕的毒理数据仍需进一步研究。此外,对球孢白僵菌致病机理的研究还需深入到细胞免疫和体液免疫[38],这样才能更加准确地解释球孢白僵菌与昆虫的互作机制。
