超声对颈动脉体瘤的定量与分型评估
2021-04-17蔡凤萍庄勇陈晓宇阮琴韵
蔡凤萍,庄勇,陈晓宇,阮琴韵
福建医科大学附属第一医院超声影像科,福建福州 350000;*通讯作者 阮琴韵 qyruan@126.com
颈动脉体位于颈动脉分叉后壁外膜下,成人颈动脉体直径约0.3 cm。颈动脉体瘤(carotid body tumor,CBT)由颈动脉体衍变而来,属化学感受器瘤或神经节瘤[1]。尽管CBT 无明显临床症状,且瘤体生长缓慢,但会向周围血管神经浸润性生长,应早期手术[2]。当CBT 超过5 cm,病死率提高1%~3%[3]。Shamblin Ⅲ型瘤体完全包裹颈动脉,常需要切除颈动脉和进行血管移植[4]。CBT的大小及分型很大程度上决定了手术方式[5]。超声、CT 血管成像(CTA)、MRI 和数字减影血管成像均可帮助诊断CBT,数字减影血管成像是诊断“金标准”,但逐渐被CTA 和MRI 取代[6-7];超声无创且简便易行,也逐渐用于诊断和评估CBT[8]。既往关于超声诊断CBT的报道较多,但超声对CBT定量和分型评估方面的研究鲜有报道。本研究拟比较超声与CTA 的CBT术前检查结果,探讨超声对CBT的定量与分型评估价值。
1 资料与方法
1.1 研究对象 选取2006年1月—2019年12月在福建医科大学附属第一医院经手术病理证实的36例CBT,其中男16例,女20例;年龄25~70岁,平均(36.0±10.8)岁。所有患者均行CTA检查,其中20例同期行二维超声检查。排除病理组织不完整者。本研究通过伦理委员会的伦理审核(闽医大附一伦理医技审[2015]084号),受检者均对研究内容知情同意。
1.2 超声评估方法 采用Philips iU22 超声诊断仪,线阵探头频率5.0~12.0 MHz,凸阵探头频率1.0~5.0 MHz。患者取仰卧位,充分暴露颈部,头偏向一侧,双侧颈部对照扫查,二维超声显示颈部肿块,对肿块进行纵切面、横切面、斜切面探查,记录肿块大小(包括最大径)及与颈动脉的关系。按Adler分级[9]将肿块内血流分为4级:0级为无血流信号;Ⅰ级为少量血流,可见1~2处点状血流;Ⅱ级为中等量血流,可见多条小血管或1条血管超过病灶的半径;Ⅲ级为血流丰富,可见4条以上血管或交织成网状。
1.3 CTA 评估方法 采用东芝Aquilion 16层扫描机,扫描条件:管电压120 kV,管电流250~300 mA,层厚1 mm,1~1.5 mm 重建,螺距15,视野25 cm×25 cm。采用高压注射器注射非离子型对比剂80 ml,双期或三期扫描。采用多平面重组、最大密度投影、容积重建等多种技术进行图像后处理。记录CBT 大小(包括最大径)及与颈动脉的关系。
1.4 CBT的Shamblin 分型 根据术中瘤体与颈动脉的关系分为3型[10],Shamblin Ⅰ型:CBT 体积较小,与颈动脉粘连极少,手术切除并无困难;Shamblin Ⅱ型:CBT 体积较大,与颈动脉粘连较多,瘤体可被切除,但手术中需要临时颈动脉腔内转流;Shamblin Ⅲ型:CBT 体积巨大,瘤体将颈动脉完全包裹,手术常需要颈动脉切除和血管移植。超声与CTA 对CBT的分型标准参照上述标准,根据肿块与颈动脉的关系判断分型:Shamblin Ⅰ型:肿块紧邻颈动脉,但未包绕颈动脉;Shamblin Ⅱ型:肿块部分包绕颈动脉;Shamblin Ⅲ型:肿块完全包绕颈动脉。
1.5 统计学方法 采用SPSS 19.0 软件,计数资料比较采用Fisher 确切概率法。正态分布的计量资料以表示,采用独立样本t检验;非正态分布者以M(Qn)表示。采用Pearson 相关分析二维超声与CTA对患者术前瘤体最大径测值与术后病理测值的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 36例CBT中,29例为体检发现肿块或无痛性肿块逐渐增大,7例有临床症状。不同分型出现症状的比例差异无统计学意义(P>0.05,表1)。22例Shamblin Ⅱ型患者中,4例合并高血压;14例Shamblin Ⅲ型患者中,2例合并高血压,两组差异无统计学意义(P>0.05)。

表1 不同分型CBT患者的术前临床症状
2.2 二维超声、CTA及病理分析结果 2例单侧CBT存在2个紧邻瘤体无法进行相关性分析,20例18个组织完整的瘤体术前二维超声最大径测量值为1.9~7.8 cm,中位数3.5(2.6,4.7)cm;CTA测量值为2.0~7.2 cm,中位数3.5(2.6,4.3)cm;术中肉眼观察并探查发现11个为Shamblin Ⅰ型、7个Ⅲ型,术后病理测量值为2.0~8.0 cm,中位数3.4(2.6,5.0)cm(表2,图1);36例中34个病理组织完整的瘤体CTA术前测量值为1.5~9.0 cm,中位数3.7(2.7,4.7)cm,术中肉眼观察并探查发现21个为Shamblin Ⅱ型、13个Ⅲ型,术后病理测量值为1.5~8.0 cm,中位数3.7(3.0,4.6)cm。20例中,1例单侧CBT存在2个紧邻瘤体(病理最大径分别为2.5 cm、3.2 cm),超声仅检测到低位瘤体(最大径2.4 cm),而漏检了高位瘤体;CTA将2个瘤体误诊为1个(最大径测值为6.0 cm),发现两者结果不一致后经DSA确认为上下紧邻的2个瘤体(图2)。彩色多普勒血流显像显示,18个瘤体中,13个血供为AdlerⅡ~Ⅲ级,5个为Ⅰ级。
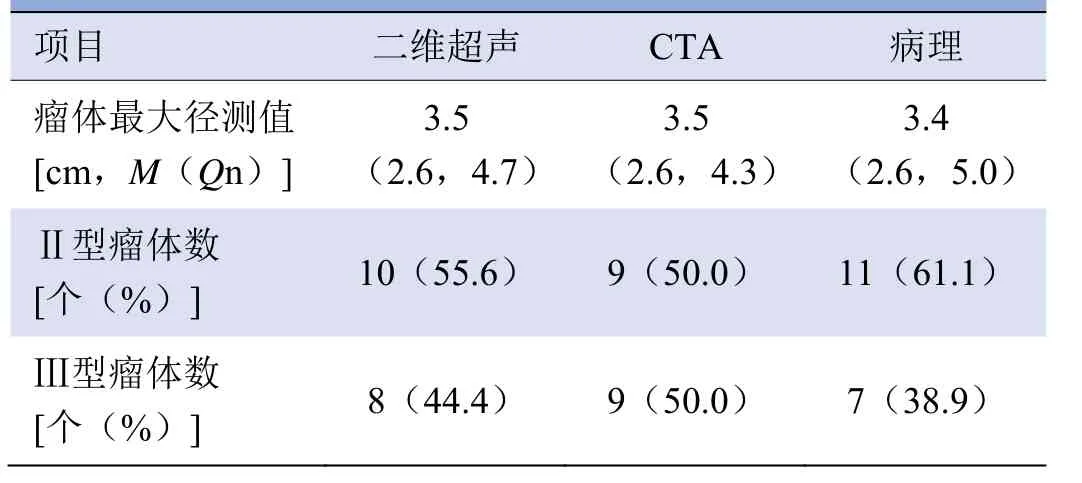
表2 二维超声、CTA 及病理评估18个组织病理完整CBT的大小及分型
2.3 瘤体最大径的术前超声及CTA 评估 20例中18个组织完整的瘤体,二维超声及CTA 对CBT的术前最大径测量值均与术后病理测量值相关(r=0.86、0.75,P均<0.01,图3、4),术前超声和CTA 瘤体最大径测量值差异无统计学意义(t=0.19,P>0.05)。36例中34个组织完整的瘤体CTA 测量值与术后病理测量值相关(r=0.67,P<0.01;图5)。
2.4 超声、CTA术前分型和术中分型的关系 20例18个组织完整的瘤体中,术前超声及CTA分别将1例和2例Shamblin Ⅱ型(术中)误判为Shamblin Ⅲ型(表2,图1),其余瘤体分型与术中一致。当术前超声和CT测量值均<3.0 cm时,术中发现均为Shamblin Ⅱ型;而当两者测量值均>5.0 cm时,则为Shamblin Ⅲ型。

图1 男,46岁,右侧CBT(术中分型为Shamblin Ⅱ型,病理最大径测量值为4.0 cm)。箭头示CBT,箭示右侧颈内动脉。超声示CBT 未完全包绕颈内动脉,为Shamblin Ⅱ型,术前超声最大径测量值为4.0 cm(A);超声示颈内动脉及CBT的彩色血流信号(B);CTA 示CBT 完全包绕颈内动脉,为Shamblin Ⅲ型,术前CTA 最大径测量值为4.0 cm(C)
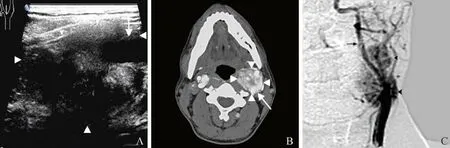
图2 男,38岁,双侧CBT(左侧2个紧邻瘤体,右侧1个瘤体),手术切除左侧2个紧邻瘤体(病理最大径测值分别为2.5 cm、3.2 cm),超声漏检高位瘤体,而CTA 将2个紧邻瘤体误判为1个,发现两者结果不一致后经DSA 确认为上下紧邻的2个瘤体。箭头示CBT,箭示左侧颈内动脉。超声测得低位瘤体的最大径为2.4 cm(A);CTA 测得最大径为6.0 cm(B);DSA 示上下2个紧邻的瘤体(C)

图3 20例患者18个组织完整的CBT最大径术前超声与术后病理测值的相关性

图4 20例患者18个组织完整的CBT最大径术前CTA与术后病理测量值的相关性

图5 36例患者34个组织完整的CBT最大径术前CTA与术后病理测量值的相关性
3 讨论
CBT的超声特征是位于颈总动脉分叉处、形态规则、回声不均匀的实性低回声团块,团块完全或部分包绕颈动脉,彩色血流信号丰富[11]。尽管CBT是一种化学感受器瘤,CB通过感受血液成分改变调节机体的呼吸及循环系统[12],但本组患者CBT合并高血压者不多,CBT与循环系统的相互影响不明显,且不同分型合并高血压的比例无显著差异。另外,本组CBT患者的临床症状主要为头颈部疼痛、耳鸣耳聋、吞咽困难、反复头晕和气喘气促,可能与瘤体压迫迷走神经、听神经、舌咽神经、颈动脉、咽、气管等有关,且不同分型患者出现症状的比例无显著差异,CBT症状发生率与分型无明显相关性。
本研究结果显示,术前超声和CTA的CBT最大径测量值无显著差异,两者与术后病理测量值均呈中-高度相关,推测超声评估CBT大小的价值与CTA相近。CTA测量的准确性还取决于仪器扫描层厚值,Jin等[13]研究发现,CTA评估CBT大小较超声更准确,该研究使用CT层厚值为0.6 mm,较本研究使用的层厚值1.0 mm的分辨率高,更为精确。在径线指标选择方面,Jin等[13]报道术前超声和CTA的平均径测量值无显著差异,但平均径的获得受测量切面等诸多因素的影响,重复性低,而最大径较易测得,重复性高,且与预后相关,是一个更好的径线评估指标。
超声及CTA 术前分别将1例和2例Shamblin Ⅱ型(术中)误判为Ⅲ型。超声仪器分辨率不足会导致误判,CTA 的误判可能与层厚、扫描参数等有关。图1病例CTA 将Shamblin Ⅱ型CBT 误判为ShamblinⅢ型,而超声探头可以通过多方向动态扫查及加压判断肿块是否与颈内动脉粘连,因此对个别病例的判断比CTA 更有优越性。本研究发现,超声联合CTA检查时,当术前超声和CTA 测量值均<3.0 cm 时,术中发现均为Shamblin Ⅱ型,而当两者测值均>5.0 cm 时,则为Shamblin Ⅲ型。
另外,对于单侧存在的2个紧邻CBT,CTA 和超声均存在诊断缺陷,超声漏诊了高位瘤体,CTA 将2个瘤体误认为1个。超声易漏诊位置高的瘤体或小的CBT,主要原因为高位瘤体超声扫查困难,而小瘤体超声难以与淋巴结、神经源性肿瘤鉴别,结合超声声学造影或可提高超声对高位CBT 和小瘤体的检出率。而超声联合CTA检查则有助于准确判断分型。
本研究的局限性:样本量偏少,34个和18个组织完整瘤体的CTA测值与术后病理测值的相关系数有波动。
总之,超声评估CBT 大小和分型方面有较高的应用价值,当与CTA 联合应用时可以更准确地判断其分型。
