低氧诱导因子-3α对胎盘滋养层细胞生长的影响
2021-04-16张丹孙大光张璐马旭夏红飞
张丹,孙大光,3,张璐,马旭*,夏红飞*
(1.国家卫生健康委科学技术研究所遗传优生中心,北京 100081;2.北京协和医学院研究生院,北京 100730;3.重庆市人口和计划生育科学技术研究院,重庆 400020)
低氧诱导因子(hypoxia inducible factor,HIF)是一种转录因子,它参与细胞对低氧的适应性生理反应,包括免疫细胞激活、增殖和凋亡等[1-3]。HIF家族在大多数脊椎动物中有3个不同的成员,即HIF-1、HIF-2和HIF-3,均由α和β两个亚基组成,属于基本螺旋-环-螺旋(basic helix-loop-helix,bHLH)-下游钟基因-芳香烃受体核转位子-专一性蛋白结构域(per-arnt-sim,PAS)超家族成员,其中α亚基是调节HIF活性的功能亚基[4]。与HIF-1和HIF-2[5]相比,对HIF-3的研究较少。最初由Gu等[4]在1998年发现小鼠低氧诱导因子-3α(hypoxia inducible factor-3α,mHIF-3α),2001年Hara等[6]发现了人类HIF-3α。人HIF-3、HIF-1、HIF-2的α亚基中的bHLH及PAS区高度相似,但HIF-3的α亚基C端缺乏转录激活结构;此外,HIF-3α能抑制人肾脏中由HIF介导的低氧诱导基因的表达,它可能是低氧期间基因表达的负调节器[6]。有研究发现HIF-3α是一个氧依赖的转录激活因子,它的转录激活作用是保守的,如人HIF-3α-1和HIF-3α-9能上调相似的基因[7]。HIF-3α是在生理和病理条件下对人类低氧反应进行微调的一个重要因子[8]。低氧能迅速激活HIF-3的表达[9],同时,低氧也可引起胎盘功能减退或老化,但HIF-3α对胎盘细胞是否有影响目前尚不清楚。在本研究中,我们以HTR8/SVneo细胞系作为研究对象,我们设计HIF-3α的过表达和敲低的实验,探究HIF-3α对HTR8/SVneo细胞在增殖和凋亡、迁移和浸润等方面的影响,从而预测它在胎盘中的作用。
材料与方法
一、实验材料和试剂
1.细胞株:人绒毛膜滋养层细胞(HTR8/SVneo细胞)由中国科学院动物研究所王雁玲和王红梅老师赠送。
2.主要试剂与仪器:pcDNA3.1(+)质粒(Thermo Fisher Scientific,美国);HIF-3α抑制物(scramble siRNA、HIF-3αsiRNA #1、HIF-3αsiRNA #2和HIF-3αsiRNA #3)购自上海吉玛生物公司;MTT(Sigma-Aldrich,美国);Cell-Light EdU Apollo643 In Vitro Imaging Kit试剂盒购自广州锐博生物;Annexin V/PI试剂盒(Invitrogen,美国);兔抗HIF-3α多克隆抗体(Genetex,美国);小鼠抗β-ACTIN单克隆抗体(Abcam,美国),辣根过氧化物酶(Horseradish peroxidase,HRP)标记的羊抗兔和羊抗小鼠IgG二抗购自北京中杉金桥;Synergy2 多功能酶标仪(Biotek,美国);TE2000-U倒置荧光相差显微镜(尼康,日本);流式细胞仪(Beckman coulter,德国)。
二、实验方法
1.载体构建:由生工生物工程(上海)股份有限公司合成人HIF-3α的编码序列(Coding domain sequence,CDS),并插入真核表达载体pcDNA3.1(+),即获得HIF-3α表达载体pcDNA3.1-HIF-3α。
2.细胞转染:实验分为pcDNA3.1组、pcDNA3.1-HIF-3α组、scramble siRNA组和HIF-3αsiRNA组(从HIF-3αsiRNA #1、HIF-3αsiRNA #2和HIF-3αsiRNA #3抑制剂中筛选最佳抑制剂供HIF-3αsiRNA组使用),其中pcDNA3.1组是pcDNA3.1-HIF-3α组的阴性转染组,scramble siRNA组是HIF-3αsiRNA组的阴性转染组。将HTR8/SVneo细胞接种于6孔板,当细胞密度达80%时,各组按照下表1进行转染,转染 24 h后,根据后续实验需求将转染后的细胞分别接种于不同的孔板中。

表1 细胞转染加样量情况
3.MTT法检测细胞活力:细胞转染24 h后,以每孔5 000个细胞接种于96孔板,再过24 h加入20 μl 5 mg/ml MTT,避光孵育4 h后弃上清,加入200 μl二甲基亚砜,10 min后检测样品在A570 nm处的吸光度。为了避免组内误差设置3个重复孔;为了降低实验误差和批间差异,每组实验至少重复3次。MTT=实验组A570 nm/对照组A570 nm×100%。
4.EdU法检测细胞增殖:细胞转染24 h后,以每孔5×104个细胞接种于24孔板。24 h后根据EdU试剂盒说明书,用细胞培养基按照1 000∶1的比例稀释EdU溶液,EdU终浓度为50 μmol/L。细胞培养板每孔加入200 μl EdU培养基,37℃ 孵育2 h,弃培养基,用4%多聚甲醛固定细胞,然后每孔加入200 μl 1×Apollo染色液,室温孵育30 min,最后每孔加入200 μl 1×Hoechst33342反应液孵育30 min进行DNA染色。显微镜下随机取5个视野,分别计数视野下EdU标记的红色荧光细胞数和Hoechst33342标记的蓝色荧光细胞总数,每组实验至少重复3次。细胞增殖率=EdU标记的细胞数/Hoechst33342标记的细胞数×100%。
5.流式细胞术检测细胞凋亡:细胞转染24 h后,以每孔5×104个细胞接种于24孔板。24 h后根据Annexin V/PI 凋亡检测试剂盒说明书,用2.5 μl AnnexinV-FITC储液和5μl 20 μg/ml磷脂酰肌醇(Phosphatidylinositol,PI)混匀后加入每组的细胞悬液中,避光室温孵育15 min,用流式细胞仪对标本进行定量分析,每管共检测8 000个细胞。每组设置2个重复,试验重复3次。Annexin V-FITC/PI双染流式细胞术依据不同功能状态下细胞对染料的吸收作用不同分别采集到早期凋亡和晚期凋亡细胞的荧光信号,检测得到的二维散点图的4个象限分别代表不同状态的细胞,左上方区域的细胞为坏死细胞,右上方区域的细胞为晚期凋亡细胞,右下方区域的细胞为早期凋亡细胞,左下方区域的细胞为活细胞。
6.细胞培养小室(Transwell)法检测细胞浸润和迁移能力:在细胞迁移的检测中,用RPMI-1640培养基重悬并调整细胞浓度为 0.5×109个/L,将100 μl细胞悬液移入小室中,在下室里添加600 μl的培养基(内含2.5%胎牛血清),18 h后加入结晶紫染色液染色10 min。在细胞浸润的检测中,Transwell小室上有稀释的基质胶(1∶3),加入含0.5×105个/L的细胞悬液,12 h后用结晶紫进行染色,镜下观察细胞。任意取5个视野(目镜20×)记录细胞的总数,每组重复3次。
7.蛋白质印迹法(Western blot):各组细胞提取蛋白后,取60 μg蛋白在裂解液变性后,经10%十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳达分离,然后转膜(硝酸纤维素膜),室温下用5%脱脂奶粉孵育1 h,依次与1∶1 000稀释的一抗(兔抗HIF-3α多克隆抗体和小鼠抗β-ACTIN单克隆抗体)和1∶10 000稀释的二抗(HRP标记的羊抗兔和羊抗小鼠IgG)均室温孵育1 h,最后,用ECL发光液进行显色、曝光。利用Image J软件分析目标条带的灰度值。β-actin为内参,每组实验至少重复3次。
三、统计学方法

结 果
一、HIF-3α的过表达和敲低实验的验证结果
Western Blot分别检测转染pcDNA3.1- HIF-3α质粒和HIF-3αsiRNA的HTR8/SVneo细胞中HIF-3α的表达水平,结果显示pcDNA3.1- HIF-3α的过表达是有效的(P<0.05),而且HIF-3αsiRNA的敲低也是高效的(P<0.05),HIF-3αsiRNA #1、HIF-3αsiRNA #2和HIF-3αsiRNA #3的敲低效率分别是60.0%、66.6%和50.1%(图1)。后续实验选用HIF-3αsiRNA #2作为HIF-3αsiRNA组处理HTR8/SVneo细胞。
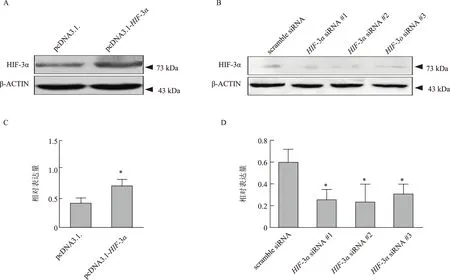
A:Western Blot检测pcDNA3.1- HIF-3α质粒在HTR8/SVneo细胞中的表达;B:Western Blot检测HIF-3α siRNA在HTR8/SVneo细胞中的表达;C:过表达HIF-3α的Western Blot检测结果灰度分析,与pcDNA3.1组比较,*P<0.05;D:敲低HIF-3α的Western Blot检测结果灰度分析,与scramble siRNA组比较,*P<0.05图1 过表达和敲低HIF-3α结果
二、HIF-3α对HTR8/SVneo细胞活性和细胞增殖的影响
EdU法检测细胞增殖发现,与pcDNA3.1组相比,pcDNA3.1-HIF-3α处理组细胞的增殖能力显著增强(P<0.05);与scramble siRNA组相比,HIF-3αsiRNA处理组细胞增殖显著降低(P<0.05)(图2)。MTT法检测细胞活性发现,与pcDNA3.1组比较,pcDNA3.1-HIF-3α组细胞活力无显著差异(P>0.05);与scramble siRNA组比较,HIF-3αsiRNA组细胞的细胞活力显著升高(P<0.05)(图3)。
三、HIF-3α对HTR8/SVneo细胞凋亡的影响
Annexin V-FITC/PI双染流式细胞术检测发现,HIF-3α过表达有降低HTR8/SVneo细胞早期凋亡的趋势,但无显著差异(P>0.05);HIF-3α敲低后细胞凋亡无显著差异(P>0.05)(图4)。
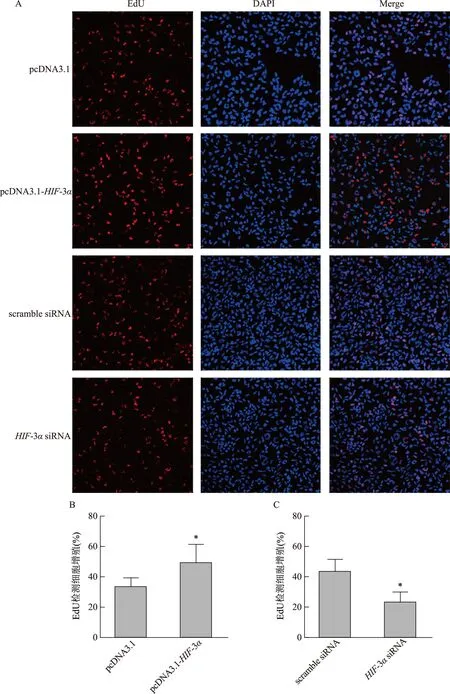
A:EdU荧光成像图(阳性细胞是红色荧光,DAPI复染细胞核是蓝色荧光,Merge是EdU和DAPI的荧光成像合成图像)(×200);B:过表达HIF-3α对HTR8/SVneo细胞增殖的影响,与pcDNA3.1组比较,*P<0.05;C:敲低HIF-3α对HTR8/SVneo细胞增殖的影响,与scramble siRNA组比较,*P<0.05图2 HIF-3α对HTR8/SVneo细胞增殖的影响
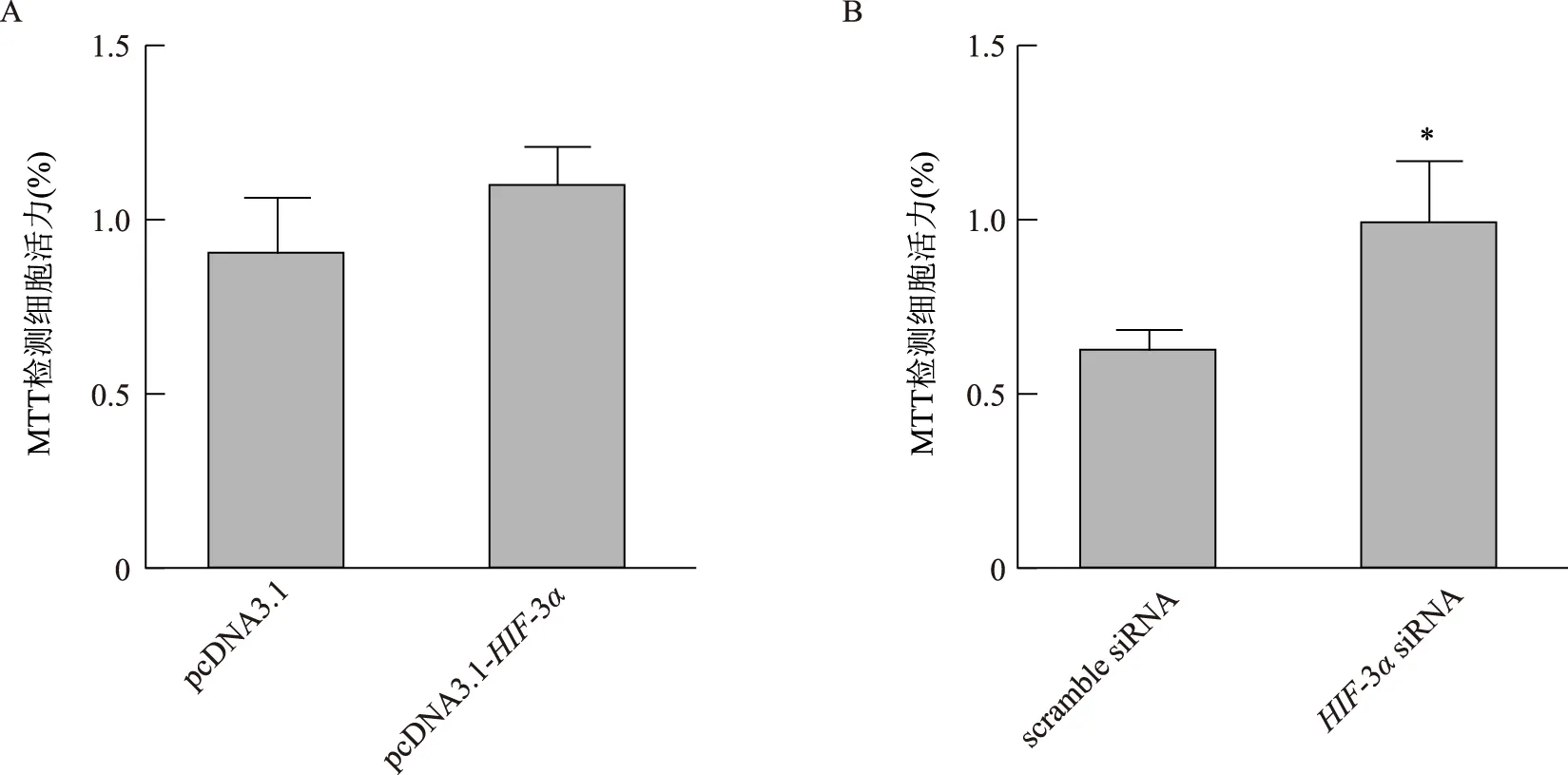
A:过表达HIF-3α对HTR8/SVneo细胞活力的影响;B:敲低HIF-3α对HTR8/SVneo细胞活力的影响;与scramble siRNA组比较,*P<0.05图3 HIF-3α对HTR8/SVneo细胞活力的影响
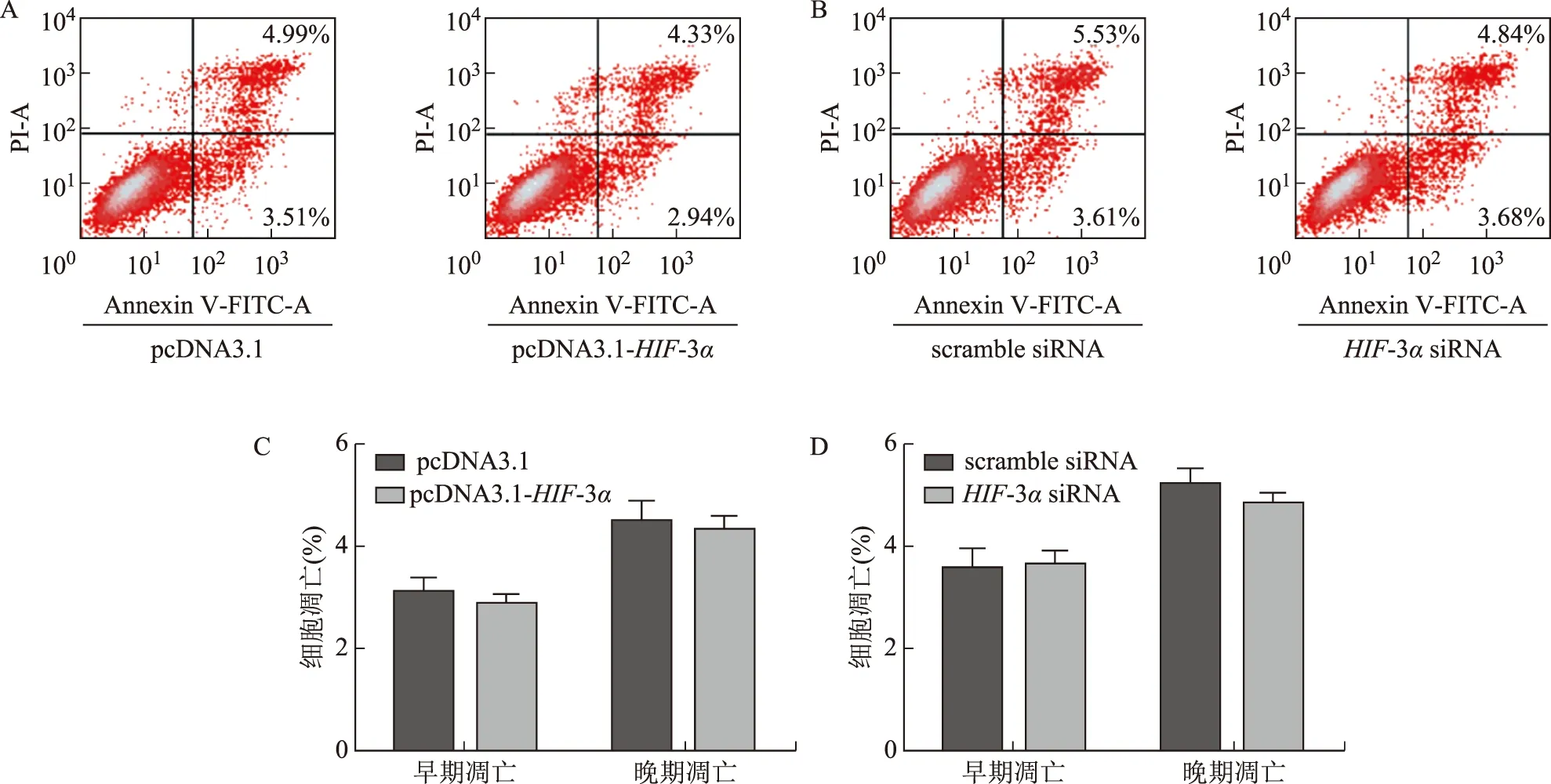
A:流式细胞术检测过表达HIF-3α对HTR8/SVneo细胞凋亡的影响;B:流式细胞术检测敲低HIF-3α对HTR8/SVneo细胞凋亡的影响;C:过表达HIF-3α对HTR8/SVneo细胞早期凋亡和晚期凋亡的影响;D:敲低HIF-3α对HTR8/SVneo细胞早期凋亡和晚期凋亡的影响图4 HIF-3α对HTR8/SVneo细胞凋亡的影响
四、HIF-3α对HTR8/SVneo细胞迁移和浸润能力的影响
Transwell小室法检测发现,HIF-3α过表达处理后细胞的计数显著升高(P<0.05),即HIF-3α过表达可促进HTR8/SVneo细胞的浸润和迁移能力;而HIF-3α敲低处理后细胞的计数显著降低(P<0.05),即HIF-3α敲低可降低HTR8/SVneo细胞的浸润和迁移能力(图5和图6)。
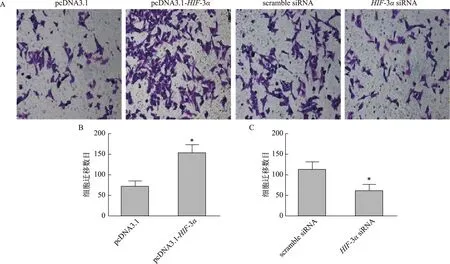
A:Transwell法检测HIF-3α对HTR8/SVneo细胞迁移影响的染色图(×200);B:HIF-3α过表达的Transwell结果柱形图分析,与pcDNA3.1组比较,*P<0.05;C:敲低HIF-3α的Transwell结果柱形图分析,与scramble siRNA组比较,*P<0.05图5 HIF-3α对HTR8/SVneo细胞迁移的影响
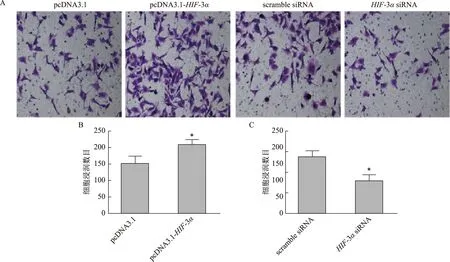
A:Transwell法检测HIF-3α对HTR8/SVneo细胞浸润影响的染色图(×200);B:HIF-3α过表达的Transwell结果柱形图分析,与pcDNA3.1组比较,*P<0.05;C:敲低HIF-3α的Transwell结果柱形图分析,与scramble siRNA组比较,*P<0.05图6 HIF-3α对HTR8/SVneo细胞浸润的影响
讨 论
氧是哺乳动物新陈代谢和生理功能中必不可少的条件之一,它在细胞能量产生和许多酶的辅助因子/底物中扮演着重要角色。机体在有氧条件下,HIFα与希佩尔-林道蛋白(von hippel-lindau,VHL)蛋白相互作用并结合,从而激活泛素连接酶系统,导致HIFα的蛋白酶体降解。低氧时,HIFα表达稳定并与HIFβ相结合形成二聚体,然后转移到细胞核,与低氧应答元件(HREs)结合,参与调控低氧基因表达[9]。HIF可以激活控制细胞氧稳态的基因,包括与氧消耗、红细胞生成、血管生成和线粒体代谢有关的基因。低氧细胞通过转录和转录后机制应对低氧环境的影响,这主要受HIF调控[10]。低氧会使HIF-3αmRNA表达水平升高[11]。已有研究发现大鼠在低氧环境下,在肺和其他器官中HIF-3αmRNA表达水平显著增加[12-14]。低氧条件下斑马鱼中HIF-3αmRNA和蛋白质表达水平也会升高[15]。本实验中,我们通过HIF-3α在HTR8/SVneo细胞中过表达和敲低的实验可知,它的表达水平对HTR8/SVneo细胞的增殖、活力、迁移和浸润功能均有影响。并且HIF-3α的过表达对HTR8/SVneo细胞的迁移和浸润能力、细胞增殖都有显著的促进作用(P<0.05)。而细胞的增殖、迁移、浸润等功能在胚胎组织器官发育中发挥着重要的作用,我们认为HIF-3α可能参与胎盘在胚胎发育中的调控过程。HIF-3α基因的表达是通过HIF-1α和HIF-2α诱导的[16-17]。因此,HIF-3α基因产物可能在低氧诱导基因表达的负反馈调节中发挥关键作用[18]。目前对HIF-3α的作用尚未完全了解,长期以来人们一直认为它与HIF-1α和HIF-2α的表达负相关,并直接或间接调节低氧诱导的病理过程[19]。我们发现HIF-3α敲低对HTR8/SVneo细胞的迁移和浸润能力、细胞增殖有很显著的抑制作用(P<0.05),但对细胞活力有显著的促进作用(P<0.05),对HTR8/SVneo细胞早期凋亡的影响无显著差异(P>0.05)。总之,HIF-3α过表达或敲低都对HTR8/SVneo细胞的增殖、迁移和浸润能力有显著影响(P<0.05),说明HIF-3α是调节HTR8/SVneo细胞增殖、迁移和浸润能力的重要因子。
HIF-3是一种氧依赖性转录因子,它可以通过调控其下游的基因[20]激活应对缺氧的独特转录反应[7]。已有的研究证明HIF-3α除了低氧环境的应激调控外、在糖代谢中也发挥作用[21]。我们推测它参与胎盘某些重要功能(如内分泌功能与浸润功能等)的过程,那么也可能在妊娠中多种疾病的发生过程有着重要的调控作用。
