大黄酸分散体对糖尿病大鼠肝损伤的抑制机制
2021-04-16吕怀恩王文永付静波张宝生董晓宇高玲焕
吕怀恩,王文永,王 蕊,王 鹏,付静波,张宝生,董晓宇,高玲焕
(1.唐山市丰润区人民医院药剂科,唐山 063000;2.华北理工大学基础医学院,唐山 063000)
糖尿病发生率有持续增长趋势,2型糖尿病发病率较高,糖尿病死亡的主要原因是后期多器官损伤,其中糖尿病肝、肾损伤占比较高[1-4]。大黄酸(rhein)是大黄等中药的活性成分,近年来研究报道较多[5],但rhein溶出度差,吸收慢。课题组前期研究表明,以聚乙烯吡咯烷酮为载体将rhein制成固体分散体,能明显增加rhein的溶解度,提高其生物利用度,动物实验显示其对高糖所致肾损伤有抑制作用[6]。rhein具有抑制乙醇损伤肝脏作用[7],对肝脏有保护作用,但rhein对糖尿病肝脏病理改变的影响及机制的相关文献很少,特别是大黄酸分散体(rhein-F)对糖尿病肝损伤的作用未见文献报道。本研究应用rhein-F干预糖尿病大鼠,观察其对肝损伤的影响并与rhein比较,为rhein-F的进一步研究奠定了实验基础。
1 仪器与材料
1.1仪器 GA-3型血糖仪及试纸(Sinocare);Chemray 420 型全自动生化分析仪(美国Rayto);200PRO 型多功能酶标仪(瑞士Tecan);H-7650 型透射电子显微镜(日本日立有限公司);光学显微镜(日本Olympus);真彩病理图像分析系统(高腾科技有限公司);5180R型高速低温离心机(德国Eppendorf);F6-10-8G型超细匀浆机(FLUKO);DYY-6C型电泳仪(北京六一生物科技有限公司);G560E型涡旋混合器(美国Scientific Industries);FA2104N型电子天平(上海第二天平仪器厂);Unervirsal Hood Ⅲ型全自动曝光机(Bio-Rad Laboratories)。
1.2试药 链脲佐菌素(STZ,Sigma公司,批号18883-66-4);大黄酸(Bio-Bustyl,湖北云镁科技有限公司,批号478-43-3,质量分数>98%);血清谷草转氨酶(AST)、谷丙转氨酶(ALT)测定试剂盒(南京建成药业有限公司,批号分别为:C010-3-1、C009-3-1);PVDF 膜(美国Milipore公司,批号K5EA5857D);RIPA裂解液(Solarbio,批号R0020);蛋白浓度测定试剂盒(APPLYGEN基因技术有限公司,批号P1511);三磷酸甘油醛脱氢酶(GAPDH)、核因子-κB (NF-κB) 和过氧化物酶体增殖物激活受体-γ(PPAR-γ抗体),均购自Santa Cruz Biotechnology.Inc;糖基化终产物(AGEs)酶联免疫吸附(Elisa)试剂盒(武汉基因美科技有限公司);麦芽糖(上海信裕生物科技有限公司,批号20150127);羧甲基纤维素钠(CMC-Na,淄博海澜化工有限公司,批号20161003); 3,3′-二氨基联苯胺四盐酸盐 (DAB,江苏凯基生物技术股份有限公司,批号20180531);磷酸盐缓冲液(PBS,北京梦怡美生物科技有限公司,批号20160920);戊二醛(上海复申生物科技有限公司,批号20181104);洗膜缓冲液(TBST,自制)。
1.3实验动物 Wistar大鼠50只,SPF级,雄性,体质量为(190±25) g,大鼠普通饲料及高脂饲料,均购于北京华阜康生物科技有限公司,许可证号:SCXK(京)2014-0004。实验均在华北理工大学SPF实验室进行。
2 实验方法
2.1rhein-F的制备方法 按照参考文献方法制备[6]。
2.2大鼠2型糖尿病模型的建立 大鼠适应性饲养1周后,随机选取10只常规饲养,作为正常对照(NC)组。另外40只大鼠给予高脂饲料喂养10周,禁食20 h,尾静脉注射12.5 g·L-1STZ(柠檬酸-柠檬酸钠缓冲液稀释),注射量为25 mg·kg-1。NC组大鼠同时尾静脉注射等量的柠檬酸-柠檬酸钠缓冲液。STZ注射1周后,所有大鼠禁食8 h,取尾静脉血测定空腹血糖(FBG),2次FBG均≥16.7 mmol·L-1的大鼠被视为造模成功,选入实验组。
2.3分组与给药 10只正常大鼠作为NC组。大鼠共成模36只,剔除血糖过高和体质量过高或较低的6只,剩余30只,按照血糖高低顺序编号,从第1只大鼠开始,按编号顺序每3只大鼠放1个笼内(共10个笼),之后再将每个笼内的3只大鼠随机分到糖尿病模型组(DM)、rhein组和rhein-F组中,每组10只。rhein组与rhein-F组给药量均为80 mg·kg-1(所含rhein剂量相等),rhein组与rhein-F分别用5 g·L-1的CMC-Na配成混悬液,同时NC组与DM组给予同体积CMC-Na溶液。各组大鼠每日固定同一时间给药,连续给药8周。
2.4观察指标
2.4.1FBG与餐后血糖(PBG) 给药8周后,测定大鼠禁食8 h后的FBG;给药8周后各组大鼠禁食16 h后给药,于0.5 h灌胃麦芽糖2 g·kg-1,分别检测麦芽糖灌胃后1、2 h的PBG。
2.4.2血清AST、ALT、AGEs和肝脏指数(LI)的测定 给药后禁食16 h,用100 g·L-1水合氯醛腹腔注射(3 mL·kg-1)麻醉大鼠,负压管经腹主动脉取血,分离血清。用全自动生化分析仪测定血清中AST和ALT活性,用Elisa法测定AGEs含量;取血后立即剖腹取肝脏,置于磷酸盐缓冲液(PBS)中,用吸水纸吸干血,称定肝质量。计算LI,LI=大鼠肝质量(g)÷大鼠体质量(g)×100%。
2.4.3肝组织病理学观察 切取每只大鼠1/4的肝左叶,立即置于甲醛固定液中,48 h后常规石蜡包埋、切片、苏木精-伊红(HE)染色,光镜下观察肝组织的病理改变;马松染色(Masson)观察肝脏纤维组织的增生情况。迅速切取约0.5~1.0 mm3肝组织,置于2.5 g·L-1戊二醛中,切片超薄制备,染色,透射电镜观察超微结构及拍照。
2.4.4免疫组织化学法测定肝组织PPAR-γ和NF-κB蛋白表达 肝组织石蜡切片3.5 μm,脱蜡水化,修复抗原,血清封闭,分别加入PPAR-γ和NF-κB抗体(1∶250),4 ℃孵育过夜,PBS洗后二抗37 ℃孵育1 h,PBS洗后滴加DAB显色1 min,纯水中终止后染核。棕黄染色为阳性表达,用Image-Pro Plus 6.0测定积分光密度值(IOD值)。
2.4.5Western Blot检测肝组织PPAR-γ和NF-κB蛋白表达 液氮研磨肝组织,低温离心后取上清液,BCA蛋白定量,上样量50 μg,80 V恒压电泳,200 mA恒流电转至PVDF膜,5 g·L-1牛血清白蛋白(BSA)室温封闭1 h,一抗(PPAR-γ1∶500,NF-κB 1∶1 000),4 ℃孵育过夜。TBST洗膜3次后二抗(1∶5 000),室温孵育1 h,洗膜后显影。条带采用Image J软件测定灰度值,与内参GAPDH的比值表示其相对含量。

3 结果
3.1rhein-F对糖尿病大鼠FBG和PBG的影响 见表1。由表1可知,DM组的FBG和PBG明显高于NC组(P<0.01);rhein组和rhein-F组的FBG和PBG均明显低于DM组(P<0.01),空腹8 h后rhein-F组血糖略低于rhein组,但差异无统计学意义(P>0.05)。灌胃麦芽糖后rhein-F组血糖值明显低于rhein组,特别是餐后1 h血糖明显低于rhein组(P<0.01)。
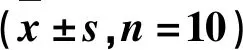
表1 rhein-F对糖尿病大鼠FBG和PBG的影响Tab.1 Effect of rhein-F on FBG and PBG indiabetic rats
3.2rhein-F对糖尿病大鼠血清AST、ALT、AGEs和LI的影响 见表2。DM组大鼠血清ALT、AST、AGEs和LI明显高于NC组(P<0.05 或P<0.01),rhein组和rhein-F组的上述各指标均不同程度的低于DM组,rhein-F组降低更明显,rhein-F组对AST和AGEs的降低明显优于rhein组。

表2 rhein-F对糖尿病大鼠血清AST、ALT、AGEs和LI的影响 Tab.2 Effect of rhein-F on serum AST,ALT,AGEs and LI in diabetic rats
3.3rhein-F对糖尿病大鼠肝组织病理结构的影响 HE染色:NC组(见图1-A1)大鼠肝组织未见炎细胞浸润和小脂滴,组织结构基本正常;DM组(见图1-A2)大鼠肝组织结构紊乱,肝细胞出现脂肪变性,散在炎症细胞浸润和片状出血点;rhein组(见图1-A3)和rhein-F组(见图1-A4)脂滴空泡和炎症细胞明显减少,肝组织形态结构明显改善,rhein-F组肝组织形态结构明显优于rhein组。
Masson染色:NC组大鼠肝组织在门静脉处几乎未见亮绿染色的胶原纤维物质(见图1-B1);DM组肝脏组织可见较多的亮绿染色的胶原纤维,主要分布在血管和汇管区周围(见图1-B2);与DM组比较,rhein组(见图1-B3)和rhein-F组(见图1-B4)亮绿染色组织减少。
透射电镜:NC组大鼠肝细胞核膜光滑,核较大,包浆中内质网、高尔基体等细胞器丰富,形态正常(见图1-C1);DM组肝细胞内可见线粒体肿胀,空泡化,数量减少,内质网扩张和断裂,可见散在脂滴和胶原纤维(见图1-C2);rhein组(见图1-C3)和rhein-F组(见图1-C4)肝细胞超微结构明显改善,少见脂滴和胶原纤维,rhein-F组超微结构改变较rhein组轻。
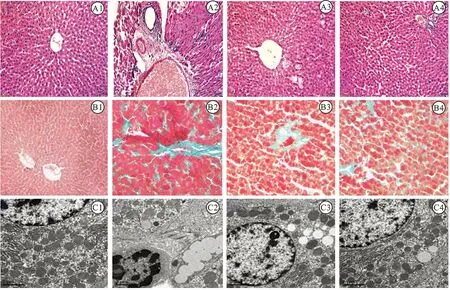
图1 糖尿病大鼠肝脏组织的形态结构1.正常对照组;2.糖尿病模型组;3.大黄酸组;4.大黄酸分散体组;A.苏木精-伊红染色结果;B.马松染色结果;C.透射电镜结果。Fig.1 Morphological structure of liver tissues in diabetic rats1.NC group;2.DM group;3.rhein group;4.rhein-F group;A.HE staining;B.Masson staining;C.Electronic microscope.
3.4rhein-F对糖尿病大鼠肝组织PPAR-γ和NF-κB蛋白表达的影响 见图2和表3。
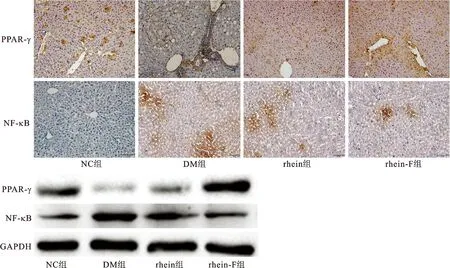
图2 糖尿病大鼠肝组织中PPAR-γ和NF-κB蛋白表达的免疫组化图片和Western Blot条带Fig.2 Immunohistochemistry images and Western Blot bands of PPAR-γ and NF-κB protein expression in liver tissues of diabetic rats
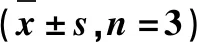
表3 糖尿病大鼠肝组织中PPAR-γ和NF-κB蛋白表达的免疫组化和Western Blot结果Tab.3 Immunohistochemistry and Western Blot results of PPAR-γ and NF-κB protein in liver tissues of diabetic rats
3.4.1免疫组化结果 由图2和表3可知,NC组大鼠肝组织PPAR-γ蛋白质表达呈强阳性,可见较多棕黄色染色颗粒,以细胞浆分布为主;NF-κB蛋白在NC组肝组织中几乎无表达;而DM组PPAR-γ和NF-κB蛋白表达量与NC组相反(P<0.01);rhein组PPAR-γ蛋白质表达明显高于DM组(P<0.05),NF-κB蛋白表达明显低于DM组(P<0.01);rhein-F组作用强于rhein组。
3.4.2Western Blot结果 由图2和表3可知,大鼠肝组织PPAR-γ蛋白表达条带的灰度值NC组和rhein-F组明显高于DM组(P<0.01),而NF-κB蛋白的表达DM组明显高于NC组和rhein-F组(P<0.01);rhein-F组上调PPAR-γ蛋白表达和下调NF-κB蛋白表达的作用强于rhein组。Western Blot结果与免疫组化结果基本一致。
4 讨论
多数复方中药中均含有rhein,如三黄泻心汤、大黄附子汤及茵陈蒿汤等[8],其中发挥药效的主要活性成分为rhein[9]。但由于rhein是难溶性的,使其很难充分发挥作用。因此,近年来利用药物制剂新技术对rhein的新剂型和结构改造进行了大量研究,明显地提高了其生物利用度[10-11]。固体分散体技术可增加难溶性药物的溶解度和溶出速率,提高药物的生物利用度,从而充分发挥药物活性[12-14]。本实验在前期研究的基础上,观察了rhein-F对2型糖尿病大鼠肝损伤的抑制作用,测定相关蛋白表达含量探讨其作用机制,并与单纯rhein比较。血糖测定结果显示,rhein组和rhein-F组均可降低FBG,但二者之间差异无统计学意义(P>0.05);rhein-F组对PBG的降低更明显,特别是对餐后1 h血糖的降低明显强于rhein组,表明rhein-F作用更快、更强,可能与rhein-F使rhein溶出度增加、提高生物利用度有关,因此,rhein-F能更好地抑制PBG的升高。
rhein-F组对AST和AGEs的降低作用明显强于rhein组,表明rhein-F改善糖尿病肝功能的作用强于rhein;同样rhein-F对高糖所致肝脏病理损伤的抑制作用也强于rhein,主要表现在抑制肝组织脂肪变性、抑制胶原纤维增生和超微结构的改变,显示了rhein-F有更好的肝保护作用。
进一步探讨rhein的作用机制发现,rhein和rhein-F都可使肝组织中PPAR-γ蛋白表达水平升高、NF-κB蛋白表达水平降低;免疫组化和Western Blot方法结果基本一致,且rhein-F作用强于rhein。研究发现,NF-κB是炎症反应的中心介质,而PPAR-γ可抑制NF-κB的活性和增加胰岛素敏感性[15]。Yu C等[16]报道,rhein可通过抑制NF-κB活性达到预防内毒素所致急性肾损伤。曾庆云等[14]研究发现,rhein可促进PPAR-γ蛋白表达,改善胰岛素敏感度。同时rhein具有较强的抗炎、抗氧化和抗细胞外基质增生作用[17-19]。本研究表明,rhein及rhein-F抑制糖尿病肝损伤的机制可能与其上调PPAR-γ和下调 NF-κB蛋白表达及降糖、抑制AGEs产生有关。推测rhein为过氧化物酶体增殖物激活受体(PPAR)的激动剂,达到降糖作用和抗炎作用,从而发挥肝保护作用。
前期研究已报道rhein-F的溶解度增大,生物利用度增加,稳定性更高[6]。STZ糖尿病模型大鼠和自发2型糖尿病db/db小鼠都灌胃给予rhein和rhein-F (二者所含rhein剂量同等),结果显示,二者均可减轻肾组织病理损伤,改善糖尿病肾功能[20-21]。但rhein对糖尿病肝损伤的影响研究报道较少,本实验应用高脂饮食与STZ制备2型糖尿病大鼠模型,进一步考察了rhein-F对糖尿病肝功能及肝组织病理损伤的影响,结果显示,rhein和rhein-F具有良好的保护组织器官的作用,与rhein相比,rhein-F具有作用更快、更强和更持久的特点,再次证明了rhein-F作用优于rhein。
综上所述,rhein-F可降低血糖,抑制肝脏组织病理损伤,对糖尿病肝脏有保护作用,同等剂量下作用优于rhein。作用机制除了抗炎、抗氧化外,尚与抑制AGEs产生及上调PPAR-γ和下调 NF-κB蛋白表达有关。
