回输卡介苗激活的T淋巴细胞重塑裸鼠硬脑膜淋巴管结构
2021-04-14谢毓峰祁方昉王清波
谢毓峰,祁方昉,王清波,王 飞
(1.中山大学医学院,广东广州 510080;2.中山大学孙逸仙纪念医院外科教研室,广东广州 510120;3.中山大学中山医学院解剖教研室,广东广州 510080;4.中山大学孙逸仙纪念医院麻醉科,广东广州 510120)
在传统观念上,中枢神经系统是一个免疫豁免区域,由于血脑屏障这一天然的物理屏障存在,使得中枢与外周相隔。近几年的研究发现,在硬脑膜内存在着淋巴管样结构[1],并发现该结构与外周淋巴结相联通[2]。随着研究的深入,证明了该结构具有典型的淋巴管道的特征,并且具备引流至颈部淋巴结的能力[3]。因此,脑膜淋巴管与脑内疾病的关系备受关注。小鼠脑内的代谢产物或有害物质积聚在脑内引起神经炎症,影响脑脊液循环,引起神经元的损害等,这些可能导致阿尔茨海默症(Alzheimer’s disease,AD)发病率增加[4]。淋巴管系统不仅负责清除碎屑,而且负责组织免疫监视的调节。在脑膜淋巴管研究中就发现其中含有大量的T 细胞,通过消融了淋巴管后,会引起脑实质的灌注受损和脑脊液引流受损,使得脑内大分子扩散速率减慢,从而影响了空间学习和记忆障碍[5]。脑膜淋巴管发育相关方面的研究发现,脑膜淋巴管的发育依赖于细胞因子,其中包括血管内皮生长因子C(vascular endothelial growth factor C,VEGF-C)等与内皮细胞相关的细胞因子[6-7]。但外周免疫是如何影响脑膜淋巴管的发育及淋巴管引流等功能,目前尚未有明确的研究报道。因此,本实验研究外周免疫缺失下,脑膜淋巴管形态及功能的变化,为外周免疫系统与中枢系统之间的联系提供一定的基础研究依据。
1 材料与方法
1.1 实验动物和饲养
8 周龄雌性裸鼠,8 周龄雌性BALB/c 小鼠,均购自广东省实验动物中心[实验动物为SPF 级,许可证号:SYXK(粤)2019-0209]。实验动物饲养于SPF 环境:温度(22±2)℃,湿度(55±5)%,12 h 光照和12 h黑暗条件,食物和水自由获取。本研究所采取的尾静脉注射均在SPF 环境内进行。本研究所有动物实验操作程序获得中山大学实验动物伦理委员会机构审批并通过。
1.2 T细胞采集及回输
给BALB/c 小鼠颈背部皮下注射卡介苗,7 日后,取供体小鼠的脾脏,使用RPMI 培养基1640 basic(Life Technologies,北京,中国)加入10 g/L 胎牛血清和抗生素,用注射器栓塞研磨成均质单细胞悬液。用ACK 裂解缓冲液裂解红细胞(1X,555899,Biolegend)。脾细胞洗涤后,用浓度为1×108个细胞/mL 的分离缓冲液重悬。对CD3+的淋巴细胞,采用专门为CD3+T 淋巴细胞设计的EasySep T 细胞分离试剂盒(Stem Cell Technologies),通过阴性选择进一步分离T 淋巴细胞。本研究中,通过尾静脉注射用1×107个单核T 淋巴细胞重建每只裸鼠,总体积为200µL。
1.3 免疫荧光染色法
小鼠按10 mL/kg 经腹腔注射40 g/L 水合氯醛过量麻醉。剪开颈部皮肤,用眼科镊分离出颈部淋巴结,放 入40 g/L 多 聚 甲 醛(paraformaldehyde,PFA)的固定液4 ℃固定24 h,梯度脱水后行连续冰冻切片(厚度20µm)。取完颈部淋巴结后,用预冷的磷酸盐缓冲液(phosphate buffer,PBS)心脏灌注,去除小鼠外周血,剪去颈后肌肉,将颅骨从枕骨大孔剪至上颚,用手术剪去除颅骨周围多余的骨组织,用眼科镊将脑组织从颅骨内剥离,将颅骨连带硬脑膜一起放入20 g/L 多聚甲醛4 ℃固定,不超过24 h[8],PBS 漂洗一遍后在体视显微镜下,用眼科镊将硬脑膜从颅骨内轻轻剥离。
CD11b+/Lyve-1+双标染色:将硬脑膜经PBS 洗后,用含2 g/L Triton X-100 牛血清蛋白(bovine serum albumin,BSA)于37 ℃孵育30 min,加入一抗:大鼠抗-CD11b(1:500)、羊抗-Lyve-1(1:500)于37 ℃孵育2 h后4 ℃过夜,次日用PBS漂洗3次后加入二抗:Alexa Flour 594 驴抗大鼠-IgG(1:500)、Alexa Flour 488 驴抗羊-IgG(1:500),于37 ℃孵育2 h,PBS 漂洗3 次后,用荧光封片剂(0.01 mmol/L PBS和甘油1:1配比)封片。
封片完毕后于激光共聚焦显微镜(ZEISS780)下扫描拍照。应用Image J图像分析软件对CD11b+的细胞进行计数,应用Image J 图像分析计算出脑膜内淋巴管上皮细胞lyve-1+荧光强度(AU);并以BALB/C 组为基准,比较各组脑膜内淋巴管上皮细胞lyve-1+荧光强度。应用Image J 计算淋巴结内lyve-1+细胞占图中整个面积的百分比(ROI)。
1.4 统计学分析
所有数据采用SPSS 20.0 统计软件分析。数据以均值±标准差或中位数(四分位数间距)表示。裸鼠和BALB/c 小鼠背侧淋巴管内CD11b+的细胞数量,采用Student’sttest 双侧t检验或秩和检验的检测方法分析数据的统计学差异,以P<0.05 为显著性水准。其余数据仅作定性分析。
2 结果
2.1 外周免疫缺失促进CD11b+细胞进入脑膜淋巴管
在8 周龄的裸鼠和BALB/c 小鼠的脑膜淋巴管中发现,在背侧矢状窦处淋巴管中,裸鼠CD11b+细胞的数量少于BALB/c 小鼠,差异具有统计学意义[53.2(39.9~66.5)vs.29.0(22.2~35.8),n=3,t=3.598,P=0.007;图1A、B、E];但在乙状窦处的淋巴管内观察到裸鼠CD11b+细胞的数量多于BALB/c小鼠(图1C、D);其原因可能是BALB/c 小鼠脑膜淋巴管的引流功能正常,在背侧担任传递功能的细胞多,在乙状窦部,淋巴管的结构正常,细胞迁入较少,而裸鼠因为淋巴管发育异常,淋巴管结构不全,导致淋巴管引流功能降低,细胞较易穿过管壁进入淋巴管。
2.2 回输BCG诱导的T淋巴细胞有助于脑膜淋巴管发育
过继转移T 淋巴细胞14 d 后,在背侧处的硬脑膜,与未处理的裸鼠(图2B,91.56 AU)相比,回输T淋巴细胞的裸鼠脑内的淋巴管上皮细胞lyve-1 的表达量增加,促进脑膜淋巴管的结构发育完整,对脑膜淋巴管有正向促进作用(图2D,121.71 AU),与正常小鼠(图2A,255.00 AU)比较,脑膜淋巴管结构仍有欠缺,但结果好于注射PBS(图2C,87.08 AU)的小鼠。结果显示,外周免疫细胞或其所分泌的细胞因子可能对中枢内的淋巴样管道的发育起到一定的影响。在乙状窦处的硬脑膜,可得到相同的结果。(图2E,255.00 AU;F,76.73 AU;G,58.04 AU;H,89.09 AU)。定性比较,我们认为回输BCG诱导的T淋巴细胞有助于脑膜淋巴管的发育。
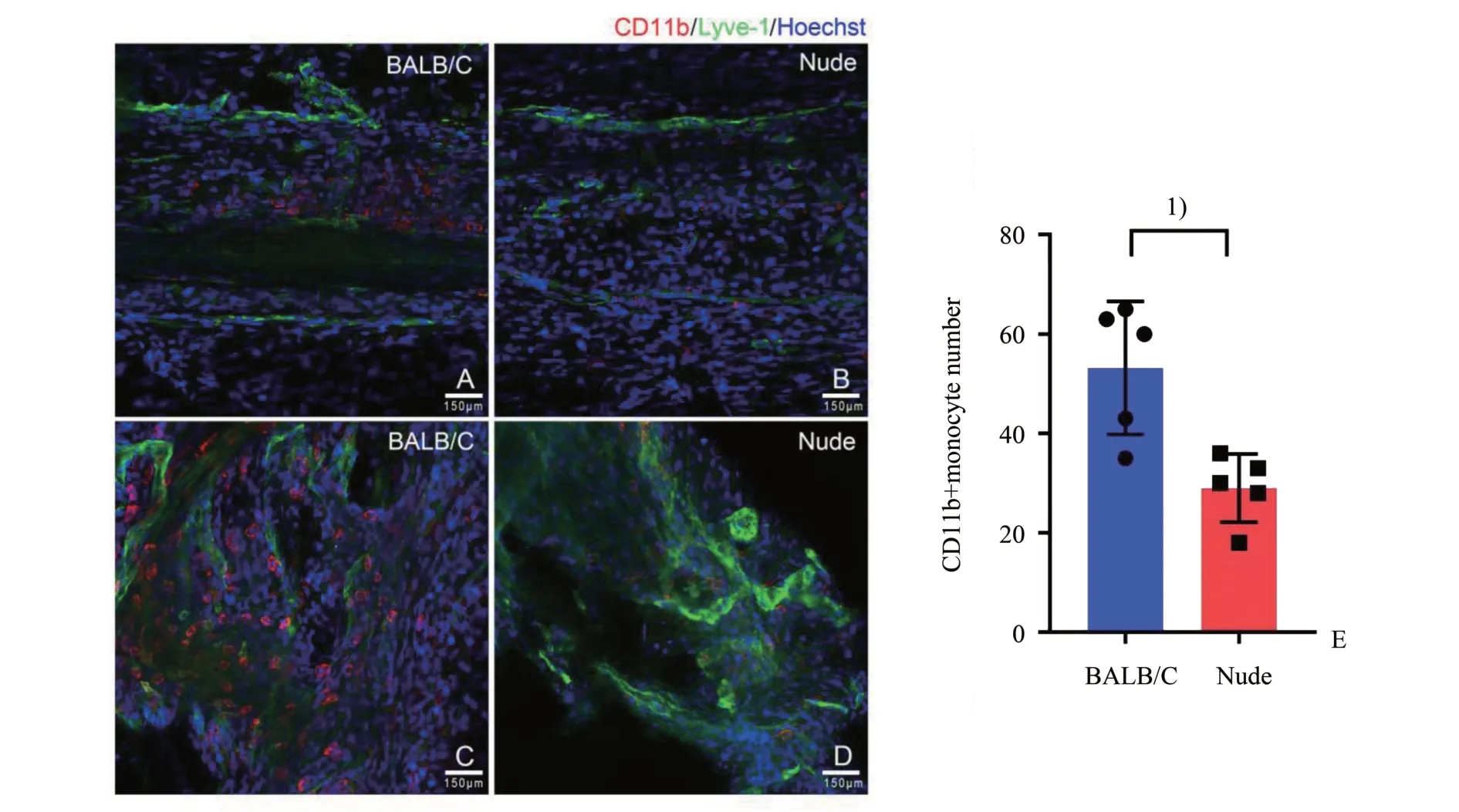
图1 裸鼠淋巴管内呈递细胞分布异常Fig.1 Abnormal distribution of CD11b+cells in meningeal lymphatic vessels in nude mice

图2 回输激活T细胞促进裸鼠脑膜淋巴管增殖Fig.2 Retransfusion activated T cells promoted proliferation of meningeal lymphatic vessels in nude mice
2.3 裸鼠颈浅淋巴结内淋巴小结增生
对裸鼠和BALB/c 小鼠的颈部浅淋巴结进行lyve-1 淋巴管特异染色发现,裸鼠的淋巴结皮质部分的淋巴管结构(图3C,ROI=14.11%)与BALB/c 小鼠(图3A,ROI=13.05%)无明显差异。在副皮质区,裸鼠淋巴结内淋巴管(图3D,ROI=16.36%)与BALB/c 小鼠(图3B,ROI=16.04%)也无明显差异,但在裸鼠了淋巴结内可以见到较多被淋巴管划分的类似淋巴结的区域。
3 讨论
在正常的脑膜淋巴管内,不同部位的脑膜淋巴管担当着不同的功能,基底部淋巴管呈纽扣状闭合,易于细胞迁入和物质交换;背侧淋巴管呈链状连续闭合,起到引流的作用[7]。包括阿尔茨海默症[4],多发性脊髓硬化症[9]在内的神经炎症与脑膜淋巴管引流功能异常相关。脑膜淋巴管的引流功能以及与引流功能相关的因素,如年龄[10]、淋巴管的位置[5]等都已被前人研究,并且对引流途径有了较为详细的论述。文献报道,正常脑膜淋巴管同脑动静脉一起发育,且与细胞因子相关[11]。我们既往研究[12]表明,向裸鼠过继卡介苗激活的T 淋巴细胞后,促进小鼠海马细胞的增殖和行为改变。发现卡介苗诱导外周免疫激活后,对硬脑膜和脑膜巨噬细胞的极化和募集增加[13]。根据我们既往研究[14]发现,注射卡介苗后,小鼠体内的抗炎细胞因子IL-10表达量会增加,尤其是脑膜内的CD11b+细胞表达量为著,同时,还发现,被卡介苗所诱导的单核细胞所衍生的巨噬细胞,其募集部位多位于脉络丛和血管周围间隙,并且脑膜内的巨噬细胞激活需要相应的T 细胞募集至脉络丛内,在卡介苗的诱导下,我们发现了T细胞在脑膜内的浸润[15]。
在此基础上,推测此次实验的裸鼠可能由于缺乏T 细胞,导致其脑膜内的巨噬细胞的激活缺乏相应的T 细胞的诱导,从而表现在横窦和乙状窦内的CD11b+细胞数量明显减少。由此信息,进一步推测外周免疫与中枢神经系统存在联系;但目前尚未有明确的研究表明中枢神经系统与外周免疫系统之间的媒介是循环系统或者是脑膜淋巴管。研究[8]报道,脑脊液是从脑膜淋巴管引流至颈部淋巴结,从而对脑脊液内的物质进行清理。因此,该区域增生的淋巴结,也可能是位于担任细胞免疫的副皮质区,且增生数量较野生型组的淋巴结多。也可能是由于胸腺的缺失导致T 细胞的发育缺失,引起数量上的增加来补偿细胞功能上的不足。本实验结果显示:外周免疫缺陷的小鼠脑内淋巴管的发育情况较正常小鼠降低,淋巴管的引流功能可能存在差异,且淋巴管的功能可能与颈部淋巴结相关联。再次激活外周免疫,可促进脑膜淋巴管的发育。本研究的发现揭示了外周免疫影响脑膜淋巴管的发育,提示外周免疫调节可能对改善中枢神经系统炎症有一定的作用。

图3 免疫缺陷导致颈部淋巴结副皮质区淋巴管增殖抑制Fig.3 Immunodeficiency leads to inhibition of lymphatic vessels proliferation in the paracortical area of cervical lymph node
近年来,随着脑膜淋巴管的发现,中枢神经系统与外周免疫的联系受到广泛的关注。外周的免疫调节参与改善大脑的功能和行为[12],在炎症状态下,筛板内的CD11b+细胞表达VEGFC,可促进VEGFR3 依赖性淋巴管的生成,该淋巴管生成在功能上增加了脑源性抗原进入引流淋巴管的通道,促进引流多余的液体。同时,淋巴管也表达CCL21,与树突状细胞的迁移有相关性[16]。也有研究表明,CCL21-CCR7 途径与淋巴系统内T 细胞的引流相关,而脑膜淋巴管内皮细胞和颈部淋巴结内皮细胞都表达CCR7 相关的配体CCL21,相关实验证实了免疫细胞在淋巴管内运输与该途径有密切联系[17]。同时,也有研究报道,外周淋巴结与外周的神经系统存在相互作用,巨噬细胞在小鼠淋巴结旁皮质和延髓内表现出与神经纤维紧密并列的位置,可与神经纤维产生双向相互作用[18],淋巴管存在神经支配。我们推测,中枢神经系统与脑膜淋巴管及其相邻的颈部淋巴结也可能存在这类相互作用。
也有研究[7]表明,随着年龄的增长,脑膜淋巴管的水肿和淋巴管内瓣膜的消失使脑脊液清除率减低,可能导致AD 的发生。我们也进行相关的实验发现,同月龄AD 小鼠的脑膜内,CD11b+的细胞数量显著低于对照组,因此,推测淋巴管内的免疫相关细胞的减少可能也是其功能减退的原因之一。诚然,这一推断仍需进一步地实验加以证实。
综上所述,本文通过对不同外周免疫情况的小鼠进行对比,证明了外周免疫缺失影响脑膜淋巴管的发育,除了观察到淋巴管特征性表达降低,还可观察到淋巴管内免疫细胞数量在背侧矢状窦的数量降低和乙状窦内存在细胞迁入的可能。本研究初次探讨了颈部淋巴结的功能异常可能影响脑膜淋巴管的功能,提示外周免疫调节可能通过改善脑膜淋巴管的结构和功能来影响中枢神经系统。
