高浓度雌二醇对刀豆蛋白A诱导小鼠急性自身免疫性肝炎的影响
2021-04-14张译文邱素苈李秋阳许成芳
张译文,汪 黎,邱素苈,李秋阳,黎 哲,许成芳
(中山大学附属第三医院妇产科,广东广州 510630)
自身免疫性肝炎(autoimmune hepatitis,AIH),是临床上一种常见的肝脏疾病,主要是自身免疫攻击引起的一种慢性进行性肝炎,表现为肝脏转氨酶升高,肝小叶结构紊乱,炎症及淋巴细胞浸润[1-2]。AIH 患者男女比例为1:8,且近年来部分临床研究认为女性妊娠期可能加重其自身免疫性肝炎的活动[3-4]。以往的研究认为,女性和男性的免疫反应不同,成年雌性比雄性表现出更强的先天性和适应性的免疫反应,这降低了女性罹患多数传染病的风险,但却增加了女性患自身免疫性疾病的风险[5]。一些临床研究显示,7%~21%的妊娠期患者和11%~86%的产后患者,高浓度的雌激素(estrogen,EE)状态可能使其自身免疫性肝炎疾病活动度加重,但也有文献报道妊娠期自身免疫性肝炎能够得到部分缓解[6-9]。多项证据和临床观察清楚的表明雌激素在自身免疫性疾病中的重要作用,但其确切的触发因素与发展的潜在机制尚未完全阐明[10]。既往研究[3-4]认为AIH 是T 淋巴细胞介导的自身免疫性疾病,雌激素已被证实可以促进辅助性T 淋巴细胞(Th2)应答,其可能通过影响细胞因子的分泌和雌激素受体的表达来调节免疫反应[4,11]。刀豆蛋白A 作为一种高效的有丝分裂原刺激物,通过小鼠尾静脉注射,可以诱导急性自身免疫性肝炎,这一模型被广泛应用[12]。近年来有研究[13]发现,体外低浓度的雌激素和刀豆蛋白A 共同处理胸腺细胞可以明显抑制胸腺细胞的增殖,缓解免疫性炎症反应;体内研究[11,14-15]也发现外源给予低浓度的雌激素可减少INF-γ、IL-2、IL-4 等炎症因子释放,缓解刀豆蛋白A 诱导的小鼠AIH。以往的研究表明,低浓度的雌激素可能通过抑制Th1/Th2 的活化,减少促炎因子释放,缓解自身免疫性肝炎,但对于妊娠这一特殊时期,高浓度的雌激素对自身免疫性肝炎的影响并不明确。目前国内外研究中,高浓度的雌激素对自身免疫性肝炎的影响鲜有报道,所以在本实验中,我们通过建立刀豆蛋白A 诱导的AIH 模型[12],探索高浓度的雌激素对AIH 的影响并揭示其中可能的分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物和饲养 SPF 级,C57BL/6,WT 雌鼠6 周龄,体质量18~22 g,购自江苏集萃药康生物科技股份有限公司[许可证号:SYXK(粤)2020-0238]。实验动物饲养于SPF 环境:温度(22±2)℃,湿度(55±5)%,12 h 光照和12 h 黑暗条件,食物和水自由获取。本研究所有动物实验操作程序获得中山大学附属第三医院疫苗所实验动物中心伦理委员会机构审批并通过。
1.1.2 主要实验试剂与仪器 AML12 小鼠正常肝细胞系由中国科学院干细胞库提供;雌二醇购自美国Sigma 公司;刀豆蛋白购自美国Sigma 公司;谷丙转氨酶测试盒,谷草转氨酶测试盒均购自上海科华生物公司;DMSO 购自美国Sigma 公司,DMEM/F12培养基,胎牛血清,0.25%胰酶和嘌呤霉素均购自美国Gibco 公司;ITS 液体培养基补充剂购自美国Sigma 公司,TNF-α,IL-6 酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒购自江莱生物;TUNEL 凋亡检测试剂盒购自武汉赛维尔生物科技股份有限公司;Cell Counting Kit-8试剂盒购自日本同仁;Annexin V-FITC/PI 双染细胞凋亡试剂盒购自凯基生物。全自动生化分析仪购自日本HITACHI 公司;DM4000B 正置生物显微镜和照相系统购自德国Leica 公司;流式细胞仪购自美国BD公司,酶标仪购自奥地利Sunrise公司。
1.2 实验方法
1.2.1 AIH 小鼠模型的建立及分组 将20 只WT雌鼠按体质量随机区组分组为:对照组(Control),刀豆蛋白A 组(ConA),雌二醇组(EE)和雌二醇+刀豆蛋白组(EE+ConA)。每组各5 只,共4 组。雌鼠卵巢去势,将雌二醇溶于5%DMSO,按20 mg/kg(参照文献及预实验结果),每天腹腔注射雌二醇,连续14 d,对照组腹腔注射等体积的5%DMSO[16-18]。最后一次腹腔注射雌二醇24 h 后,按12.5 mg/kg 剂量尾静脉注射刀豆蛋白A[12]。各组在尾静脉给药24 h 后,地氟烷吸入麻醉,眼底静脉丛取全血收集血清,处死小鼠,取肝组织经液氮速冻,置于-80 ℃冰箱保存备用。
1.2.2 AML12 细胞培养与处理 用含10 g/L 胎牛血清,1%ITS 的DMEM/F12 培 养 基 培 养AML12 细胞。置于37 ℃、含体积分数5%CO2的培养箱中培养。待细胞处于对数生长期时,0.25%胰酶消化后传代、铺板。探究在AML12 中不同浓度雌二醇对AML12 活性的影响,各处理组分别加入不同浓度的雌二醇,5、10、15 和25 µmol/L,处理24、48 h,设立溶剂组0.1%DMSO和不做处理的空白对照组。
1.3 苏木素-伊红染色
将肝脏置于40 g/L 多聚甲醛固定24 h,梯度脱水后石蜡包埋,进行连续切片(厚度4 µm)。常规苏木素-伊红(H&E)染色,中性树胶封片后于光学显微镜下观察小鼠肝脏炎性反应程度。
1.4 TUNEL凋亡染色
将石蜡切片常规脱蜡水化,用10%蛋白酶K修复组织,37 ℃恒温箱孵育20 min,PBS 漂洗;0.1%Triton破膜,常温孵育20 min,PBS漂洗;加buffer 置于室温平衡10 min;切片放于湿盒内,加入适量反应液(TDT 酶,dUTP,buffer 按1:5:50 混合),37 ℃恒温箱孵育2 h,湿盒内加少量蒸馏水保持湿度。PBS 漂洗后,DAPI 复染细胞核,避光室温孵育10 min。PBS 漂洗后,抗荧光淬灭封片剂封片。置于荧光显微镜下观察并采集图像。
1.5 血清谷丙转氨酶和谷草转氨酶测定
将采集的全血放置4 ℃,静置过夜后,于4 ℃,1 000×g离心20 min,收集血清,采用全自动生化分析仪测定谷丙转氨酶(glutamic pyruvic transaminase,ALT)和 谷 草 转 氨 酶(glutamic oxaloacetic transaminase,AST)浓度。
1.6 酶联免疫吸附试验
采用商品化酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒检测血清IL-6,TNF-α 的表达量。将血清用样品稀释液于冰上稀释5 倍,设置标准品孔,空白孔和样品孔,标准品孔加不同浓度的标准品50µL,样本孔加待测样品50µL,空白孔加样本稀释液50 µL,2 个复孔/样。向各孔中加入辣根过氧化物酶(HRP)标记的检测抗体100µL,于37 ℃恒温箱孵育60 min,洗板5次,加入显色底物100µL,37 ℃恒温箱避光孵育15 min,每孔加入终止液50µL,在450 nm 波长处测定吸光度(optical density,OD)值。根据标准品绘制标准曲线,将样品OD值代入方程,计算对应浓度。
1.7 CCK8检测雌二醇对AML12增殖能力的影响
AML12 细胞 以4 000 个/孔接种于96 孔板 中过夜,待细胞贴壁后,弃去原培养基,加入不同浓度的雌二醇5、10、15 和25µmol/L,0.1%DMSO 及完全培养基的对照组100 µL/孔,分别培养24、48 h,每孔加入10µL CCK8溶液,37 ℃恒温箱孵育2 h后于酶标仪450 nm处测量OD值。
1.8 流式细胞术检测细胞凋亡数量
AML12 细胞接种于六孔板,待细胞数量长至60%~70%融合后,加入不同浓度的雌二醇5、10、15和25µmol/L,0.1%DMSO 及完全培养基的对照组2 mL/孔,培养24 h 后进行后续处理分析。将上述各组细胞加入不含EDTA 胰酶消化后,PBS 洗涤细胞2 次(1 000×g,5 min),收集(1~5)×105个细胞,加入500µL Binding Buffer 悬浮细胞;加入5µL Annexin V-FITC 混匀后,加入5 µL PI(碘化丙啶,Propidium Iodide)混匀,室温,避光反应5~15min,然后用BD流式细胞分析仪分析凋亡情况。
1.9 统计学分析
符合正态分布的计量资料,以均数±标准差()表示,采用Graphpad Prism 8 软件进行统计学分析。血清学,TUNEL 及ELISA 结果,当数据呈正态分布且方差齐时,采用二因素二水平析因设计的方差分析,并计算交互作用。CCK8 及流式细胞术结果,当数据呈正态分布且方差齐时,采用单因素方差分析,方差分析有统计学意义时,组间两两比较用LSD-t检验。检验为双侧,P<0.05为差异有统计学意义。
2 结果
2.1 高浓度的雌二醇可加重刀豆蛋白诱导的AIH
本研究通过H&E 染色观察到:正常小鼠肝细胞正常,肝小叶结构完整清晰,肝索排列有序整齐;各模型组可见肝细胞肿胀,变性并伴有大量的炎症细胞浸润;与对照组相比,EE 组也出现少量的炎症细胞,分布于界板周围,但肝小叶结构相对完整;与ConA 组相比,EE+ConA 组病理变化更为明显,出现肝细胞坏死,并伴有大量炎症细胞浸润,分布于肝窦,界板周围,肝小叶结构不清,肝脏损伤程度加重(图1)。分别对各模型组小鼠血清中AST 与ALT含量进行2×2 析因设计的方差分析,AST 结果显示:ConA 处理的主效应差异具有统计学意义,(F=194.76,P<0.000 1);EE 处理的主效应差异具有统计学意义,(F=41.09,P<0.000 1);两种处理存在交互效应,差异具有统计学意义,(F=27.33,P<0.000 1)。ALT 结果显示:ConA 处理的主效应差异具有统计学意义,(F=122.67,P<0.000 1);EE 处理的主效应差异具有统计学意义,(F=32.02,P<0.000 1);两种处理存在交互效应,差异具有统计学意义,(F=17.10,P=0.00 1)。组间两两比较结果显示,与Control 组相比,ConA 组给药24 h 后,血清ALT 和AST 水平明显增高,差异具有统计学意义,[ALT:(36.32 ± 13.36)vs.(1 567.02 ± 526.91)U/L,P=0.000 2;AST:(45.78 ± 8.47)vs.(2 363.08± 629.94)U/L,P<0.000 1]。与Control 组相比,EE 组血清ALT 和AST 水平增高,差异具有统计学意义,[ALT:(36.32 ± 13.36)vs.(372.33 ± 87.25)U/L,P=0.000 7;AST:(45.78 ± 8.47)vs.(359.81± 139.01)U/L,P<0.000 1]。与ConA 组相比,EE+ConA 组血清ALT 和AST 水平明显增高,差异具有统计学意义,[ALT:(1 567.02 ± 526.91)vs.(3 727.34 ± 829.05) U/L,P<0.000 1;AST:(2 363.08 ± 629.94)vs.(5 452.09 ± 996.58)U/L,P<0.000 1;图2]。
2.2 高浓度的雌二醇通过促进凋亡加重刀豆蛋白A诱导的AIH
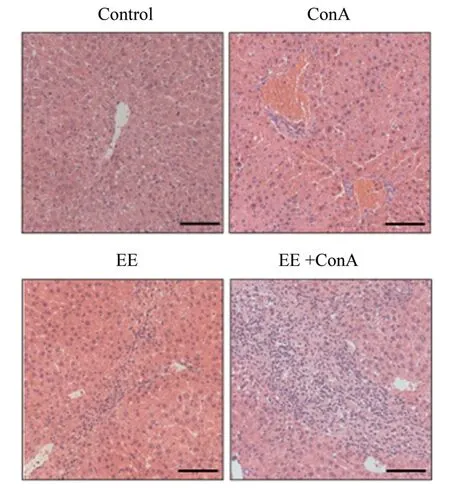
图1 各组小鼠中肝脏炎症反应程度比较Fig.1 Comparison of inflammation in liver tissues of mice among each group
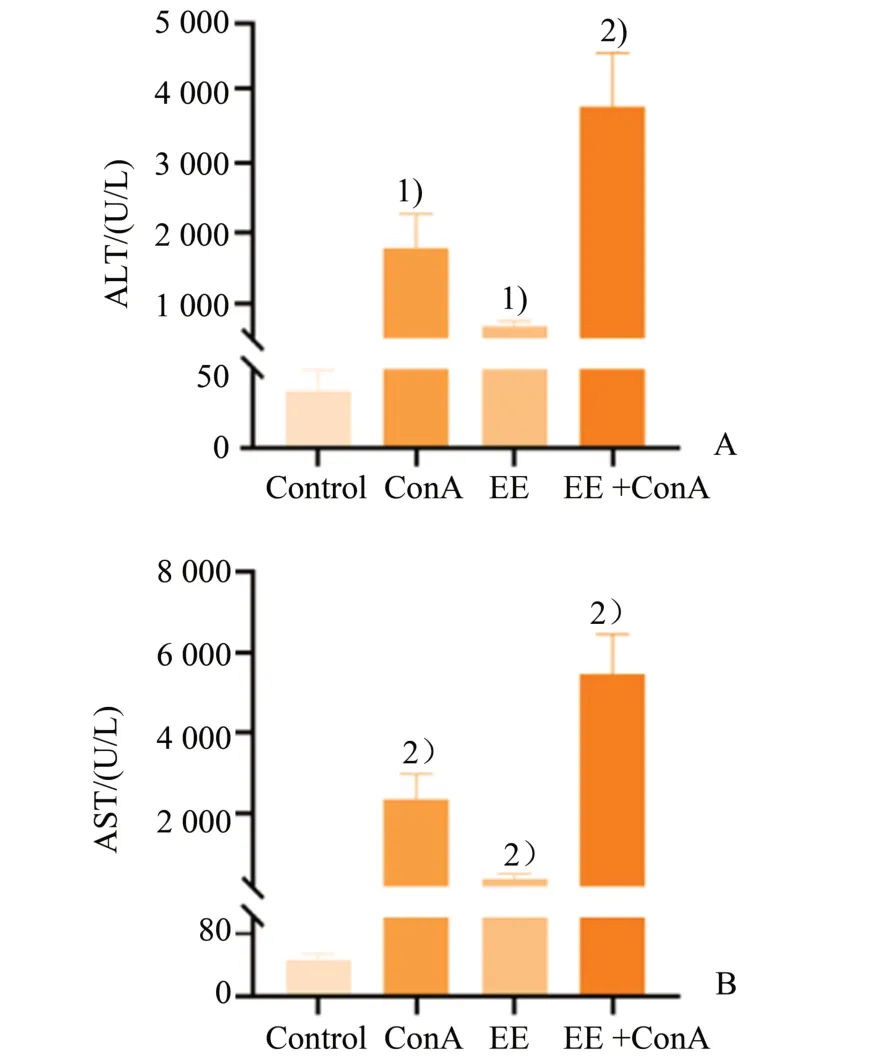
图2 各组小鼠血清转氨酶AST和ALT变化Fig.2 Serum AST and ALT of mice among each group
分别对各模型组TUNEL 阳性细胞的荧光强度进行2×2 析因设计的方差分析,结果显示:ConA 处理的主效应差异具有统计学意义,(F=608.81,P<0.000 1);EE 处理的主效应差异具有统计学意义,(F=119.02,P<0.000 1);两种处理存在交互效应,差异具有统计学意义,(F=26.24,P=0.001)。组间两两比较显示:与Control 组相比,ConA 组TUNEL阳性细胞数量明显增高,差异具有统计学意义(12.67±2.52vs.96.00±4.58,P<0.000 1);EE 组TUNEL 阳性细胞数量增高,差异具有统计学意义(12.67±2.52vs.37.77±4.93,P<0.000 1)。与ConA组相比,EE+ConA 组TUNEL 阳性细胞数量明显增高,(96.00±4.58vs.164.33±12.90,P<0.000 1;图3),差异具有统计学意义。
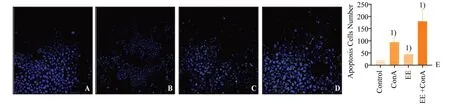
图3 各组小鼠肝细胞TUNEL阳性表达情况Fig.3 Positive expression of TUNEL in colon cells of mice in each group
2.3 高浓度的雌二醇增加血清中TNF-α和IL-6含量
通过ELISA 检测小鼠血清中炎症因子TNF-α和IL-6 的含量,分别对各模型组TNF-α 和IL-6 的表达水平,进行2×2 析因设计的方差分析,TNF-α结果显示:ConA 处理的主效应差异具有统计学意义,(F=339.54,P<0.000 1);EE 处理的主效应差异具有统计学意义,(F=40.74,P<0.000 1);两种处理存在交互效应,差异具有统计学意义,(F=6.00,P=0.037)。IL-6 结果显示:ConA 处理的主效应差异具有统计学意义,(F=33.08,P<0.000 1);EE 处理的主效应差异具有统计学意义,(F=395.641,P<0.000 1);两种处理存在交互效应,差异具有统计学意义,(F=60.86,P<0.000 1)。组间两两比较结果显示,与Control 组相比,ConA 组TNF-α 表达明显增高,[(22.16±6.27)vs.(85.92±7.12)pg/mL,P<0.000 1],差异具有统计学意义;与Control 组相比,EE 组TNF-α 表达明显增高,[(22.16±6.27)vs.(49.14±3.77)pg/mL,P=0.000 1],差异具有统计学意义。与ConA 组相比,EE+ConA组TNF-α表达明显增高,[(22.16±6.27)vs.(97.94±3.23)pg/mL,P=0.024 7],差异具有统计学意义。小鼠血清中IL-6 水平结果显示,与Control 组相比,ConA 组IL-6 水平增高,[(3.31±0.48)vs.(4.05±0.89)pg/mL,P=0.18],差异不具有统计学意义;EE组IL-6 水平增高,[(3.31±0.48)pg/mLvs.(13.34±0.52)pg/mL,P<0.000 1],差异具有统计学意义;EE+ConA 组IL-6 水平明显增高,[(3.31±0.48)vs.(8.43±0.79)pg/mL,P<0.000 1],差异具有统计学意义。与ConA 组相比,EE+ConA 组IL-6 水平明显增 高,[(22.16±6.27)vs.(97.94±3.23)pg/mL,P=0.024 7;图4],差异具有统计学意义。
2.4 高浓度雌二醇抑制AML12增殖活性
本实验采用CCK8 检测AML12 细胞的活力,分别对各模型组采用单因素的方差分析,结果显示差异具有统计学意义,(24 h:F=6.11,P=0.000 5;48 h:F=118.61,P<0.000 1)。采用LSD-t检验,进行组间两两比较结果显示,与Control 组相比,0.1%DMSO 组处理24 h 对AML12 增殖活性无明显影响,(1.03±0.17vs.1.01±0.15,P=0.783),差异不具有统计学意义。10 µmol/L EE 组处理24 h 可以明显抑制AML12 增殖活性,(1.03±0.17vs.0.85±0.06,P=0.014 6),差异具有统计学意义。与Control 组相比,0.1%DMSO组处理48 h对AML12增殖活性无明显影响,(1.02±0.09vs.1.08±0.07,P=0.074 4),差异不具有统计学意义。10 µmol/L EE 组处理48 h 可以明显抑制AML12 增殖活性,(1.02±0.09vs.0.71±0.05,P<0.000 1;图5),差异具有统计学意义。
2.5 高浓度雌二醇体外可以促进AML12细胞凋亡
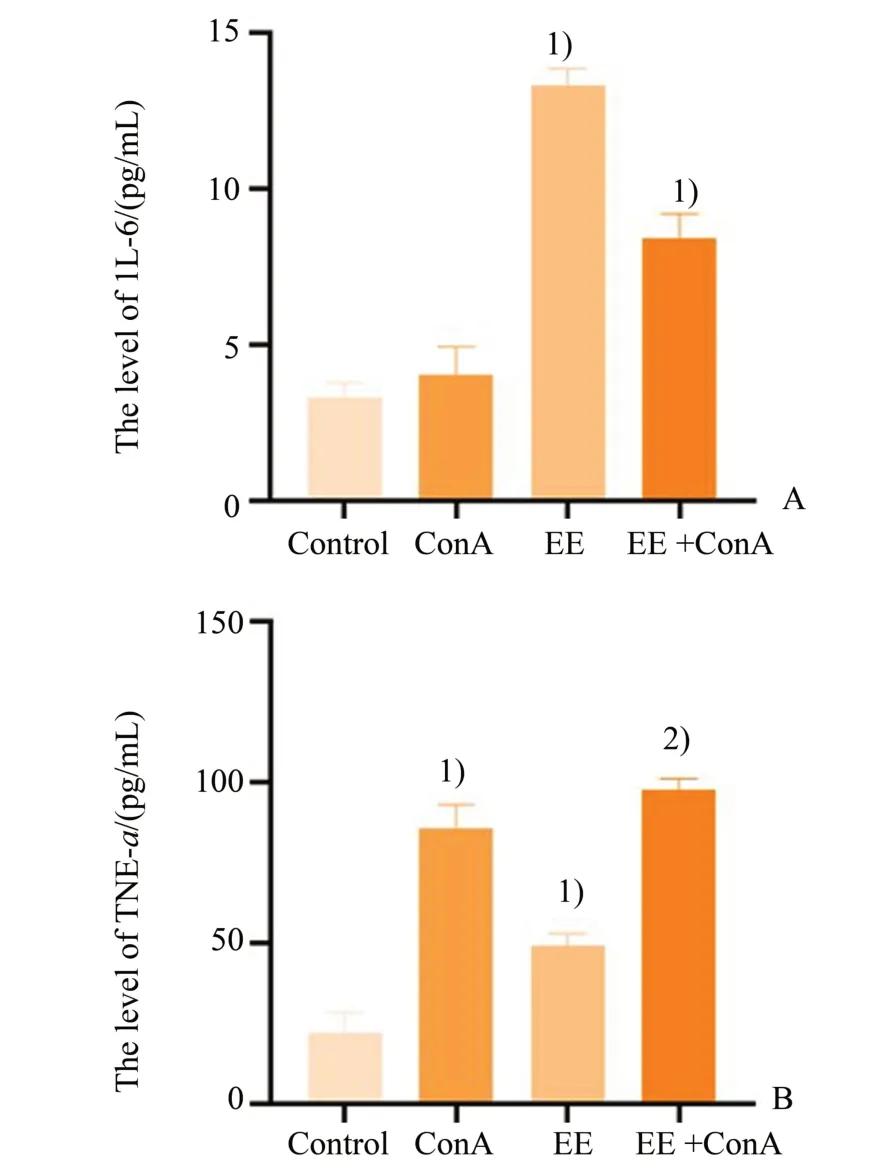
图4 高浓度的雌二醇增加血清中TNF-α和IL-6含量Fig.4 EE administration increased the levels of IL-1β and TNF-α in serum
流式细胞术是一种常见的检测细胞凋亡的方法,利用Annexin V 及PI 双染法标记凋亡细胞,可以直观地了解细胞凋亡比例。分别对各模型组采用单因素的方差分析,结果显示差异具有统计学意义,(F=4.337,P=0.017 4)。采用LSD-t检验,进行组间两两比较结果显示,与Control 组相比,10µmol/L EE 组处理24 h 可以促进AML12 的凋亡,[(6.42±0.43)%vs.(18.11±5.79)%;图6],差异具有统计学意义。
3 讨论
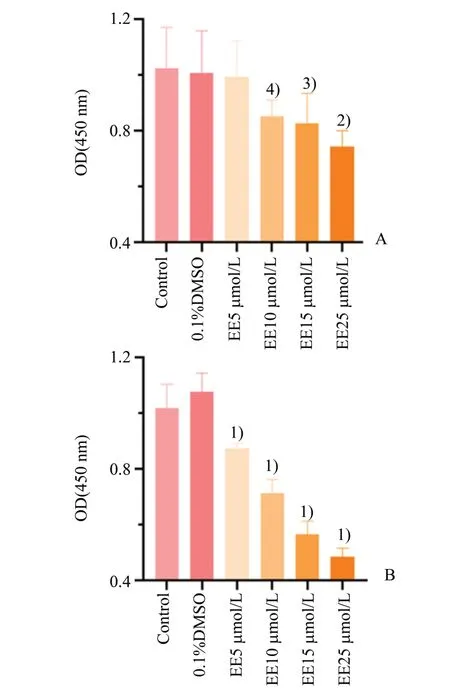
图5 CCK8检测AML12细胞活力Fig.5 Analysis of cell viability of AML12 cells by cell counting kit-8
自身免疫性肝炎的发病机制可能是,抗原呈递细胞(APC)将抗原肽提呈给未分化的辅助性T 细胞(Th0),根据免疫微环境中的不同细胞因子分化为Th1、Th2、Th17 和调节性T 细胞(Tregs)等细胞,Th1 主要分泌TNF-α、IL-2 等,Th2 主要分泌IL-6、IL-4 和IL-10 等;在TGF-β 存在时,可以促进Th0向Tregs 细胞分化,抑制免疫反应过度激活[19]。研究表明自身免疫性肝炎的发生发展是由于自身免疫耐受机制受到破坏,在正常人中,这种免疫抑制作用主要由存在于外周循环中的FOXP3+、CD4+、CD25+Tregs完成;但在自身免疫性疾病患者中这种细胞的功能和数量却存在争议,儿童期发病患者的外周循环中的Tregs 数量和功能可能均受到抑制,但成年期发病患者外周循环中Tregs却并未发现有明显缺陷,相反在未经治疗的AIH 患者的肝脏中发现了Tregs 细胞累积[20]。目前,部分自身免疫性肝炎女性患者,妊娠期复发的原因不清,多以激素和免疫抑制剂等对症治疗[21]。妊娠期高浓度的雌激素浓度可抑制Th1/Th2和Th17/Tregs之间的平衡,增加FOXP3+、CD4+、CD25+Tregs 细胞的水平,增强免疫耐受,其可能通过激活雌激素受体,如经典的细胞核受体ERα和ERβ,以及非经典的膜受体G蛋白偶联雌激素受体(GPER),影响不同细胞炎症因子,如IL-6,TNFα 等的分泌[10,22-23];也可能通过不同的雌激素代谢产物如2-羟基雌二醇和16-羟基雌二醇等影响肝脏的代谢反应[5]。刀豆蛋白A是一种植物血凝素,能有效刺激T 细胞并迅速诱导其活化和组织浸润[12]。在本实验中,我们通过建立刀豆蛋白A 诱导的AIH 模型,H&E 染色结果显示,高浓度的雌激素不但能直接诱导免疫细胞激活和炎症细胞浸润,损伤肝脏;还可以加重刀豆蛋白诱导的AIH,使肝内门管区大量淋巴细胞浸润,肝小叶内部分肝细胞肿胀,变性,坏死。ELISA 结果提示,高浓度的雌激素可以直接促进炎症因子TNF-α和IL-6的分泌,这可能与雌激素直接影响Th1/Th2的分化相关[10-11]。
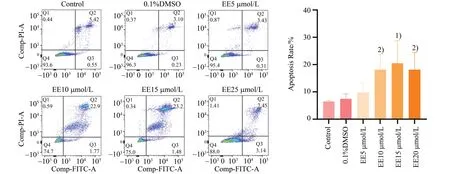
图6 流式细胞术分析内皮细胞凋亡率Fig.6 Analysis of AML12 cells′apoptosis rates with flow cytometry
以往的研究表明,低浓度的雌激素对肝细胞的活性无明显影响。高浓度的雌激素可以在诱导Hela细胞死亡,并通过激活内源性凋亡通路促进内皮细胞凋亡[10,24],因此我们推测,高浓度的雌激素可能影响肝细胞的活性。本次实验中,我们通过建立不同浓度梯度的雌激素,体外培养AML12 细胞,发现高浓度的雌激素可以直接抑制AML12 细胞的增殖活性并促进其凋亡。TUNEL 染色也进一步证明高浓度的雌激素可以诱导肝细胞凋亡。其可能的机制是,高浓度的雌激素可能通过影响Th1/Th2分化,增加炎症因子TNF-α,IL-6 等的分泌,激活凋亡通路,促进肝细胞的凋亡,加重对AIH 的损伤,这为临床上部分患者在妊娠期自身免疫性肝炎的加重,提供了可能的实验证据。
综上,本研究结果提示,高浓度的雌二醇可能通过促进炎症因子TNF-α 和IL-6 的分泌,诱导肝细胞细胞凋亡,加重AIH 小鼠肝脏炎症反应。但具体是如何激活内外源凋亡通路,是否通过ERα/ERβ 等受体调控肝细胞的凋亡,是否影响调节性Tregs 细胞,抑制免疫反应等机制,后续实验将进一步探讨。
