双氢睾酮体外培养人毛囊中差异表达的miR-133b对人毛乳头细胞的增殖及诱导能力的影响
2021-04-14邓文佳邓长健万苗坚
邓文佳,邓长健,韩 乐,刘 本,唐 鑫,万苗坚
(1.中山大学附属第三医院皮肤性病科,广东广州 510630;2.龙岗区人民医院耳鼻咽喉科,广东深圳 518172)
雄激素源性脱发(androgenetic alopecia,AGA)又称男性型脱发(male pattern baldness,MPB)是临床最常见的脱发疾病。近年来,雄激素源性脱发的发病逐渐呈现年轻化的趋势,它不但可以对患者容貌、精神心理健康产生不利影响,甚至严重干扰患者正常社交生活[1-2]。AGA 的发生发展由雄激素主导,特征表现为特定部位的毛囊的微型化,如前额及顶部头皮,受累毛囊可逐渐萎缩甚至消失,造成毛囊密度的明显降低,伴有一定的遗传倾向[3-4]。毛囊是一个由上皮及间叶组织组成的皮肤附属器,其生长具有独特的周期特性,由生长期、退行期及休止期构成[5]。上皮组织与间叶组织之间的联系对毛囊的生长发育起到至关重要的作用[6-7]。毛乳头(dermal papilla,DP)亦称真皮乳头,主要由间叶组织细胞组成,在生长期毛发中,可激活毛囊周围包绕着它的毛母质细胞以维持及启动毛囊生长周期[8]。毛囊的生长周期,受局部雄激素的影响,其中主要为双氢睾酮(5α-dihydrotestosterone,DHT),研究发现,一定浓度的DHT 可引起毛乳头细胞的凋亡,从而导致毛发周期异常[9]。过去,AGA 在基因方面的研究主要着重于编码基因。近几年,非编码基因逐渐被发现在许多细胞活动中引起关键作用。MicroRNAs(miRNAs)作为一类内源性非编码RNAs(长度通常为约22~42 核苷酸),通常通过降解mRNAs 或抑制翻译过程从而影响靶基因的表达,与细胞的增殖、凋亡、分化及生长等过程密切相关[10]。已有许多不同miRNAs 被发现在毛囊的发生发展中起到非常重要的作用。miR-133b 在心脏及骨骼肌中高度富集,是肌肉发育的关键调节因子之一[11],但近几年,越来越多的研究表明miR-133b不仅在肌肉组织中表达,其在人类肿瘤以及脑卒中样本中亦呈现异常表达[12-13]。近期研究发现,miR-133b 在雄激素刺激的激素敏感性前列腺癌细胞中表达明显上调,当miR-133b缺乏时,雄激素刺激前列腺癌细胞的能力将被抑制,提示miR-133b 为介导雄激素刺激前列腺癌细胞生存能力的关键环节[14]。另外,在骨肉瘤及肝癌细胞中,研究表面人为上调miR-133b 可以通过miR-133b/Sirt1 轴干扰Wnt/β-catenin 信号通路达到抑制肿瘤细胞增殖、迁徙能力及诱发凋亡的作用[15-16]。我们的前期研究发现Wnt/β-catenin 信号通路在DHT 调控毛囊的生长中发挥重要作用[17]。但miR-133b是否参与该过程目前尚未明确。因此,本文拟探究不同浓度双氢睾酮对毛囊生长和毛囊细胞增殖的影响及其与miR-133b 表达的关系,并进一步探究miR-133b 对毛乳头细胞的增殖和诱导能力的影响,有望今后治疗AGA提供方向。
1 材料与方法
1.1 材料
1.1.1 毛囊标本及细胞来源 人头皮样本来源于中山大学附属第三医院皮肤科和脑外科以及广州市粤秀整形医院整形手术中枕部或额顶部废弃的男性头皮。共5 例,平均年龄25.6(S=3.9)。供皮区头皮完整正常,毛发密度及生长正常,无脱发、感染等毛发相关疾病,近半年未使用激素、免疫抑制剂等其他药物,局部未使用育发或染发类产品及药物。本研究经中山大学附属第三医院医学伦理委员会批准,志愿者均需签署知情同意书。人毛乳头细胞购置于美国ScienCell公司。
1.1.2 主要试剂 双氢睾酮(Sigma,美国,溶于无水乙醇配成10-2mol/L 母液);配制的Williams E 无血清培养基(Gibco,美国,各成分终浓度:4-羟乙基哌嗪乙磺酸(Hepes)2 mmol/L、谷氨酰胺2 mmol/L、牛胰岛素10 mg/L、氢化可的松10 µg/L、亚硒酸钠10 µg/L、转铁蛋白10 mg/L、青霉素1×105µg/L、链霉素100 mg/L);DMEM 培养基(Gibco,美国);胎牛血清(Gibco,美国);兔抗人Ki-67 抗体(Sigma,美国);兔抗人Actin 抗体(Millipore,美国);兔抗人ALP 抗体(Abcam,美国);兔抗人Versican 抗体(Abcam,美国);兔抗人β-catenin 抗体(Abcam,美国);山羊抗兔荧光二抗(Abcam,英国);牛血清白蛋白(BSA)(索莱宝,北京);6-二脒基-2-苯基吲哚(DAPI)(碧云天,上海);抗荧光淬灭封片剂、4’,6-二脒基-2-苯基吲哚(DAPI;碧云天,上海);CCK-8 试剂盒(DOJINDO,日本);Trizol(Invitrogen,美国);反转录试剂盒(Takara,日本);qPCR 试剂盒(Takara,日本);Lipofectamine2000(Invitrogen,美国)。
1.2 方法
1.2.1 毛囊分离与培养 术中废弃的头皮浸泡在生理盐水中,冰上保存,4 h内分离培养。首先以生理盐水清洗头皮,去除血液,转移至青霉素(200 U/mL)链霉素(200µg/mL)双抗的D-Hanks 缓冲液中冲洗约3 min,再转移至青霉素(100 U/mL)链霉素(100µg/mL)双抗的D-Hanks 缓冲液中冲洗2 次,每次2 min。在解剖显微镜下,用10 号刀片沿毛囊生长方向将头皮纵向分为粗胚、细胚、单株毛囊,小心去除毛囊周围的真皮和脂肪组织,在表真皮交界处切断毛囊,选择结构完整的生长期Ⅵ期毛囊进行培养。全过程在冰上进行。
将配制的Williams E 无血清培养基以每孔500µL 加入24 孔培养板中。用显微镊将分离的毛囊置于培养板中,每孔1 根,将毛囊完全浸入培养基中。在倒置显微镜下观察并采集每根毛囊毛球部的形态变化图像以及测量毛囊初始长度。将培养板置于37 ℃体积分数为5%CO2的培养箱中。培养24 h 后挑选生长良好且平均长度为0.35 mm(S=0.05 mm)的毛囊进行分组培养,每组有15 根毛囊,分别加入含有浓度分别为10-8、10-7、10-6和10-5mol/L的DHT 以及不添加的DHT 的Williams E 无血清培养基中,各组培养基中无水乙醇浓度一致,每日在倒置显微镜下观察并拍摄每根毛囊毛球部的形态变化以及测量毛囊初始长度。
1.2.2 免疫荧光技术评估毛囊毛母质细胞的增殖情况 选取体外培养8天的毛囊分别用40 g/L多聚甲醇固定后进行石蜡包埋,沿毛囊纵轴方向将蜡块切成厚度约为3 µm 石蜡切片,在镜下选择毛囊结构完整的切片浸泡于二甲苯中脱蜡2 次,梯度乙醇(100%、85%、75%)水化,用蒸馏水冲洗后将切片浸泡入乙二胺四乙酸(EDTA)修复液(pH=8.0)中高压抗原修复,室温自然冷却后磷酸盐缓冲液(PBS)洗涤3 次,滴加用5% BSA 配制好的Ki-67 一抗30µL 充分覆盖毛囊组织,4 ℃湿盒内孵育过夜。PBS洗涤切片3 次,加入稀释好的荧光二抗约30µL 室温避光静置1 h,PBS 再次洗涤3 次后滴加DAPI 10µL室温避光孵育10 min,PBS清洗后封片。于荧光显微镜下观察并拍摄毛囊图像。
1.2.3 人毛乳头细胞的培养与转染 将购置的人毛乳头细胞复苏后转移到含10%FBS 的DMEN 培养基中,置于体积分数5%CO237 ℃培养箱中培养,待细胞生长至60%~70%后传代,转染前细胞汇合达到70%~90%,按3×105细胞/孔接种在6 孔板中,按照Lipofectamine 2000 说明书,将适宜浓度的miR-133b mimics 或miR-133b-NC 转染至人毛乳头细胞中,培养48 h后,收集细胞进行下一步检测。相关序列如下,miR-133b mimics:5’-UUUGGUCCCCUUCAACCAGCUA-3’;miR-133b-NC:5’-GGGAGUGAAGACACGGAGCCAGA-3’,miR-133b-NC 为无同源性的随机序列,上述序列均由上海生工生物工程公司合成。
1.2.4 CCK-8 检测人毛乳头细胞增殖能力 转染人毛乳头细胞48 h 后,将各组细胞消化下来,以3×103/孔的密度接种至96 孔板中,每组设置3 个复孔,置于体积分数5% CO237 ℃培养箱,培养24 h后,依照CCK-8 试剂盒说明书将10 µL CCK-8 检测试剂添加到每孔中,在37 ℃下孵育1~4 h,应用酶标仪450 nm波长处测量吸光度。
1.2.5 总RNA 提取-逆转录-qPCR 检测 用Trizol试剂提取总RNA,并检测其浓度及纯度,依照反转录试剂盒说明书将RNA 转录成cDNA。引物均由Invirtrogen 公司设计,以Actin 作为内参基因,相关引物序列为:Actin 上游5’-CACAGAGCCTCGCCTTTGC-3’和下游5’-GCGCGGCGATATCATCATCC-3’;miR-133b 上游 5’-GGGTTTGGTCCCCTTCAAC-3’和下游5’-CAGTGCGTGTCGTGGAGT-3’;ALP上游5’-CTTCAGGTCAAGAGGCTGGGC-3’和下游5’-AATCAGGGAGAACTGTGTCCCG-3’;Versican 上游5’-AGGTGGTCTACTTGGGGTGA-3’和下游5’-TGCAGCGATCAGGTCGTTT-3’;β-catenin 上游5’-GCGCCATTTTAAGCCTCTCG -3’和下游5’-CTGAAGCTGCTCCTCAGACC-3’;依照qPCR 试剂盒说明书,配制反应体系,反应条件设置为95 ℃30 s,95 ℃3 s,60 ℃34 s,循环40次。
1.2.6 蛋白免疫印迹检测 转染人毛乳头细胞48 h 后按常规方法提取总蛋白,用5%浓缩凝胶和12%分离凝胶进行SDS-PAGE 电泳,上样量为总蛋白20µg,浓缩的凝胶在60 V电泳60 min,分离的凝胶在120 V 电泳70 min,湿转移100 V 60 min 后以5%BSA 封闭1 h,1×TBST 洗膜后相应一抗4 ℃孵育过夜,1×TBST洗膜3次,每次10 min,二抗室温孵育1 h 后,再次以1×TBST 洗膜3 次,每次10 min,进行ECL 化学发光、X 射线胶片显影,使用Image J 软件分析蛋白质表达。
1.3 统计学方法
采用IBM SPSS Statistics 22.0 统计软件进行数据分析,计量资料以表示,两组间比较,数据符合正态分布且满足方差齐性采用t检验;多组间数据比较采用单因素方差分析,当满足方差齐性的情况下,使用Dunnett-t法进行进一步的两两比较,当不满足方差齐性的情况下采用Dunnett’sT3法进行进一步的两两比较,α=0.05,P<0.05 表明差异有统计学意义。
2 结果
2.1 毛囊生长长度
将毛囊分组培养在配制好的William’s E 培养基中或添加10-8~10-5mol/L DHT 的培养基中,每天换液并且测量毛囊延长长度。可观察到各组毛囊生长良好,表现为毛干明显伸长突出毛囊顶端,方差分析显示5 组间毛囊生长长度差异有统计学意义(F=8.279,P<0.001),采用Dunnett-t法进一步进行两两间比较,对照组与DHT 10-8、10-7和10-6mol/L实验组之间差异无统计学意义,仅DHT 10-5mol/L实验组的毛囊生长长度较对照组明显缩短(P<0.05),其中,对照组以及DHT 10-5mol/L 实验组毛囊生长长度分别为(0.464 1±0.086 9)mm、(0.345 3±0.112 1)mm。选择与对照组毛囊生长速度存在统计学差异的10-5mol/L 实验组毛囊用于后续实验(图1)。

图1 不同浓度双氢睾酮体外培养人毛囊生长长度的比较Fig.1 Comparison of the length of human HFs growth treated by different concentrations of DHT in vitro
2.2 毛囊形态改变及毛囊毛母质细胞的增殖
倒置显微镜下可以观察到,对照组在培养第8天开始进入退行期早期,表现为毛母质形态变细,毛乳头逐渐椭圆,毛干黑色素明显减少,毛囊弯曲扭折等,对比可见,DHT10-5mol/L 实验组则于第6天开始出现退行表现(图2A)。经免疫荧光染色后,Ki-67 阳性分子呈现绿色荧光(白色箭头所指为核内绿色荧光),主要于毛母质细胞的细胞核中表达。t检验显示,与对照组相比,10-5mol/L 实验组中毛母质细胞中的Ki-67阳性细胞减少(t=2.928,P<0.05;图2B、C)。

图2 不同浓度DHT体外培养人毛囊的形态变化、增殖及miR-133b表达的影响Fig.2 Effects of different concentrations of DHT on human HFs’morphology,proliferation and miR-133b expression in vitro
2.3 体外培养人毛囊中miR-133b的表达量
培养8 天的体外人毛囊,研磨后提取总RNA后进行qRT-PCR 检测,分别检测各组中miR-133b的表达。t检验显示,与对照组相比,DHT10-5mol/L 实验组毛囊中miR-133b 的相对表达量明显升高,相 当 于 对 照 组 的(0.13±0.09)倍(P<0.01;图2D)。
2.4 上调miR-133b 对人毛乳头细胞增殖及诱导能力的影响
2.4.1 上调miR-133b对人毛乳头细胞增殖能力的影响 分别用miR-133b NC及miR-133b mimics转染人毛乳头细胞,转染后将细胞消化至96 孔板中,48 h后进行CCK-8实验,检测450 nm 处吸光值。miR-133b NC 组OD 值 为1.750±0.104,miR-133b mimics 组OD 值为1.377±0.101,miR-133b mimics组吸光度值明显低于miR-133b NC 组(t=4.476,P<0.05;图3A)。
2.4.2 上调miR-133b对人毛乳头细胞诱导能力的影响 转染48 h 后,提取总RNA 进行qRT-PCR 检测,与miR-133b NC 组相比,miR-133b mimics 组毛囊中ALP、Versican、β-catenin的相对表达量均明显下降,分别相当于miR-133b NC组的0.21±0.02倍(t=17.40,P<0.001)、0.50±0.07 倍(t=9.90,P<0.01)、0.31±0.10 倍(t=8.92,P<0.01)。提取总蛋白进行western blot 检测,miR-133b NC 组 与miR-133b mimics 组相比,ALP 条带的灰度值分别为0.29±0.03、0.12±0.02,即miR-133b mimics 组的ALP 蛋白相对表达量低于miR-133b NC 组(t=8.29,P<0.01);同样,Versican 的灰度值在miR-133b NC 组与miR-133b mimics 组分别为0.37±0.02、0.13±0.02,βcatenin 灰度值0.18±0.02、0.07±0.02,提示miR-133b mimics组的Versican、β-catenin 蛋白相对表达量 低 于miR-133b NC 组(tVersican=13.16,P<0.001;tβ-catenin=6.74,P<0.01)。
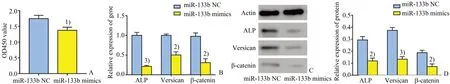
图3 miR-133b mimics对人毛乳头细胞增殖及诱导能力的影响Fig.3 Effects of miR-133b mimics on human dermal papille cells in vitro
3 讨论
在本研究中,通过体外分离培养毛囊,我们发现抑制毛囊生长及增殖的高浓度的DHT 可调控毛囊中miR-133b 的表达显著上调。通过细胞培养,我们进一步发现这种对毛囊的抑制作用可能是雄激素通过调控miR-133b的表达抑制人毛乳头细胞的增殖活性及诱导能力实现的。
体外分离的毛囊因保留了毛囊中真皮组织与上皮组织的联系,常作为探究毛发生长的理想模型。通常在体外培养时,毛囊普遍于第8~10 天开始退行,伴随其生长速度减慢[18]。Winiarska 等[9]发现,相较10-7、10-6mol/L 等浓度,10-5mol/L浓度下的DHT处理6 d时抑制毛乳头细胞增殖的作用最为显著,提示DHT 促进毛乳头细胞凋亡的能力具有一定的浓度与时间依赖性。同样,我们的研究也发现,在体外,较高浓度的DHT 如10-5mol/L 环境中培养的人毛囊,生长受到抑制的现象最显著。另外,我们的前期研究[17]表明低浓度如10-7mol/L 的DHT可对毛囊的生长产生促进作用,提示DHT 对体外毛囊生长的作用可呈现双向剂量反应,这或许与DHT 调控毛乳头细胞中的活性氧(ROS)水平的机制相关[19]。研究[20-21]表明,作为胞内的一种信号分子,低浓度的ROS 可增加细胞增殖活性,亦可通过TNF-α 激活Wnt/β-catenin 信号通路,诱导毛囊进入生长期,但高浓度的活性氧可对毛囊细胞产生毒性作用,抑制毛囊生长。
对于生长期毛囊,Ki-67 是评估其增殖活性的重要指标,仅处在增殖期的毛母质细胞才能表达Ki-67[22]。结合免疫荧光检测及qRT-PCR,10-5mol/L DHT 实验组的毛母质细胞增殖活性明显受到抑制,进一步验证了10-5mol/L DHT 对毛囊的生长并缩短生长期,在该浓度刺激下miR-133b 的表达显著上调,提示miR-133b 的表达与雄激素影响毛囊生长及毛囊细胞的增殖活性可能存在一定负性相关性。这与其在雄激素刺激的激素敏感性前列腺癌细胞中被观察到的趋势一致。
miRNAs作为一类高度保守的非编码RNAs,与细胞的增殖、凋亡、分化及生长等过程密切相关[10]。已有许多不同miRNAs 被发现在毛囊的发生发展中起到非常重要的作用,如miR-214被检测到可以通过调控Wnt/β-catenin 通路影响鼠类胚胎毛囊的发育[23];miR-205 及miR-125b 分别被发现与毛囊干细胞的增殖与分化息息相关[24-25]。miR-133b 最初一直被认为是肌肉组织高度保守的miRNA。近期的相关研究证实,在骨肉瘤及肝癌肿瘤细胞中,人为上调miR-133b 可以通过miR-133b/Sirt1 轴干扰Wnt/β-catenin 信号通路达到抑制肿瘤细胞增殖、迁徙能力及诱发凋亡的作用[15-16]。但miR-133b 在AGA 的发生发展中的作用尚不清楚。我们上调人毛乳头细胞中的miR-133b 表达后,通过CCK-8 实验发现人毛乳头细胞增殖能力的显著下降。同时,结合qRT-PCR 及western blot 实验发现人毛乳头细胞诱导能力的指标如Versican[26]、ALP[27-28]、β-catenin[29],相关基因及蛋白表达均显著下降,提示过表达miR-133b 可抑制人毛乳头细胞增殖能力及诱导能力。这与肿瘤组织中观察到的作用一致。
本研究仅初步证明AGA 的发病机制可能是由于高浓度的雄激素通过上调miR-133b的表达抑制人毛乳头细胞的增殖活性及诱导能力,但本研究仍存在许多不足之处。首先,本研究仅通过过表达miR-133b,未做低表达实验将其与雄激素共处理,因此不能完全证实miR-133b在雄激素影响毛发生长中的作用。其次,毛囊作为组织器官,其细胞成分及环境复杂,除毛乳头细胞外,miR-133b 亦可能通过其他细胞及细胞环境影响毛发生长发育,不能反映体内复杂环境下的毛囊发生发展。这有待于进一步的研究。
