晚期肝细胞癌免疫检查点抑制剂的临床研究进展
2021-04-13李代龙王雨珂庞雅琪许新华
李代龙 王雨珂 庞雅琪 许新华,2
1三峡大学第一临床医学院&宜昌市中心人民医院(湖北宜昌443003);2三峡大学肿瘤防治中心∕三峡大学肿瘤研究所(湖北宜昌443003)
据GLOBOCAN 2018年统计数据,肝癌已是全球癌症发病率第6 位,死亡率第4 位的恶性肿瘤[1]。中国作为肝癌高发地区,中国每年新发肝癌病例约占全球的59%[2]。原发性肝癌主要包括肝细胞癌(HCC)、肝内胆管癌(ICC)和HCC-ICC 混合型3 种不同病理类型,其中HCC 占90%[3]。早期肝癌手术治疗是主要的治疗手段,治愈率可达80.5%[4]。但肝癌早期常无临床症状,就诊时病情往往已进展到中晚期,晚期HCC 患者的5年生存率低于15%[5-6]。非手术治疗成为首选,自2007年第一个治疗HCC 的抗血管生成分子靶向药物,索拉非尼问世后,众多分子靶向药物不断涌现。目前索拉非尼、仑伐替尼是晚期HCC 的一线治疗方案,瑞戈非尼、卡博替尼、雷莫芦单抗等可作为晚期HCC 的二线治疗选择,分子靶向药物已成为晚期HCC 的重要治疗手段之一。但分子靶向药物在晚期HCC 中的疗效并不理想,客观缓解率(ORR)仅2%~11%,中位生存时间(mOS)仅6.5~13.6 个月[7-12]。
近年来,随着多种ICIs 在晚期HCC 的临床前研究中取得良好疗效,尤其以ICIs 为主的联合治疗在晚期HCC 中取得了可喜的疗效,迎来了晚期HCC 免疫治疗新时代。本文将对ICIs 在晚期HCC中的临床研究现状作一综述。
1 单药ICIs
免疫检查点是一类负性共刺激分子,在人体免疫系统中起保护作用,类似刹车,防止T 细胞过度激活导致炎症损伤等,主要包括CTLA4∕B7 通路和PD-1∕PD-L1 通路。而肿瘤细胞利用人体免疫系统这一特性,通过过度表达免疫检查点分子,抑制人体免疫系统反应,逃脱人体免疫监视与杀伤,从而促进肿瘤细胞的生长。ICIs 通过阻断CTLA4∕B7通路和PD-1∕PD-L1 通路,重新激活T 细胞对肿瘤细胞的免疫活性,从而发挥抗肿瘤作用[13-14]。近年来,ICIs 治疗多种恶性肿瘤的研究相继获得成功,以PD-1∕PD-L1 和CTLA-4 为代表的免疫检查点抑制剂发展最为迅猛,在晚期HCC 的临床研究中也显示出良好的治疗前景。目前在晚期HCC 中最有代表性的ICIs 大致有如下几种。
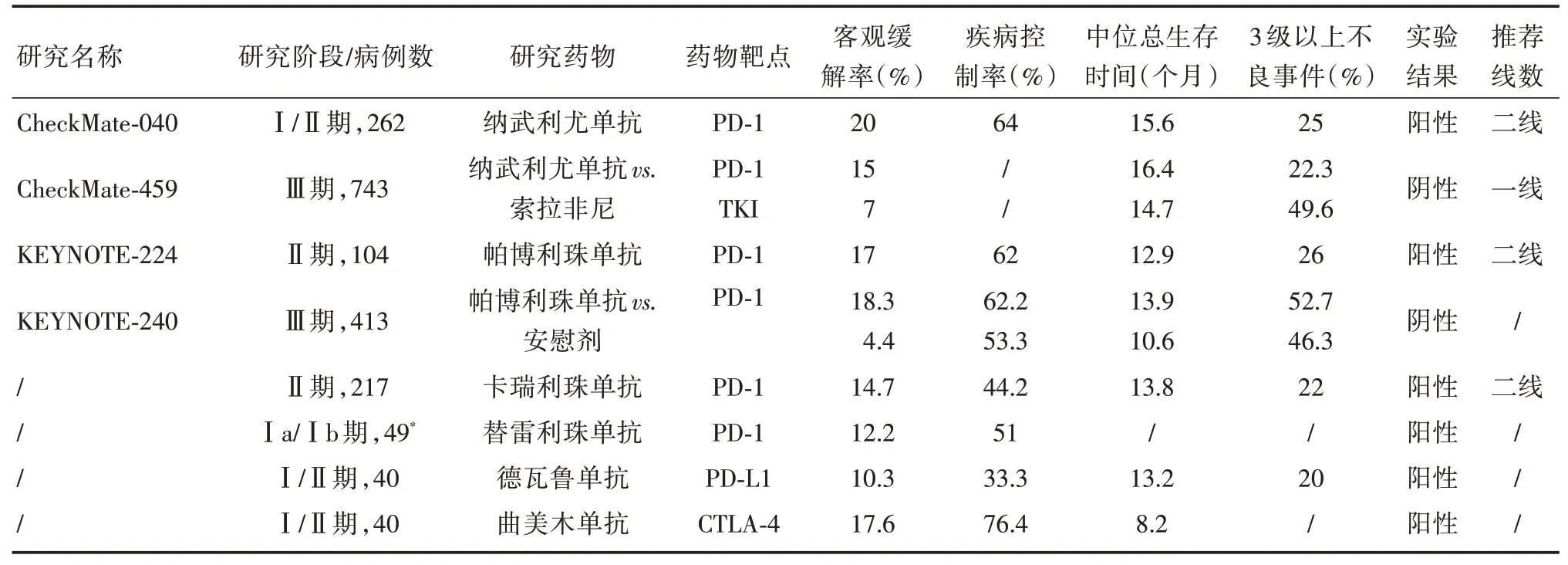
表1 单药免疫检查点抑制剂治疗晚期肝细胞癌Tab.1 Immune checkpoint inhibitor monotherapy for advanced hepatocellular carcinoma
1.1 纳武利尤单抗(Nivolumab)纳武利尤单抗是一种PD-1 单克隆抗体。CheckMate-040[15]作为最早开展的免疫单药治疗晚期HCC 的临床研究,其结果奠定了纳武利尤单抗在晚期HCC 治疗中的重要地位。Checkmate-040 是纳武利尤单抗治疗晚期HCC 的Ⅰ∕Ⅱ期、多队列临床试验,其中剂量递增组(0.1 ~10.0 mg∕kg)的客观缓解率(ORR)为15%,疾病控制率(DCR)为58%,中位生存期(mOS)为15.0 个月,3∕4 级治疗相关不良反应(TRAEs)为25%;剂量扩增组(3.0 mg∕kg)ORR、DCR、mOS 分别为20%、64%、15.6 个月。在Checkmate-040 研究中,初步显示出纳武利尤单抗对晚期HCC 的良好疗效和可控的安全性。因此,美国食品药品监督管理局(FDA)于2017年9月批准纳武利尤单抗二线治疗晚期HCC,开启了HCC 免疫治疗的新时代。为了进一步评估纳武利尤单抗在一线治疗中的疗效与安全性,开展一项全球多中心随机对照Ⅲ期临床研究CheckMate 459,共纳入743 例患者,比较纳武利尤单抗与索拉非尼一线治疗晚期HCC的疗效与安全性。初步研究结果显示,两组主要研究终点OS 为16.7 个月vs. 14.7 个月(HR= 0.85,P= 0.075 2),未达到预先设计的统计学要求[16]。在经过至少33.6 个月随访观察后,研究人员发现纳武利尤单抗组患者的肝功能较索拉非尼组保存更好;在安全性方面,3 ~4 级TRAEs 为22.3%vs.49.6%;伴有HBV 或HCV 感染的患者中,纳武利尤单抗组的mOS 明显长于索拉非尼组。随访还发现无论患者PD-L1 表达水平如何,患者均能从纳武利尤单抗中获益,尤其是在PD-L1 表达大于1%的患者中,纳武利尤单抗组的mOS 较索拉非尼组更长,为16.1 个月vs.8.6 个月[17]。CheckMate 459 作为首个一线单药ICIs 对比标准方案(索拉非尼)治疗晚期HCC 的Ⅲ期临床研究,虽然纳武利尤单抗组并没有明显延长患者的OS,这可能与研究设计有关,但长期随访发现应用纳武利尤单抗治疗患者的生活质量更好。因此,2020年NCCN 指南将纳武利尤单抗纳入晚期HCC 患者的一线治疗,也是首个肝癌一线治疗的免疫单药。
1.2 帕博利珠单抗(Pembrolizumab)帕博利珠单抗也是一种PD-1 单克隆抗体。KEYNOTE-224研究是评估帕博利珠单抗疗效及安全性的Ⅱ期临床研究,研究结果显示,帕博利珠单抗组的ORR、DCR、mOS 分别为17%、62%、12.9 个月,在安全性上,帕博利珠单抗3 ~5 级TRAEs 为26%[18],研究证明了帕博利珠单抗的抗肿瘤活性与安全性。在此基础上,另一项帕博利珠单抗对比安慰剂治疗晚期HCC 的Ⅲ期临床研究KEYNOTE-240[19]结果显示,虽然其主要研究终点(mOS 与mPFS)未达到预设的统计学阈值,但延长了患者的mOS与mPFS,且帕博利珠单抗组的ORR 和DCR 较安慰剂组有显著改善(表1)。该结果支持了帕博利珠单抗被FDA 批准用于晚期HCC 的二线治疗。
1.3 卡瑞利珠单抗(Camrelizumab)卡瑞利珠单抗是我国自主研发的PD-1 单克隆抗体,在晚期HCC 患者的Ⅱ临床研究中取得了不错的结果。在中国13 家中心,220 例患者随机予以卡瑞利珠单抗3 mg∕kg,2 周一次或3 周一次治疗,结果显示,ORR为14.7%,DCR为44.2%,6个月OS率为74.4%,mOS 为13.8 个月,3 ~4 级TRAEs 为22%[20]。基于此,卡瑞利珠单抗于2020年3月在中国成功获批二线治疗晚期HCC,成为国内肝癌获批的首个免疫药物。
1.4 替雷利珠单抗(tislelizumab)替雷利珠单抗是另一种国产人源化PD-1 单抗。已有早期临床研究报道替雷利珠单抗在晚期实体肿瘤患者中普遍具有良好的耐受性和抗肿瘤活性[21]。在一项替雷利珠单抗治疗多种晚期实体肿瘤的Ⅰa∕Ⅰb 期临床研究数据显示,在50 例晚期HCC 患者队列中,有49 例可进行疗效评估。其中6 例患者达到部分缓解(PR),19 例患者病情稳定(SD)。确证的ORR、DCR 分别为12.2%和51%;在安全性上,1 例患者出现5 级TRAEs 死亡[21]。该研究初步展示了替雷利珠单抗在晚期HCC 中的应用前景,期待之后更大型的Ⅲ期临床研究结果报道。
1.5 德瓦鲁单抗(Durvalumab)德瓦鲁单抗是一种人源化PD-L1 单克隆抗体。一项Ⅰ∕Ⅱ期临床研究结果初步表明德瓦鲁单抗在晚期HCC 中的疗效与安全性。纳入的40 例患者经索拉非尼治疗后进展,接受德瓦鲁单抗单药10 mg∕kg,2 周一次治疗,结果显示总体样本的ORR 为10.3%,DCR 为33.3%,mOS为13.2个月;在安全性上,3 ~4级TRAEs为20%[22]。相比其他单药ICIs,德瓦鲁单抗严重不良事件发生率较少,但治疗疗效还有待大型研究进一步证明。
1.6 曲美木单抗(Tremelimumab)曲美木单抗是一种CTLA-4 单克隆抗体。在一项评估曲美木单抗的抗病毒活性和治疗晚期HCC 的疗效的Ⅰ∕Ⅱ期临床研究中,纳入21 例感染HCV 的HCC 患者,结果显示部分缓解(PR)率为17.6%,DCR 为76.4%,mOS 为8.2 个月,12 个月OS 率为43%;在安全性上,未见严重免疫相关不良反应;大多数患者HCV 载量下降明显[23]。该研究证实了曲美木单抗的安全性和抗肿瘤,抗病毒活性。期待以后大型Ⅲ期临床试验进一步验证其结果。
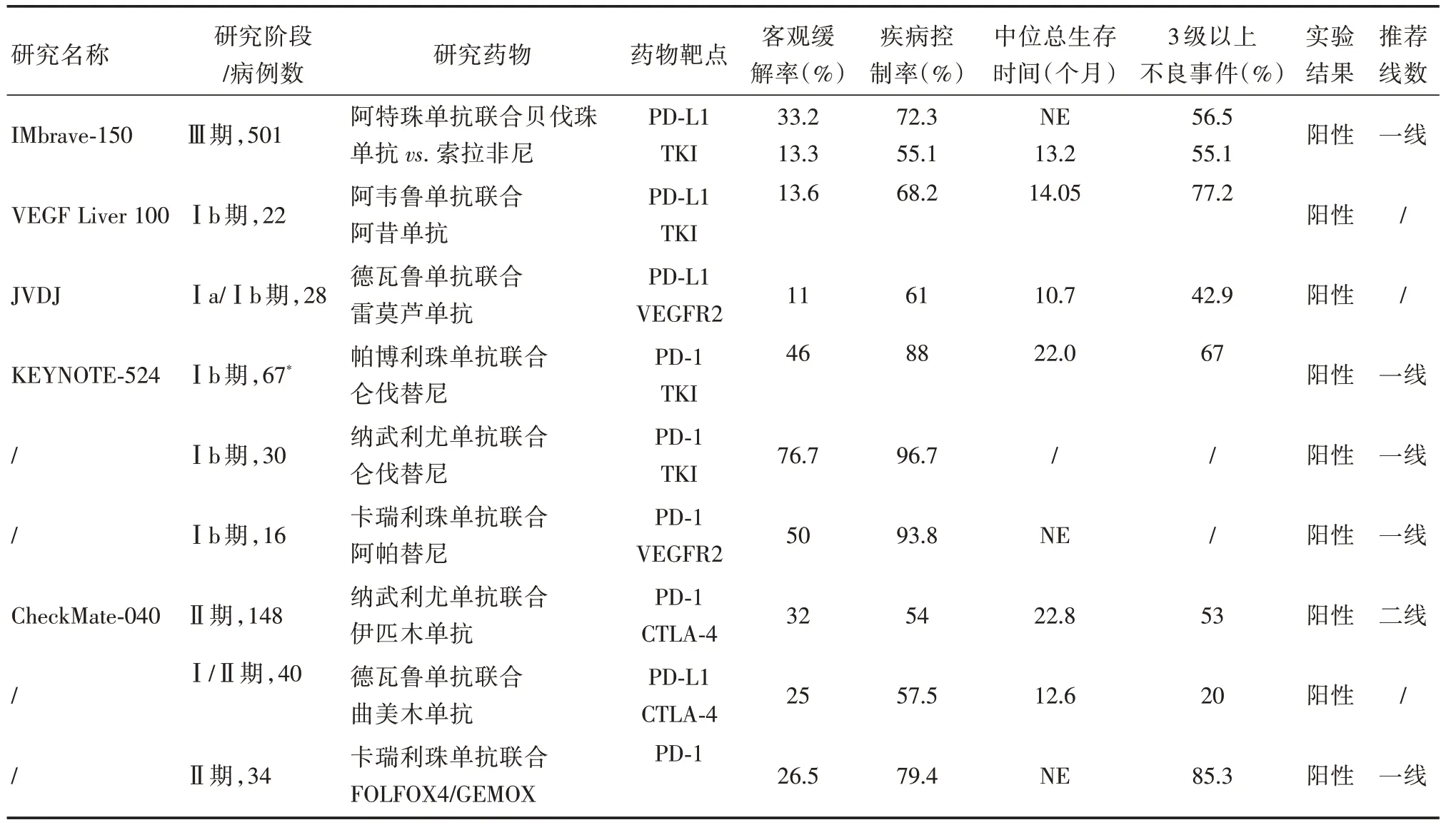
表2 免疫检查点抑制剂联合治疗晚期肝细胞癌Tab.2 Combination of immune checkpoint inhibitors in the treatment ofadvanced hepatocellular carcinoma
2 以ICIs 为主的联合治疗
单药ICIs 的有效率在20%左右,为提高PD-1∕PD-L1 单抗的疗效,免疫联合策略已在晚期HCC中火热开展。研究者们正积极寻求ICIs 联合其他药物的治疗方法,如PD-1∕PD-L1 联合分子靶向药物、双ICIs 联合(PD-1∕PD-L1 联合CTLA-4 单抗)、PD-1∕PD-L1 联合细胞毒性药物等。
2.1 PD-1/PD-L1 联合分子靶向药物肿瘤区域中肿瘤细胞和血管内膜释放的血管内皮生长因子及一系列免疫抑制细胞,共同创造了一个抑制肿瘤免疫的微环境。而抗血管生成的分子靶向药物能够抑制肿瘤血管生成,改善肿瘤局部的免疫微环境抑制状态,为ICIs 发挥疗效创造有利环境,发挥协同抗肿瘤的作用[24]。贝伐珠单抗是一种抗血管生成的靶向药物,在一项与阿特珠单抗(PD-LI单抗)联合治疗晚期HCC 的Ⅲ期临床研究(IMbrave150 试验)结果表明,阿特珠单抗联合贝伐珠单抗组的mOS 较索拉非尼组显著延长(HR=0.58,P= 0.000 6),两 组mPFS 为6.8 个月vs. 4.3 个月(HR= 0.59,P<0.000 1),联合治疗组的ORR 为33.2%,索拉非尼组仅为13.3%(按照mRECIST 标准)[25]。阿特珠单抗联合贝伐珠单抗治疗晚期HCC疗效显著,成为继十年前索拉非尼在HCC 一线治疗取得成功后的首次突破。基于此,2020年5月FDA 批准了阿特珠单抗联合贝伐珠单抗用于晚期HCC 一线治疗。
此外,阿韦鲁单抗联合阿昔替尼[26],德瓦鲁单抗联合雷莫芦单抗[27]的Ⅰb 期临床研究也初步证明了联合方案在晚期HCC 中的疗效(表2)。
另一种抗血管生成靶向药物仑伐替尼联合PD-1 单抗治疗晚期HCC 的疗效初显。这种联合方案主要包括仑伐替尼联合帕博珠单抗或纳武利尤单抗。在仑伐替尼联合帕博利珠单抗治疗晚期HCC 的1b 期临床研究(KEYNOTE-524 试验)结果显示,在公布的67 例患者中,ORR 为46%,DCR 达88%,中位OS 长达22.0 个月[28]。在2020年的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO G1)上,公布了仑伐替尼联合纳武利尤单抗的Ⅰb 期研究结果,该研究纳入了30 例晚期HCC 患者,按照mRECIST 标准,总人群的ORR 为76.7%,DCR 高达96.7%。仑伐替尼联合PD-1 单抗治疗晚期HCC 初步取得令人欣喜的结果,期待仑伐替尼联合帕博利珠单抗对比仑伐替尼+安慰剂一线治疗晚期HCC 的Ⅲ临床研究(LEAP-002,NCT03713593)结果。
阿帕替尼作为抗血管生成靶向药物,对晚期HCC 具有一定的疗效[29]。一项卡瑞利珠单抗联合阿帕替尼治疗晚期HCC 的Ⅰ期临床研究结果显示,在可评估疗效的16 例患者中,ORR 为50%,DCR 为93.8%。mOS 未达到,mPFS 为5.8 个月,安全性和耐受性良好[30]。初步证明了卡瑞利珠联合阿帕替尼在晚期HCC 中的良好疗效和可控的安全性。目前卡瑞利珠单抗联合阿帕替尼对比索拉非尼一线治疗晚期HCC 的大型Ⅲ期临床研究(NCT03764293)正在开展。
综上,PD-1∕PD-L1 单克隆抗体联合分子靶向药物是治疗晚期HCC 最有前景的研究方向,但仍需探索最佳的联合方式和剂量,并重视不良事件的管理与预防。
2.2 双ICIs 联合在双ICIs 用于HCC 的联合治疗中,抗PD-1∕PD-L1 抗体与抗CTLA-4 抗体联用是目前最常见的策略。既往研究表明,CD8+T 淋巴细胞是刺激肿瘤免疫的必要因素。在缺乏CD8+T 淋巴细胞时,无论PD-1∕PD-L1 通路是否被抑制,由于肿瘤瘤灶缺少淋巴细胞均无法激发免疫反应。然而,通过联合抗CTLA-4 抗体阻断B7-CTLA-4 通路,可以导致淋巴结中活化的CD8+T 细胞升高并向肿瘤组织浸润,从而提高抗肿瘤效应。此外,抗CTLA-4 抗体通过抑制Treg 细胞上CTLA-4 的表达能够增强CD8+T 细胞的免疫活化[31]。这是目前开展抗PD-1∕PD-L1 抗体联合抗CTLA-4 抗体临床试验的理论基础。纳武利尤单抗为PD-1 单抗,伊匹木单抗为CTLA-4 抑制剂,两者的联合应用在HCC 的治疗中取得了佳绩。Ⅱ期临床研究(CheckMate-040)队列4 将入组患者分为三组:A 组(纳武利尤单抗1 mg∕kg+伊匹木单抗3 mg∕kg,3 周∕次)、B 组(纳武利尤单抗3 mg∕kg+伊匹木单抗1 mg∕kg,3 周∕次)、C 组(纳武利尤单抗3 mg∕kg,2 周∕次+伊匹木单抗1 mg∕kg,6 周∕次)。研究结果表明,A∕B∕C 三组ORR 相似,分别为32%∕30.6%∕30.6%,其中A 组的mOS 最长,达22.8 个月,B 组、C 组的mOS分别为12.5、12.7个月[32]。基于此,2020年3月FDA正式批准纳武利尤单抗(1 mg∕kg)+伊匹木单抗(3 mg∕kg)二线治疗晚期HCC,成为首个且唯一获批的双免疫治疗方案。虽然这种双ICIs 联合治疗显示出更高的客观缓解率,但不良事件的发生率和严重程度较单药治疗明显升高,53%患者出现3 级以上治疗相关不良事件[32],因此,其疗效和安全性还需要大型研究进一步证实。
在CheckMate-040 的另一个队列研究中,研究者将71 例HCC 患者分为两组:纳武利尤单抗+伊匹木单抗+卡博替尼组(三联组)和纳武利尤单抗+卡博替尼组。研究结果显示三联组的ORR为26%,DCR 为83%,mPFS 为6.8 个月,mOS 未达到;纳武利尤单抗+卡博替尼组的ORR 为17%,DCR 为81%,mPFS 为5.5 个月,mOS 未达到,该研究结果提示三联组疗效更好。但三联组3 ~4级TRAEs 发生率明显高于纳武利尤单抗+卡博替尼组,为71%vs.42%[33]。
此外,一项PD-L1 单抗德瓦鲁单抗联合CTLA-4 抑制剂曲美木单抗治疗40 例晚期HCC 的Ⅰ期临床研究结果显示,ORR 为25%,DCR 为57.5%,3 ~5 级TRAEs 为20%[34]。期 待Ⅲ期临床研究(NCT03298451)的结果进一步证实其疗效与安全性。
2.3 ICIs 联合化疗系统化疗可以抑制和杀伤肿瘤细胞,暴露抗原,有利于ICIs 发挥疗效。以奥沙利铂为主的系统化疗FOLFOX4 方案是晚期HCC的一线治疗方案之一。卡瑞利珠单抗联合FOLFOX4 或GEMOX 方案一线治疗晚期HCC 的Ⅱ临床研究结果显示,34 例可评估的患者ORR 为26.5%,DCR 为79.4%,mPFS 为5.5 个月,mOS 未达到。在安全性上,虽有85.3%的患者发生3 ~4 级治疗相关不良事件,但只有5.9%的患者发生3 ~5 级免疫相关不良事件(irAEs)[35]。研究结果表明卡瑞利珠单抗联合FOLFOX4 或GEMOX 方案一线治疗晚期HCC 的疗效及安全性良好,可为晚期HCC 患者提供一种新的一线治疗方案。
3 总结与展望
随着多种ICIs 在晚期HCC 中的临床研究取得良好疗效,ICIs 给晚期HCC 患者带来了新的希望,但后续以纳武利尤单抗为代表的Ⅲ期临床研究发现ICIs 单药治疗晚期HCC 与标准治疗方案(索拉非尼)相比并没有压倒性的优势。与此同时以ICIs 为主的联合治疗在晚期HCC 的临床试验中取得了前所未有的疗效,特别是阿特珠单抗联合贝伐珠单抗治疗晚期HCC 首次破冰十年来的一线治疗格局,成为首个获批的肝癌免疫联合疗法,标志着晚期HCC 一线治疗正式进入免疫时代。因此以ICIs 为主的联合治疗是未来晚期HCC 领域的重点研究方向,但最佳治疗组合的选择、治疗相关毒性的预测和管理、以及实用的生物标志物的开发仍然是目前面临的重要挑战。未来应进一步深入了解免疫治疗的分子生物学机制,根据患者的特异性免疫特征及基因情况选择个体化精准免疫治疗方案,最大程度地降低毒性,提高疗效。
