蜡样芽孢杆菌调控NF-κB信号通路以抑制口腔鳞狀細胞癌细胞增殖、迁移及侵袭
2021-04-13周倩饶凤琴霍花齐晓岚廖健洪伟
周倩 饶凤琴 霍花 齐晓岚 廖健 洪伟
1贵州医科大学口腔医学院∕附属口腔医院(贵阳550001);2贵州医科大学地方病与少数民族疾病教育部重点实验室(贵阳550004)
在每年新增的口腔颌面部肿瘤病例中,有近85%为口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)。作为口腔颌面部中最常见的恶性肿瘤,根据2018年的一项统计数据显示,全球范围内口腔恶性肿瘤新增35.5 万例,死亡人数17.7 万例[1]。因此,深入研究OSCC 的治疗方法迫在眉睫。
人体微生物群落数量庞大,能通过其自身的代谢活动以及对宿主的免疫调节从而参与人体的生理功能[2]。多项研究表明,细菌在癌症治疗中有着巨大潜力,可通过提高机体对肿瘤的免疫应答,从而抑制肿瘤的进程[3-5]。有研究表明,分别向原位脑肿瘤的大鼠、自发性实体瘤的犬以及晚期平滑肌肉瘤的患者注射诺维氏梭状芽孢杆菌可以有效杀伤癌细胞,并且诱发炎症反应进一步遏制肿瘤的生长[6]。在接受诺维氏梭状芽孢杆菌治疗的患者中,有42%的患者肿瘤尺寸明显缩小[7]。NAKATSUJI 等[8]研究表明,分离自健康人类皮肤的表皮葡萄球菌可产生6-HAP 以抑制黑色素瘤的生长。RUBIO 等[9]研究证实,芽孢杆菌的毒素能作用于CDH11 细胞膜受体,从而抑制乳腺癌细胞的活性。此外,芽孢杆菌的代谢产物还能对结肠癌细胞及急性淋巴白血病T 淋巴细胞产生细胞毒性[10]。当芽孢杆菌被巨噬细胞吞噬后,芽孢杆菌产生的蛋白酶InhA1 能剪切NprA 帮助芽孢杆菌从宿主巨噬细胞中逃逸,避免了免疫细胞攻击[11]。微生物的感染常能引起炎症的产生[12]。有研究表明,芽孢杆菌感染小鼠后,NF-κB 上游的TLR 受体能够识别感染并启动炎症反应,显著上调CXCL1、CXCL2 及CXCL10 等炎症相关基因的表达[13]。芽孢杆菌抑制OSCC 发展的作用机制目前尚未明确。因此,本次实验采用最常见的蜡样芽孢杆菌,旨在研究其对OSCC 增殖、迁移及侵袭能力的改变,并探索可能的机制,以期更深入的了解OSCC 与微生物间的关系。
1 材料与方法
1.1 主要试剂、细胞株及菌株人OSCC 细胞SCC-25(四川大学华西口腔医学院提供),蜡样芽孢杆菌ZQ-2(贵州医科大学分子生物学重点实验室提供),胎牛血清(Gibco,USA),DMEM 培养基(Sigma,USA),青链霉素混合液(Gibco,USA),兔抗人P65、pP65、IκBα、pIκBα、IKKγ、GAPDH 单克隆抗体(Abcam,USA),羊抗兔二抗(Absin,CHN),BHI培养基(Solarbio,CHN),CCK-8 试剂盒(Dojindo,CHN),ECL 显影液(Absin,CHN),BAY 11-7082 抑制剂(Beyotime,CHN)。
1.2 细胞培养SCC-25 细胞培养于含10%胎牛血清,100 U∕mL 青霉素和100 μg∕mL 链霉素的DMEM培养基中,37 ℃,5% CO2孵育。细胞融合85% ~90%时,0.25%胰酶消化,传代备用。细胞计数仪计算SCC-25 细胞培养于6 孔板上,密度达到85%~90%时的细胞数量。
1.3 细菌培养蜡样芽孢杆菌ZQ-23 接种于5 mL BHI 培养基,37 ℃培养18~24 h。稀释涂布平板法计算细菌数量。菌液离心后弃上清,细菌重悬于无血清无双抗DMEM 细胞培养基中,调整细菌浓度为1×109CFU∕mL 备用。
1.4 构建细菌感染细胞模型细胞接种于6 孔板培养24 h。根据感染复数(multiplicity of infection,MOI),即蜡样芽胞杆菌数与SCC-25 细胞数的比值,将MOI 分别为1、50、100 及200 时相应细菌数的蜡样芽孢杆菌,加入6 孔板与细胞共培养3 h后,更换含双抗及血清的DMEM 培养基继续培养0、3、6、9、12、24 h,收集细胞。以上培养条件均为37 ℃,5%CO2。实验分组为:对照组(SCC-25细胞)、对照+BAY 11-7082 组(SCC-25 细胞+NF-κB 抑制剂)、共培养组(蜡样芽孢杆菌+SCC-25 细胞共培养)、共培养+BAY 11-7082组(蜡样芽孢杆菌+SCC-25 细胞共培养+NF-κB 抑制剂)。
1.5 CCK-8 检测将细胞2.2×103个接种于96 孔板,每孔加培养液100 μL。待细胞贴壁,加入蜡样芽孢杆菌共培养。每孔加入10 μL CCK-8检测液,孵育2 h,酶标仪在波长450 mm 处检测吸光值(OD450)。
1.6 划痕实验将细胞接种于6孔板,无血清DMEM培养24 h。每孔使用丝裂霉素0.02 mg∕mL 处理2 h后,加入蜡样芽胞杆菌培养3 h,用200 μL 枪头垂直于孔板制造细胞划痕,加入含双抗的无血清培养基,于0、24、48、72 h 拍照,计算各时间段细胞迁移率。迁移率=(TX面积-T0面积)∕T0面积。
1.7 Transwell实验将基质胶与DMEM培养基按1∶8 比例混合加入Transwell 上室,37 ℃凝固2 h。收集感染后的细胞清洗消化重悬,调整细胞数为1×105个∕mL,取100 μL 细胞悬液加入Transwell 上室,下室加入500 μL 培养基放入37 ℃培育24 h,多聚甲醛固定,结晶紫染色后在倒置显微镜下随机选取5 个视野计算细胞数。
1.8 Western blot将收集到的细胞加入含蛋白酶抑制剂的RIPA 裂解液,冰上裂解40 min,4 ℃12 000 r∕min 离心15 min,取上清,获得总 蛋 白。BCA蛋白浓度检测试剂盒测定总蛋白浓度。从收集的上清液中提取蛋白质经过高温煮沸变性,电泳,转膜,5%脱脂牛奶室温封闭1 h,一抗(GAPDH、P65、pP65、pIκBα、IκBα、IKKγ)4 ℃孵育过夜,羊抗兔二抗室温孵育1 h,ECL 显影。
1.9 统计学方法应用GraphPad Prism 统计学软件对数据进行统计分析计量数据采用表示为均数±标准差。两组间的比较使用t检验,多组间的比较使用单因素方差分析检验或Kruskal-Wallis 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 蜡样芽孢杆菌抑制细胞增殖选择MOI 为1、50、100、200 及300 感染细胞后培养24 h,与对照组相比较,MOI 为300 时细胞活性受到抑制(P<0.001)。检测各时间点蜡样芽孢杆菌对SCC-25细胞增殖变化,结果显示感染后培养48 h 后,共培养组细胞活性明显低于对照组,差异有统计学意义(P<0.05,图1)。
2.2 蜡样芽孢杆菌抑制细胞迁移及侵袭采用划痕实验于感染后0、24、48、72 h 观察SCC-25 细胞迁移状态。随着时间变化,受感染的SCC-25 细胞迁移率明显低于同一时间段对照组,差异有统计学意义(P<0.05)。Transwell 侵袭实验结果表明,共培养组细胞侵袭数低于对照组,差异有统计学意义(P<0.05,图2)。
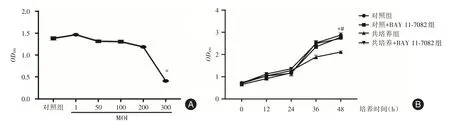
图1 蜡样芽孢杆菌对SCC-25 细胞活性及增殖能力的影响Fig.1 Effect of Bacillus on the activityand proliferation of SCC-25
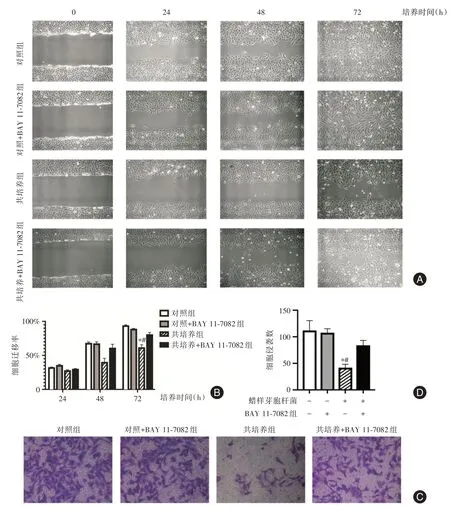
图2 蜡样芽孢杆菌对SCC-25 细胞迁移及侵袭能力的影响Fig.2 The effect of Bacillus on migration andinvasion of SCC-25
2.3 蜡样芽孢杆菌调控NF-κB 通路相关蛋白的表达Western blot 结果表明,蜡样芽孢杆菌激活SCC-25 细胞NF-κB 信号通路。当感染后培养时间为12 h 时,随MOI 升高,P65 及IκBα磷酸化水平上升,IKKγ被活化,差异有统计学意义(P<0.05)。当MOI = 50,pP65 表达量在感染后培养0 h 达到最大,pIκBα及IKKγ9h 则在9 h 时最高。此外,蜡样芽孢杆菌感染的SCC-25 细胞经NF-κB 抑制剂BAY 11-7082 处理后,pP65、pIκBα、IKKγ表达受到抑制,NF-κB 通路激活受阻(图3)。
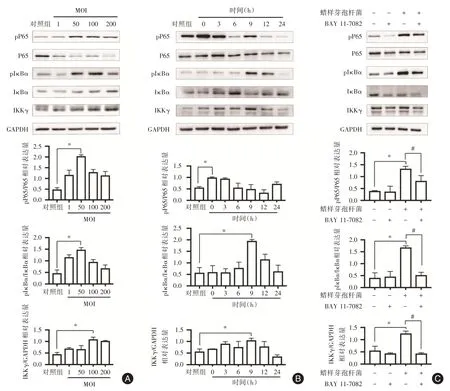
图3 蜡样芽胞杆菌对SCC-25 细胞NF-κB 信号通路的影响Fig.3 Effect of Bacillus on NF-κB signaling pathway of SCC-25
2.4 抑制NF-κB 信号通路后蜡样芽孢杆菌促SCC-25 细胞增殖、迁移及侵袭能力增强CCK-8实验结果显示,共培养组细胞活性明显低于共培养组+BAY 11-7082,差异有统计学意义(P<0.05,图1)。划痕实验及Transwell 结果表明,经NF-κB抑制剂BAY 11-7082 处理后,受感染的SCC-25 细胞迁移率及侵袭数升高,差异有统计学意义(P<0.05,图2)。
3 讨论
目前,在癌症治疗中,利用微生物自身特性及其代谢产物开发新的抗癌手段已成为趋势。ANTIC等[14]认为来自创伤弧菌的MARTX 蛋白可以通过剪切Ras 蛋白使其失活,从而抑制肿瘤细胞生长。大肠杆菌-CP1 能够直接作用于前列腺癌病变组织,发挥抑癌特性[15]。芽孢杆菌的毒素制剂还可高效靶向杀灭膀胱癌细胞[16]。本研究选择SCC-25细胞作为研究对象,首次观察了蜡样芽孢杆菌对SCC-25 细胞增殖、迁移及侵袭能力的影响,探讨蜡样芽孢杆菌对炎症相关NF-κB 通路表达水平的改变情况,以及蜡样芽孢杆菌调控NF-κB 通路以抑制SCC-25 细胞增殖、迁移及侵袭的机制。
本研究发现,OSCC 细胞SCC-25 感染蜡样芽孢杆菌后,炎症相关NF-κB 信号通路中P65 及IκBα发生磷酸化,意味着NF-κB 信号通路活化;加入抑制剂BAY 11-7082 后,以上蛋白磷酸化受到抑制。此外,还检测到了蜡样芽孢杆菌对SCC-25 细胞IKKγ表达的影响。有研究发现IKKγ能调节IKK复合体的形成以及信号传导,促进NF-κB 的活化,从而影响喉鳞癌细胞功能[17]。有学者认为,细胞对蜡样芽孢杆菌的炎症反应,可能是由于来自蜡样芽孢杆菌分泌的溶血性肠毒素和非溶血性肠毒素结合细胞膜受体,在细胞表面形成裂孔,引起K+外流,激活NF-κB下游的NLRP3炎症小体[18-19]。笔者推测蜡样芽孢杆菌对SCC25 细胞NF-κB 通路的调控可能也与这两种肠毒素的分泌有关。
NF-κB 是炎症中至关重要的转录因子,在肿瘤的增殖、迁移及侵袭等进展中起着关键作用[20]。本研究证明,蜡样芽孢杆菌抑制OSCC 细胞SCC-25增殖、迁移及侵袭。加入抑制剂发现,增殖、迁移及侵袭能力明显增高。这说明,蜡样芽孢杆菌抑制SCC-25 细胞增殖、迁移及侵袭的机制是通过调控NF-κB 信号达到的。
综上所述,本研究首次报道了蜡样芽孢杆菌通过调控NF-κB 信号通路以抑制OSCC 细胞的增殖、迁移及侵袭能力,意味着应用蜡样芽孢杆菌可能发展成为一种新的OSCC 治疗手段,为肿瘤治疗提供新的思路。然而,本研究仍缺乏体内实验以探究蜡样芽孢杆菌抑制OSCC 的功能,后续本课题组也将进行更深层次的探索。
