胃癌中幽门螺杆菌vacA基因型的分布及其与NF-κB表达的关系
2021-04-13薄威王旭光李佳琦梁伊灵李磊勾佳钰张忠
薄威 王旭光 李佳琦 梁伊灵 李磊 勾佳钰 张忠
沈阳医学院病理学教研室(沈阳110034)
胃癌是一种很常见的恶性肿瘤,并且是全世界恶性肿瘤死亡的最常见原因之一[1]。这是由于胃癌常常在晚期才被诊断出来。而对于中晚期胃癌的治疗,临床医生只能对症治疗而不能将其完全治愈[2]。如果胃癌在早期就被发现,患者的生存质量将大大提高,所以对于胃癌早期的生物学标志物筛查尤为重要。幽门螺杆菌(Helicobacter pylori,H.pylori)的感染是胃癌的危险因素[3]。但是在H.pylori感染的人群中,感染者发生非萎缩性胃炎较为普遍,仅有少数感染者会发生胃癌。这种状况的出现与宿主特性、环境因素及H.pylori毒力因子密切相关[4]。近年来,对于H.pylori毒力因子的研究越发深入,空泡毒素(vacuolating cytotoxin,VacA)逐渐进入到人们的视野,编码空泡毒素的基因序列上存在多态性位点,不同基因亚型的组合与胃癌的关系不同[5]。目前,H.pylori vacA基因亚型在辽宁胃癌患者中的分布尚不十分明确,其与胃癌发生的机制尚需研究。核因子(NF-κB)是一种功能性蛋白质,广泛存在于真核细胞的胞浆。研究发现,作为一种核转录因子,NF-κB 在很多疾病的病理过程中发挥着重要作用,NF-κB 的上调可促进基因转录活性而导致肿瘤的发生[6]。因此,本研究主要阐明胃癌患者术后组织中检测H.pylori vacA基因亚型与NF-κB 的表达的关系。
1 材料与方法
1.1 样本来源选取2010年7月至2014年7月本院普外科胃癌患者手术切除的H.pylori阳性石蜡包埋胃癌组织样本140例。其中男108例,女32例,年龄28~87 岁,年龄中位数为60 岁,本研究已获得沈阳医学院伦理委员会批准。
1.2 DNA提取蜡块每例连续切15 ~20片,每片厚度为4 μm,置于1.5 mL 离心管中,按试剂盒(购于北京天根公司,DP331-02)说明书操作提取DNA。
1.3 PCR 检测H.pyloris 序列和m 序列的特异引物,通过巢式PCR 对vacA s1、s2、m1和m2进行扩增,引物均由上海生工公司设计。按照既往文献设计特异性引物序列,确定反应条件[7]。电泳后分析结果。
1.4 NF-κB 蛋白表达检测采用ElivisionTMplus法检测NF-κB 的表达情况。兔抗人NF-κB 多抗购(ab16636)购买于美国abcam 公司。NF-κB 抗体(1∶400)稀释,4 ℃过夜,具体实验步骤参照试剂盒说明书。
1.5 免疫组化评分标准阳性结果判定,细胞中棕褐色或棕黄色颗粒,着色强度高于背景非特异性染色[8]。显微镜下观察10 个高倍视野,对100 个肿瘤细胞计数,对阳性细胞数进行计数和评分,将阳性细胞计数评分及染色强度评分相乘得分,0 ~1 分为阴性、2 ~3 分为弱阳性、4 ~6 分为中度阳性、7 ~12 分为强阳性。
1.6 观察指标观察胃癌组织中vacA的不同亚型以及NF-κB 的表达情况。
1.7 统计学方法采用SPSS 16.0 进行统计分析,计数资料用例(%)表示,采用χ2检验。采用Logistic回归分析对影响因素进行统计分析。P<0.05 差异有统计学意义。
2 结果
2.1 患者临床资料本研究选取140 例H.pylori阳性胃癌患者组织一般资料见表1。
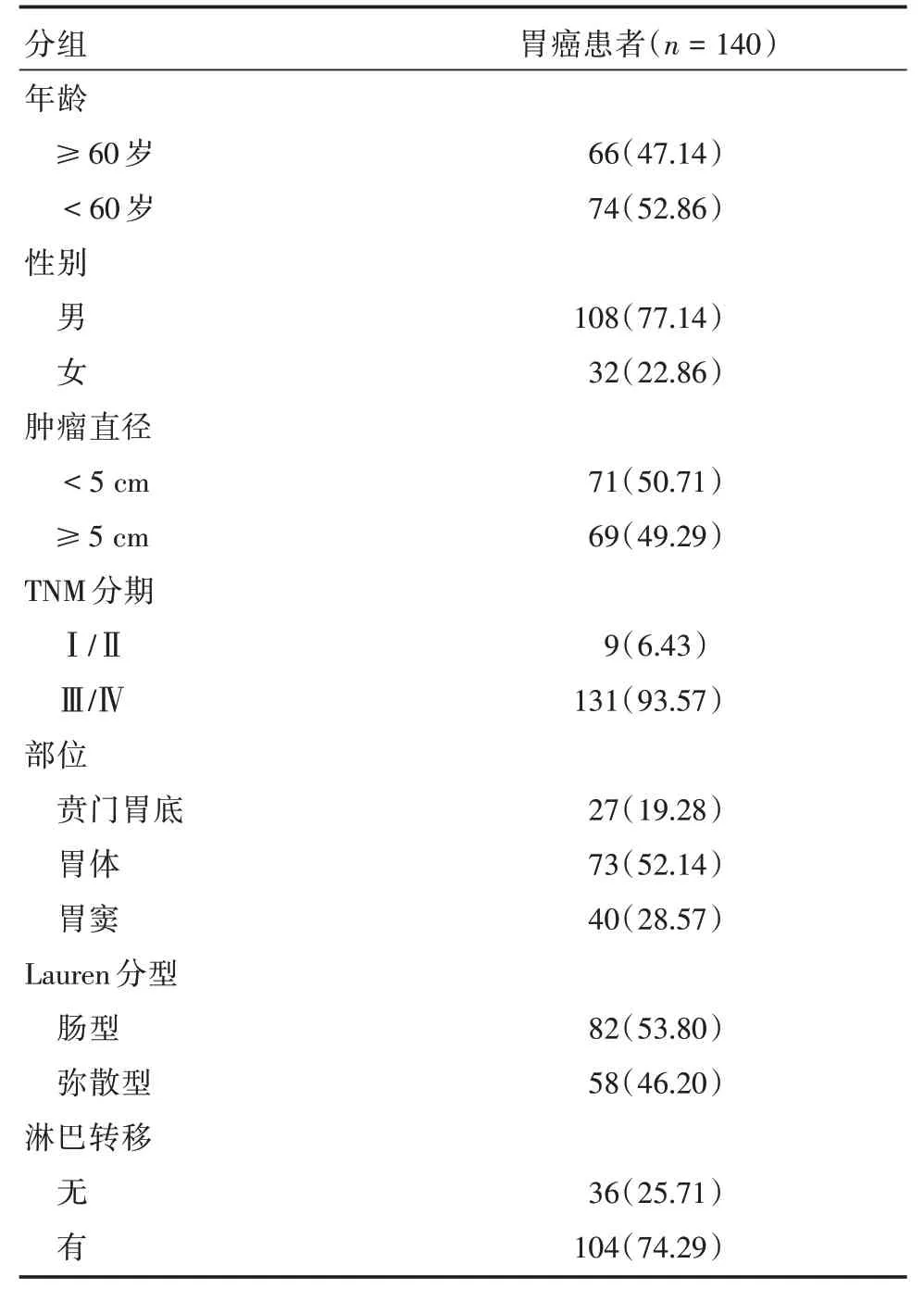
表1 胃癌患者一般资料Tab.1 Clinical data of patients with gastric cancer 例(%)
2.2 不同H.pylori vacA基因亚型在胃癌中的分布s1产物片段141 bp,s2产物片段153 bp;m1产物片段102 bp;m2产物片段102 bp。在胃癌组织中分析s和m亚型的表达情况,vacAs1亚型(88∕140,62.90%)高于vacAs组其他亚型(P<0.05);vacAm1亚型(52∕140,37.14%)在胃癌中的分布高于vacAm组其他亚型(P<0.05);联合分析s与m亚型的表达,vacAs1m1亚型(35∕140,25.00%)在胃癌中比率均高于其他亚型(P<0.05)。见表2。
2.3 H.pylori vacA优势基因型与胃癌Lauren 分型观察H.pylori vacA不同基因亚型与临床病理特征的关系,vacA不同基因亚型只与Lauren 分型有关。vacAs1在肠型胃癌和弥散型胃癌中的检出率都为50%,在两型胃癌比较中差异无统计学意义(P>0.05)。vacAm1在弥散型胃癌中检出率为61.45%高于在肠型胃癌中的检出率38.46%;vacAs1m1基因型在弥散性胃癌检出率为74.28%高于肠型胃癌中的检出率25.71%,差异均有显著统计学意义(P<0.001),见表3。
2.4 NF-κB 表达与胃癌患者临床病理特性结果显示,NF-κB 的表达与年龄、肿瘤直径、TNM 分期、部位和Lauren 分型均无关,差异无统计学意义(P>0.05);但其表达与性别和淋巴转移情况密切相关,其中男性患者NF-κB 表达明显高于女性患者。在有淋巴结转移的患者中NF-κB 的表达明显高于无淋巴结转移的患者(P<0.01)。见图1、表4。
2.5 H.pylorivacA优势基因型与NF-κB 表达H.pylori vacAs1、vacAm1、vacAs1m1亚型会明显影响NF-κB表达(P<0.05),并且当此三种基因型为阳性时,NF-κB 阳性表达率均明显升高。其余vacA基因亚型则未有明显影响(P>0.05)。见表5。

表2 不同H.pylori vacA 基因亚型在胃癌中的分布Tab.2 Distribution of different H.pylori vacA gene subtypes in gastric cancer 例(%)
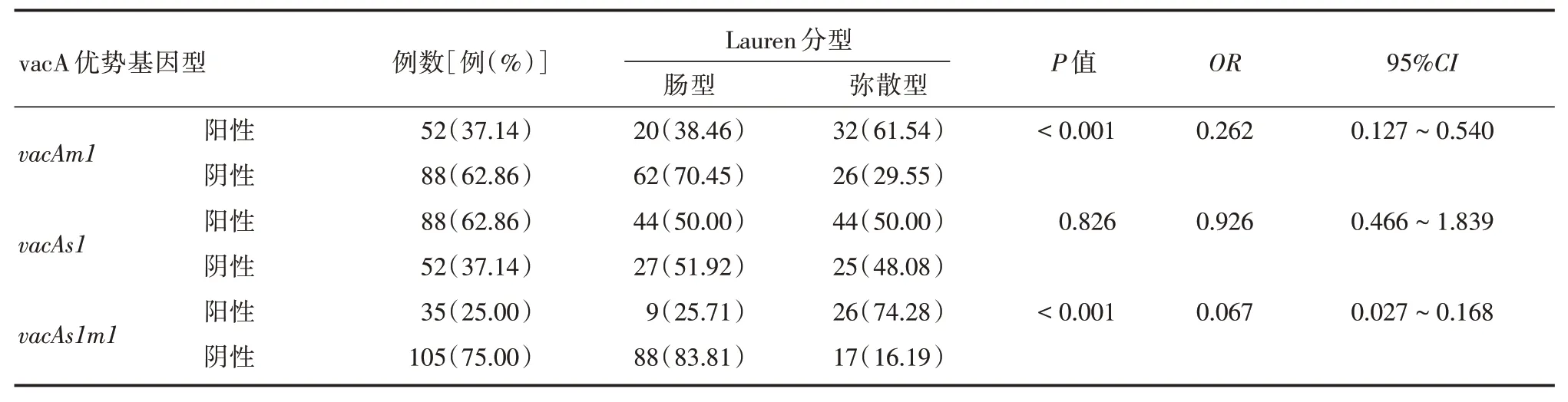
表3 H.pylori vacA 优势基因型与胃癌Lauren 分型之间的关系Tab.3 The relationship between the dominant genotype of H.pylori vacA and the Lauren classification of gastric cancer
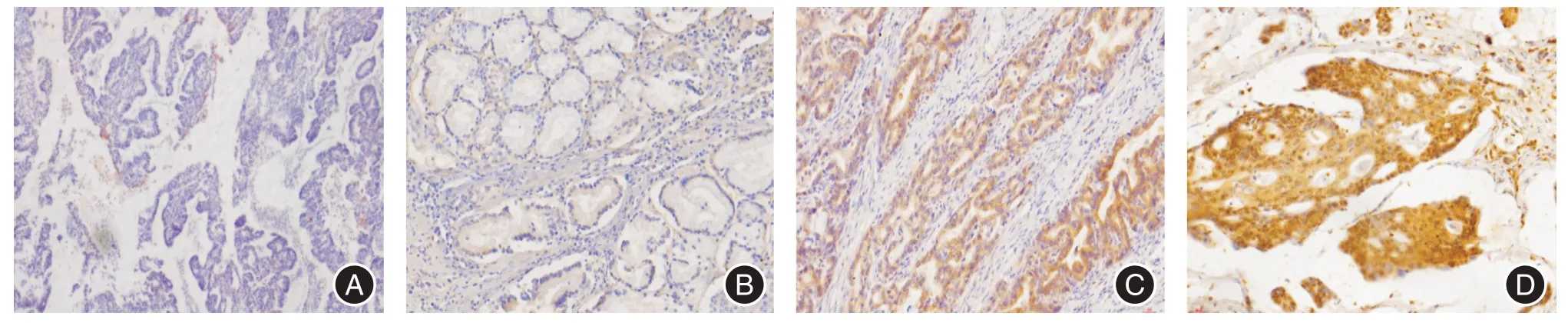
图1 NF-κB 表达Fig.1 Expression of NF-κ B(400×)
3 讨论
在全球恶行肿瘤发病率中胃癌位于前5位并是第三大癌症死亡原因。在胃癌晚期患者中,其5年生存率仅约10%,2015年中国癌症数据统计,我国每年新增胃癌人数高达40万,病死率位列癌症相关病死率第2 位[7]。我国胃癌的发病率和病死率均高于世界的其他国家,对人民的生命健康和生存质量造成了巨大威胁。流行病学研究显示3∕4的人类胃癌患者是由H.pylori引起的[8]。H.pylori在全球发病率超过50%,尤其在各条件相对较低地区,发病率更高,其被WHO 癌症研究机构归为Ⅰ类致癌原。研究已证明H.pylori分泌VacA 蛋白致使细胞空泡化改变,损耗线粒体跨膜电位,释放细胞色素C,激活促凋亡因子Bcl-2 等相关蛋白,从而引起一系列炎性反应导致细胞凋亡的发生。H.pylori感染后,可提高mir-135b-5p 的水平抑制细胞凋亡、诱导顺铂耐药,还可激活NF-κB 信号通路参与胃癌发生[9]。在辽宁省恶性肿瘤主要死因之一便是胃癌[10]。
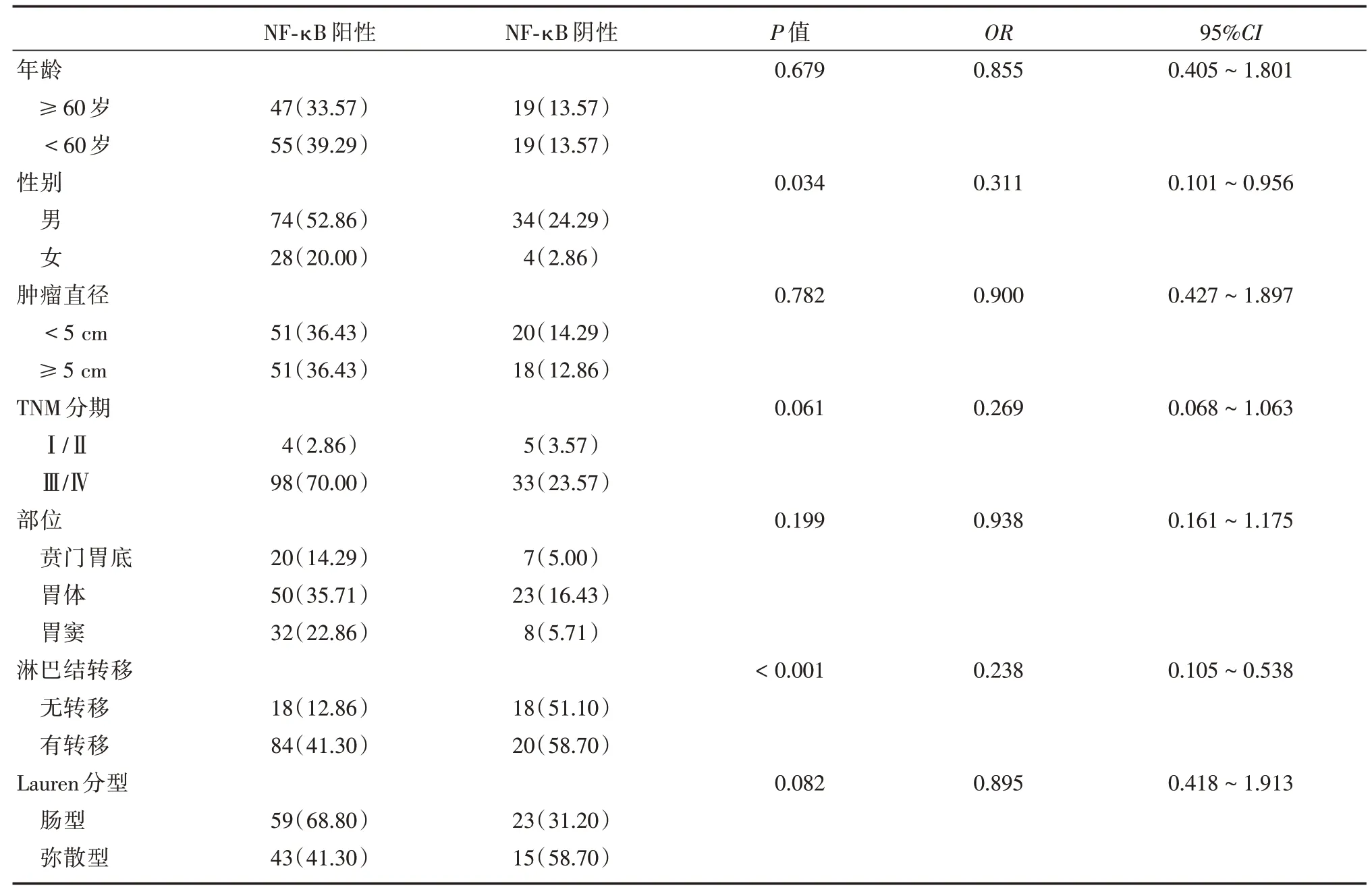
表4 NF-κB 表达与胃癌患者临床病理特性的关系Tab.4 Relationship between NF-κB expression and clinicopathological characteristics of gastric cancer patients 例(%)
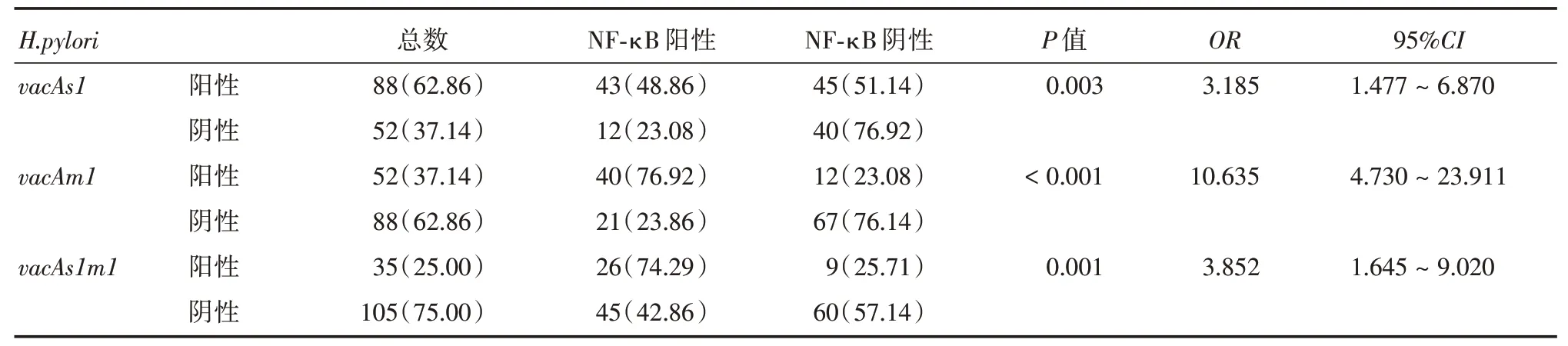
表5 H.pylori vacA 优势基因型与NF-κB 表达的关系Tab.5 The relationship between the dominant genotypes of H.pylori vacA and the expression of NF-κB例(%)
笔者的前期研究发现,vacAs1m2与萎缩性胃炎和肠上皮化生的发生密切相关[11]。笔者在前期研究基础上想进一步分析在辽宁地区胃癌患者中vacA基因的亚型分布,以及检测有H.pylori感染的胃癌组织中NF-κB 的表达情况,在组织学层面分析分析vacA基因亚型与NF-κB 之间的关系。在对收集的胃癌组织样本进行vacA基因亚型分析后发现,vacA(s1、m1和s1m1)三种基因亚型在胃癌中的分布高于其他亚型。结果还显示vacAm1和vacAs1m1基因型在弥散型胃癌中比例高于肠型胃癌,差异有显著统计学意义。这表明,携带vacAm1和vacAs1m1基因型的胃癌患者,临床预后差。NF-κB为参与疾病进展的重要信号转导因子[12],H.pylori致胃癌机制中可能存在NF-κB 信号通路受到miR-338 靶向抑制C-C 基序趋化因子配体21 调控[13]。
既往研究已证实H.pylori感染造成胃黏膜致炎状态后,可通过多种信号转导途径激活NF-κB的表达,这说明NF-κB 的高表达与胃癌的发生是密切相关的[14]。本研究通过对临床病理资料的分析后显示,NF-κB 的表达在胃癌中与性别和淋巴转移情况密切相关。在此基础上,本研究进一步分析vacA不同基因型对核因子NF-κB表达的影响,结果显示仅vacA三个优势基因型(s1、m1与s1m1)与NF-κB 的表达呈正相关。目前,vacA与NF-κB 的直接作用机制研究尚无报道,需要进一步探索。大量体内外试验证实H.pylori感染可诱导尾型同源框转录因子2 的表达。学者在人类胃癌细胞AGS 的研究中发现,在H.pylori感染的条件下,尾型同源框转录因子2 表达通过激活NF-κB 信号通路促进胃癌癌前病变的发生[15];另外SAMADANI等在胃癌细胞系(AGS、NUGC-4、KATOIII)的研究中显示,毒素相关蛋白(CagA)阳性(含有致病岛)H.pylori菌株能引起CDX2 蛋白水平和mRNA 水平增高[16]。YOON 等[17]选用两种26695 有致病岛的H.pylori菌株和TX30 无致病岛的菌株感染AGS 细胞,并于24 h 后加入骨形态发生蛋白2,研究显示在26695 有致病岛菌株中骨形态发生蛋白2、骨形态发生蛋白2下游蛋白SMAD4和p-SMAD1∕5∕8 均增高,同时NF-kB 水平也出现了相应的改变。同样在动物实验中显示H.pylori通过骨形态发生蛋白途径调节NF-κB(上调)、SOX2(下调)的水平,进而影响胃癌的进展,但是多局限于cagA 基因亚型上。
综上,vacA(m1、s1和s1m1)三种基因亚型在辽宁地区是胃癌发生的优势基因型,携带vacAs1m1基因亚型的患者可能是弥散型胃癌的高发人群,促进NF-κB 的表达应是导致胃癌恶化的可能路径之一。对于vacA基因亚型的深入研究对于胃癌的早期诊断有重要的意义,同时,本研究为胃癌的发生机制及因型施治提供实验室依据。但是,本文也有一定的局限性,仅在患者组织中检测了NF-κB的表达情况,下一步需要在体外用分子实验来进行进一步验证。
