家蝇Actin-5C基因启动子的生物信息学分析及载体构建*
2021-04-13王蓝晨王昱王颖杨仕赛朱贵明
王蓝晨,王昱,王颖,杨仕赛,朱贵明
(贵州医科大学 生物与工程学院 实验中心,贵州 贵阳 550025)
家蝇(MuscadomesticaL.)属于完全变态昆虫,是世界大部分地区最常见的一种昆虫[1]。家蝇具有生育能力强、生命周期短、易于高密度培养等特点,且育种技术简单,饲料来源丰富,已被列为世界上新的蛋白质资源昆虫[2-4]。因此将家蝇作为一种新型的转基因生物反应器进行研究,具有广阔的发展前景。昆虫转基因技术是利用功能基因开发新昆虫品种的关键,也是实现昆虫有用蛋白质合成和生物反应器开发的关键技术[5-6]。外源基因能否成功表达,启动子的选择显得尤其重要[7]。目前,对家蝇的转基因研究相对不成熟,技术体系的建立尚不完善,仍缺乏能够实现外源基因高效表达的理想启动子。在果蝇和家蚕中,肌动蛋白(Actin)是一种具有收缩特性的高度保守的组成型蛋白[8],肌动蛋白除存在于肌肉细胞中,还是细胞骨架的重要组成部分、参与细胞迁移、染色体分离及细胞内大分子转运等[9]。肌动蛋白5C(Actin-5C)属细胞质肌动蛋白,通常认为将它祝为表达外源目的基因的启动子比较合适[10-11]。本研究使用多种预测工具预测Actin-5C启动子区,并克隆预测调控区域,重组到含萤火虫荧光素酶的报告基因pGL3-Basic载体上,为进行下一步的实验研究筛选出启动子活性最强的家蝇Actin-5C启动子的调控区域。
1 材料与方法
1.1 材料
1.1.1家蝇及细胞来源 供试虫源家蝇由贵州医科大学生物与工程学院昆虫房饲养,温度25~28 ℃,湿度70%,光照周期12 L ∶12 D。供试细胞sf9(草地贪夜蛾)为贵州医科大学生物与工程学院实验室保存。家蝇幼虫经麦麸饲养,家蝇成虫以白糖和奶粉以1 ∶1比例混合进行饲养,饮用水为无菌蒸馏水。
1.1.2主要试剂 荧火虫荧光素酶报告基因载体pGL3-Basic和pGL3-Promoter购于美国Promega公司,Q5®超保真2× 预混液、限制性内切酶及T4 DNA连接酶购自美国NEB公司,DNA Marker、纯化回收试剂盒及2×TaqPCR MasterMix Ⅱ购自天根生化科技(北京)有限公司,氯化钠、酵母粉及胰蛋白胨购自英国Oxoid公司,琼脂糖购自中国biosharp公司,DNA抽提试剂盒购自德国QIAGEN。胎牛血清(fetal bovine serum,FBS)购自德国PAA公司,Grace′s昆虫培养基和细胞转染试剂购自美国Thermo ScientificTM公司。Primer 5.0设计引物(表1)、引物合成及基因测序均由生工生物工程(上海)股份有限公司完成。

表1 PCR实验中使用的引物Tab.1 Primers used in PCR experiments
1.1.3主要仪器 Applied Biosystems PCR仪购自美国Thermo ScientificTM公司,DYY-BC型电泳仪购自北京市六一仪器厂,Milli-Q超纯水仪购自德国Millipore Pharmacia,超净工作台购自苏州安泰空气技术公司。
1.2 方法
1.2.1启动子分析 在美国国家生物信息中心(national center for biotechnology information,NCBI)数据库中检索家蝇肌动蛋白Actin-5C基因gDNA序列,使用生物信息学预测工具分析得到启动子区,其中启动子转录起始位点预测使用的是Promoter 2.0(http://www.cbs.dtu.dk/services/Promoter/),启动子预测分析使用伯克利果蝇基因组计划(berkeley drosophila genome project,BDGP)在线分析软件,以及Softberry 启动子预测分析工具包(包括TSSG、TSSP和FPROM),转录元件的预测使用的是Cister(https://zlab.bu.edu/~mfrith/cister.shtml)。
1.2.2荧光素酶载体构建 Primer 5.0软件进行引物设计,DNASTAR软件行酶谱分析,在上游和下游引物5′端分别引入XhoⅠ和KpnⅠ限制性内切酶酶切位点和保护碱基(表1)。提取家蝇成虫DNA并以此为模板,采用超保真聚合酶扩增相应的目的片段。PCR条件为98 ℃变性10 s,64 ℃退火30 s,72 ℃ 延伸50 s,共35个循环,最后4 ℃保存。扩增产物经1%的琼脂糖凝胶电泳,回收PCR产物。XhoⅠ和KpnⅠ内切酶双酶切PCR产物及载体pGL3-Basic纯化回收后进行连接反应,得到的质粒分别命名为pGL3-1156、pGL3-1745及pGL3-2059三种质粒,重组质粒经XhoⅠ和KpnⅠ双酶切及测序进行鉴。
1.2.3瞬时转染细胞及荧光素酶基因的表达 取sf9细胞以1×105个/孔密度接种于6孔板中,细胞90%融合时,加无血清无双抗Grace′s培养基100 μL/孔,再加空载体pGL3-Basic和pGL3-Promoter各4 μg作为对照组,pGL3-1156、pGL3-1745及pGL3-2059各4 μg为实验组,转染时加内参载体phRL-TK400 ng和Lipofectamine2000 10 μL,补充无血清无双抗的培养基250 μL,置28 ℃ 孵箱培养。6 h后弃培养液,换完全培养基。24 h后提取细胞总RNA,反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测萤火虫荧光素酶基因的表达情况,上游引物Fluc-F为5′ TGCCTCATAGAACTGCCTGCGTG 3′,下游引物Fluc-R为5′ TATCATCCCCCTCGGGTGTAATCAG 3′。PCR扩增时64 ℃退火,延伸40 s,循环30次,产物长度为420 bp;并以βactin作为内参照,上游引物βactin-F为5′ GATGACCCAGATCATGTTTGAGACC 3′,下游引物βactin-R为5′ TGTCACGCACGATTTCCCTCTC 3′,PCR扩增时62 ℃退火,延伸10 s,循环30次,产物大小约为250 bp。结束后取反应液5 μL进行浓度为1%的琼脂糖凝胶电泳,凝胶成像系统检测PCR产物。
2 结果
2.1 家蝇Actin-5C基因定位及启动子分析
在线软件NCBI对Actin-5C(NW_004766441)基因结构进行分析,结果显示Actin-5C基因在GenBank数据库中位于Scaffold 20349上,基因全长为5 359 bp。使用BDGP在线分析Actin-5C基因启动子,以Actin-5C基因转录起始密码子(ATG)的第一个碱基A作为+1,Actin-5C基因5′端上游-2 609~-94 bp区域内有启动子活性,且启动子分值达0.8以上,其中-2 198~-2 148 bp时的分值最高,达到0.98(表2)。使用软件TSSG、TSSP、Promoter 2.0和FPROM预测Actin-5C启动子基因序列,将预测结果汇总后制图(图1)。使用Cister预测转录元件,在-220 bp处检测到CAAT盒信号;在-1 444 bp处检测到TATA盒信号(表3)。经比较取最有可能的1 156 bp(-1 236~-80 bp)、1 745 bp(-1 825~-80 bp)和2 059 bp(-2 139~-80 bp)截断启动子片段构建pGL3-1 156、pGL3-1 745及pGL3-2 059三种质粒。

表2 BDGP启动子预测工具预测Actin-5C基因非编码区序列中的启动子Tab.2 BDGP promoter prediction tool for Actin-5C promoter in non-coding region sequence
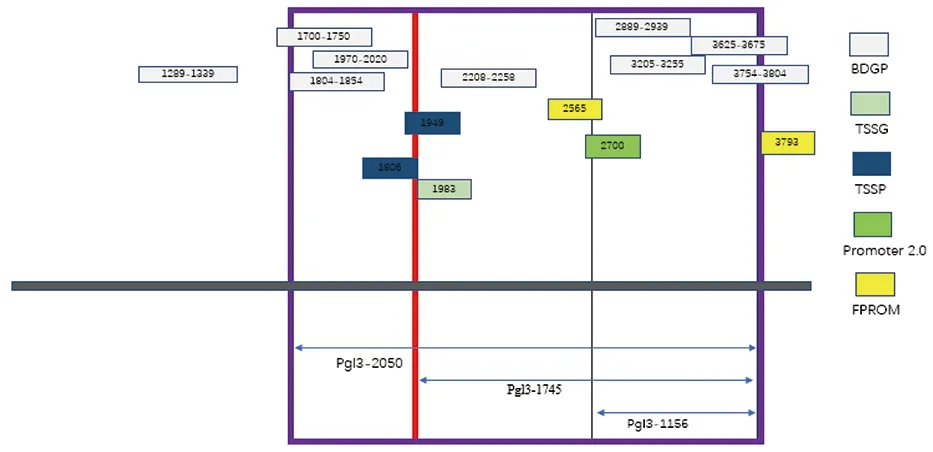
图1 多种启动子预测软件预测Actin-5C基因启动子Fig.1 A variety of promoter prediction software to predict the Actin-5C gene promoter

表3 Cister预测转录元件列表Tab.3 Cister predictive transcriptome list
2.2 家蝇Actin-5C转基因载体的构建
提取家蝇基因组DNA,并根据已经报道的Actin-5C基因预测启动子区,以家蝇基因组DNA为模板进行PCR反应,PCR产物与载体pGL3-Basic经同样的酶切回收,回收片段大小分别为1 156、1 745及2 059 bp,片段大小正确;将回收后的目的片段连接到报告基因pGL3-Basic载体上,转化筛选单克隆并提取阳性重组质粒,得到的重组质粒pGL3-1 156,pGL3-1 745,pGL3-2 059,片段大小正确;经Blast比对分析结果显示碱基序列正确,表明重组质粒构建成功。见图2和图3。
图3 重组质粒的测序结果(节选)Fig.3 Sequencing results of recombinant plasmids(Excerpt)
2.3 荧光素酶编码基因的转录检测
将3个重组质粒转染sf9细胞后RT-PCR逆转cDNA,以cDNA为模版检测荧光素酶编码基因,转录结果表示3个重组质粒载体转录成功(图4)。
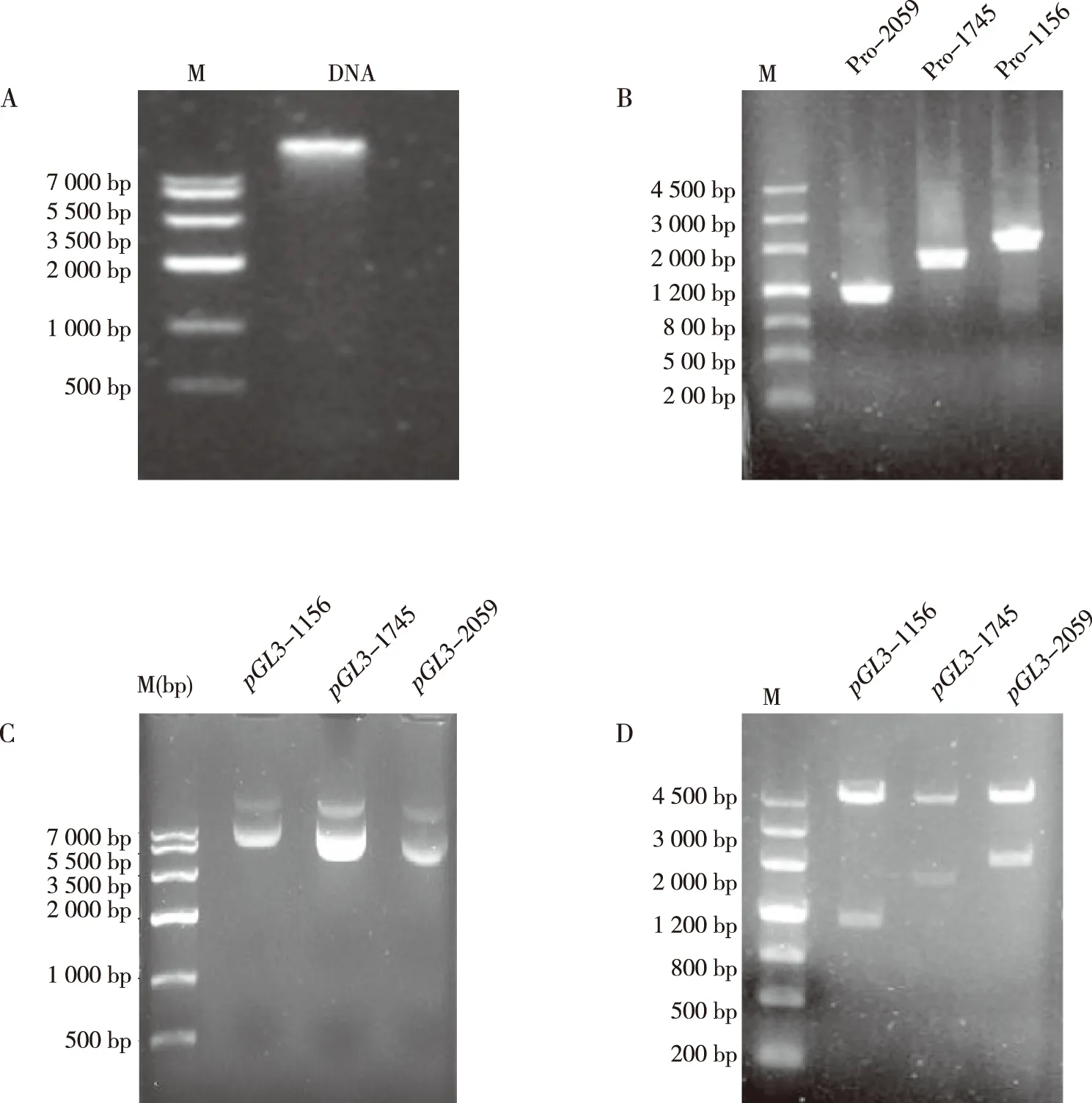
注:A为家蝇基因组DNA,B为酶切PCR产物,C为重组质粒,D为双酶切鉴定;M为DNA分子量标准Marker。图2 启动子重组质粒构建Fig.2 Construction of recombinant plasmid using promoter
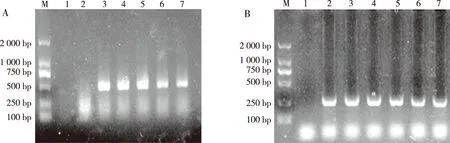
注:A为RT-PCR检测结果,B为内参;M为DNA分子量标准Marker,1为阴性对照,2为未转sf9,3为pGL3-Basic,4为重组质粒pGL3-1156,5为重组质粒pGL3-1745,6为重组质粒pGL3-2059,7为阳性质粒pGL3-Promoter。图4 RT-PCR检测重组质粒Fig.4 RT-PCR detection of recombinant plasmids
3 讨论
具有转录起始特异性的启动子是位于结构基因5′末端上游的非编码DNA序列,可以活化RNA聚合酶并使RNA聚合酶精确结合DNA模板,是基因转录调节的核心区域[12-13];真核生物启动子在转录调节中有着非常重要的作用,是RNA聚合酶特异性结合位点的转录调控元件[14-15]。利用生物信息学预测启动子,对于基因转录调控机制的研究这是一种重要的方法,它可以有效地从基因组中找到已知和未知的转录调控元件,为基因结构和功能的研究提供可靠的依据[16-17]。在真核基因表达调控系统中,基因转录的起始和调控主要通过顺式作用元件、反式作用因子和RNA聚合酶的协同作用实现[18]。顺式作用元件在起始位点和基因转录的转录效率中起决定性作用[19],并且基因的转录起始通常通过启动子实现[20]。启动子序列由核心元件TATA盒、正向核心启动子元件BRE、反向启动子元件DPE、启动子、CAAT盒和GC盒组成,这些都是通过生物信息学研究启动子的重要信息[21-23]。本研究在NCBI数据库对Actin-5C基因结构定位分析,对Actin-5C基因5′端正向3 898 bp序列进行分析,发现该基因的启动子区和核心启动子区;利用Promoter 2.0软件预测该基因的转录起始位点;通过Cister软件预测,对非编码区序列进行分析,发现Actin-5C基因有TATA盒信号,也有CAAT盒信号,经预测评分初步确定Actin-5C启动子的核心区域。
研究启动子需要生物信息学预测工具或软件,它可以大大简化理解基因的过程,通过预测和基因比对,人们可以更充分地了解基因及其编码的蛋白质[24]。生物信息学预测工具或软件等作为指引科研实验方向的辅助工具,其结果必须经过实验研究进一步证明[25-26]。目前常借助一些报告基因如双荧光素酶报告基因(luciferase)、绿色荧光蛋白报告基因(enhanced green fluorescent protein,EGFP)等瞬时表达,根据报告基因的表达情况,确定启动子中的一些相应元件的部位、功能及特性[18,27]。
对于家蝇分子生物学的研究与蚕、果蝇等昆虫相比,其理论研究不够深入,比如基因组特点、功能等,基因的表达调控是其发挥生物功能、调节机体生命过程的基础,而启动子是表达调控的关键,构建新的家蝇启动子片段报告基因载体是成功进行转基因家蝇研究的必要条件。本研究将Actin-5C基因生物信息学分析得到的结果,根据基因启动子的分析,克隆并成功构建不同启动子片段报告基因载体,为分析家蝇转基因载体的表达特征、家蝇转基因细胞系的建立以及转基因家蝇的养成奠定了基础,为研究Actin-5C基因启动活性及转录调控元件,探讨基因表达调控机制提供了实验依据。转基因家蝇是一个大工程,启动子效率的研究尤为重要,实验至此构建的3个重组质粒载体,初步检测均具有活性,为今后实验筛选出最强启动子提供了条件,具有重要意义。
