酒精对小鼠海马组织树突棘形态可塑性及记忆功能的影响*
2021-04-13李竹夏冰汪家文乐翠云王承飞丁九阳汪元河
李竹,夏冰,汪家文,乐翠云,王承飞,丁九阳,汪元河
(贵州医科大学 法医学院,贵州 贵阳 550004)
酒精滥用可导致神经退行性病变,进而产生认知及记忆障碍[1]。研究表明,高浓度酒精(25%)可明显损伤小鼠空间记忆及记忆巩固能力,主要机制为酒精可通过抑制转录因子CREB蛋白磷酸化从而抑制记忆巩固能力[2]。突触是神经系统中信息传递的重要结构,其形态及功能直接影响着神经元的信号传递过程,参与记忆的形成、巩固及消退的调节过程[3]。大脑内突触的数量及形态是一个动态的过程,外源性及内源性刺激维持着突触形态和功能的动态平衡,称为突触可塑性[4]。酒精可使突触形成障碍以及突触丢失,主要机制为酒精可活化小胶质细胞吞噬突触[5]。有学者在酗酒死者脑中检测到小胶质细胞趋化因子的升高,以及小胶质细胞数量的增多[6]。树突棘可分为成熟树突棘与幼稚树突棘两类,前者包括树桩状树突棘及蘑菇状树突棘,后者包括细丝状树突棘等[7],高浓度酒精可使树突棘数量明显减少,而低浓度酒精引起树突棘总量的变化。Ras相关的C3肉毒杆菌毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)是一种小GTP酶,在记忆形成及提取过程中发挥着重要作用。研究表明,Rac1可通过调节细胞骨架的重塑来影响突触形态和功能可塑性,因此被称为突塑可塑性的分子开关[8]。学习记忆可诱导新的记忆形成,同时,也可以通过激活Rac1负向调控已存储记忆[9]。酒精是否影响Rac1水平及树突棘可塑性的研究未见报道,本文拟通过给予小鼠低浓度酒精(20%)制作亚急性模型,同时给予Rac1抑制剂干预,观察酒精对树突棘形态可塑性的影响。
1 材料与方法
1.1 材料
1.1.1动物 C57BL/6雄性小鼠(SPF级,4周龄)15只,购自陆军军医大学实验动物中心[SCXK(渝)2017-0032]。动物饲养于贵州医科大学动物中心,小鼠自由饮水及食物,12 h灯光光照/黑暗循环,环境温度(22±3)℃、湿度45%~55%。
1.1.2试剂及药品 β-actin (K200058M,北京索莱宝科技有限公司),Synatophysin抗体(PA1-1043,美国Thermofisher Scientific公司),Synapsin I抗体(A6442,美国Thermofisher Scientific),PSD95(MA1-045,美国Thermofisher Scientific),萤光黄(L0144,美国Sigma-Aldrich公司)。
1.1.3仪器 蔡司显微镜(LSM900,德国蔡司公司),电泳仪(DYCP-31DN,南京庚辰科学仪器有限公司),ECL化学发光成像系统(Tannon-5200,上海天能有限公司),全自动膜片钳系统(NPC-16,德国Nanion公司),Morris水迷宫分析系统(XR-XM101,上海欣软信息科技有限公司)。
1.2 实验方法
1.2.1实验分组 15只4周龄野生型雄性小鼠随机分成对照组(Control,Con组)、单纯酒精处理组(Ethanol,Et组,小鼠腹腔注射20%乙醇2 mL/kg、每天1次、持续2周)及EHOP016治疗组(Et+EHOP016组,小鼠腹腔注射20%乙醇2 mL/kg后、立即灌胃EHOP016 10 mL/kg、持续2周)。
1.2.2Morris水迷宫实验 各组小鼠乙醇等药物处理的最后5 d,开始Morris水迷宫检测(平台置于第3象限),实验前训练小鼠寻找平台,若小鼠60 s内未找到平台、则引导其至平台并停留30 s;将小鼠面壁由第1象限放入水迷宫中,观察小鼠站上平台时间、记录为逃避潜伏期,同时记录小鼠在60 s内穿越平台次数、以及平台象限停留时间。
1.2.3树突棘形态观察 水迷宫实验结束后8 h,苯巴比妥麻醉小鼠后打开胸腔,蠕动泵针入左心室灌注生理盐水3 min,待肝脏颜色变淡后将脑组织取出,置于4% 多聚甲醛内固定48 h;振动切片机切片(40 μm),利用膜片钳系统玻璃电极将萤光黄注射入海马锥体层细胞胞体内(电流钳制在1~3 nA,持续注射20 min),直到所有树突均显示后撤除电极;封片后在共聚焦显微镜下观察树突棘形态。
1.2.4海马Ras相关的C3肉毒杆菌毒素底物1-三磷酸鸟苷(Rac1-GTP)、Ras相关的C3肉毒杆菌毒素底物1总蛋白(Total Rac1)、突触素I(Synapsin I)、突触体素(Synatophysin)和突触后致密蛋白95(PSD95)表达 分离小鼠海马组织,提取总蛋白后经PAGE胶电泳分离、转膜、封闭,再与Synapsin I、Synatophysin、PSD95、Rac1、Rac1-GTP及β-actin 抗体(1 ∶3 000稀释)4 ℃孵育过夜;二抗室温孵育1 h后滴加ECL发光液显影,以β-actin值作为上样控制,Image J软件测量灰度值。
1.3 统计学分析
2 结果
2.1 酒精对小鼠海马组织Rac1蛋白激活、树突棘数量及记忆功能的影响
给予小鼠酒精处理2周后,Western blot结果显示,两组小鼠海马组织Rac1总蛋白水平无差异,而Et组海马组织激活型Rac1蛋白Rac1-GTP水平较Con组升高(P<0.05);Synapsin I及Snyatophysin蛋白表达量较Con组降低(P<0.05,图1)。Et组海马区域树突棘总数量较Con组明显降低,主要表现为蘑菇型及树桩状树突棘数量较Con组降低,而细丝状树突棘数量则无明显差异(图1)。水迷宫实验结果显示,Et组小鼠60 s内平台穿越次数及平台象限停留时间较Con组减少(P<0.05,图1)。

注:A为Western blot检测Rac1-GTP、Total Rac1水平;B、C为Rac1-GTP、Total Rac1蛋白水平统计分析;D为萤光黄注射部位,黑框为海马神经元锥体层细胞所在区域;E为小鼠海马组织神经元树突棘荧光图,Bar=1 mm;F为小鼠海马区域神经元树突棘总数量统计分析;G为小鼠海马区域神经元各类树突棘数量统计分析;H为小鼠水迷宫轨迹示意图;I为小鼠水迷宫实验穿越平台次数统计分析;J为小鼠水迷宫实验平台象限停留时间统计分析;K为小鼠海马组织突触相关蛋白Synapsin I及Snyatophysin免疫印迹示意图及统计分析;(1)与Con组比较,P<0.05。图1 酒精对小鼠海马组织Rac1蛋白激活、树突棘数量及记忆的影响Fig.1 Effects of ethanol on the number and memory of mice hippocampal dendritic spines activated by Rac1 protein
2.2 抑制Rac1激活对小鼠记忆的影响
给予Rac1抑制剂EPOH016后,Rac1-GTP表达量较对照组明显降低,差异有统计学意义(P<0.05)(图2A、图2B)。水迷宫实验结果显示:Et组小鼠在第2、3、4及5天逃避潜伏期较Con组明显升高(P<0.05),给予EPOH016可明显缓解Et导致的逃避潜伏期的升高;Et组小鼠穿越平台次数及平台象限停留时间较Con组减少(P<0.05),而EPOH016可明显逆转Et导致的小鼠穿越平台次数及平台象限停留时间的减少(P<0.05),同时EPOH016可缓解Et导致的小鼠水迷宫实验逃避潜伏期的增高(P<0.05,图2C~图2F)。
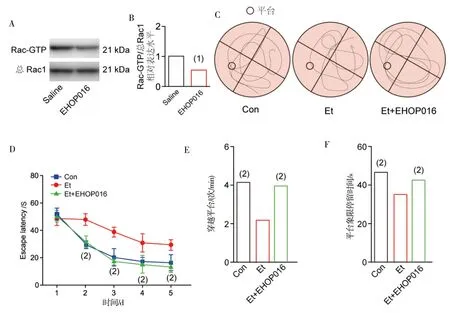
注:A为Western blot检测Rac1-GTP表达水平;B为Rac1-GTP表达水平统计分析;C为小鼠水迷宫轨迹示意图;D为小鼠水迷宫实验逃避潜伏期;E为小鼠水迷宫实验穿越平台次数统计分析;F为小鼠水迷宫实验平台象限停留时间统计分析;(1)与Saline组比较,P<0.05;(2)与Et组比较,P<0.05。图2 抑制Rac1激活对小鼠记忆的影响Fig.2 Effects of inhibition of Rac1 activation on memory in mice
2.3 抑制Rac1对小鼠树突形态可塑性及突触相关蛋白的影响
给予Rac1抑制剂EHOP016后,结果显示EHOP016可逆转Et诱导的树突棘总数量、蘑菇状及树桩样树突棘的数量的丢失(P<0.05),而对细丝状树突棘无影响(图3A~图3C)。Western blot结果显示,酒精可导致突触相关蛋白Synapsin I、Snyatophysin及PSD95水平下降(P<0.05),而EHOP016可缓解Et导致的突触相关蛋白Synapsin I、Snyatophysin及PSD95水平的降低(P<0.05,图3D~图3G)。
3 讨论
本研究用20%浓度酒精给予小鼠连续处理2周,制作酒精亚急性模型,观察到酒精可明显损伤小鼠记忆能力,并可使背侧海马组织突触相关蛋白明显减少。本研究所用酒精浓度较其它研究中所使用的酒精浓度稍低,因浓度过高酒精腹腔注射会损伤腹腔脏器浆膜层,故本研究选择了较为温和的浓度为20%的酒精[10]。海马结构是短期记忆形成的主要脑区,短期记忆一般在背侧海马储存并巩固,而长期记忆的形成及巩固则由背侧海马转移至前额叶皮层[11]。因此,本研究选择了背侧海马作为主要观察区域,在短期内(5 d)训练小鼠在Morris水迷宫寻找平台,实验结果显示与Louisa等[12]研究一致,酒精可明显降低小鼠记忆能力。
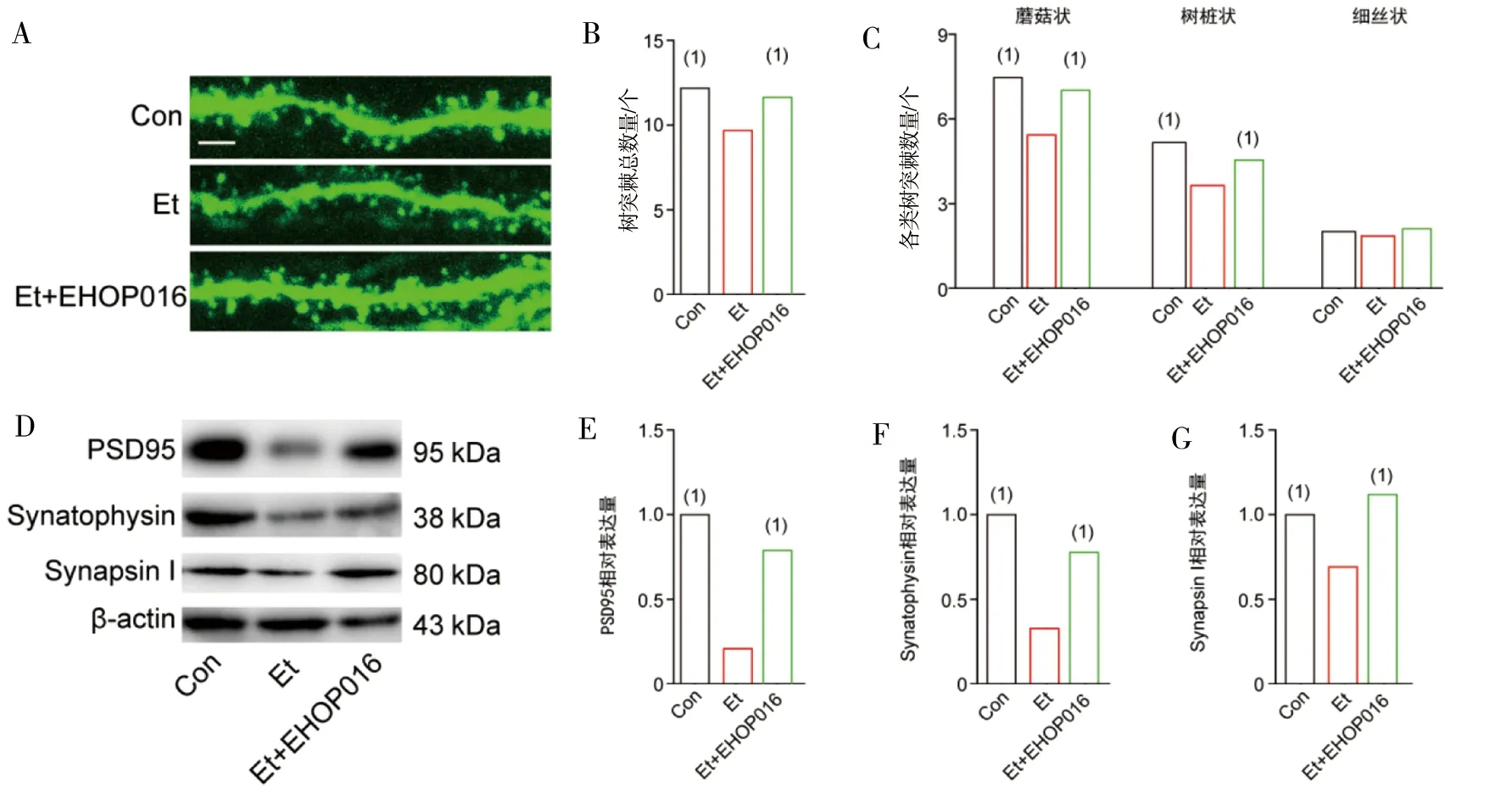
注:A为小鼠海马组织神经元树突棘荧光图,Bar=1 mm;B为小鼠海马区域神经元树突棘总数量统计分析;C为小鼠海马区域神经元各类树突棘数量统计分析;D为Western blot检测突触相关蛋白Synapsin I、Snyatophysin及PSD95水平;E为Synapsin I相对表达量统计分析;F为Snyatophysin相对表达量统计分析;G为PSD95蛋白相对表达量统计分析;(1)与Et组比较,P<0.05。图3 抑制Rac1对小鼠突触形态可塑性及突触相关蛋白的影响Fig.3 Effects of Rac1 inhibition on synaptic morphologic plasticity and synaptic related proteins in mice
本研究发现,在给予小鼠酒精处理后,Rac1蛋白被激活,表现为Rac1-GTP水平升高,同时伴有记忆行为的损伤;而当给予Rac1的抑制剂时,小鼠记忆得到明显改善,表明酒精导致的小鼠空间记忆损害是Rac1依赖的过程。有研究表明,在小鼠背侧海马脑区抑制Rac1蛋白的表达可缓解酒精导致的记忆损害[13-15]。此外,在阿兹海默病小鼠模型中,抑制Rac1的激活也可缓解淀粉样蛋白诱导的记忆损害[16-18]。值得注意的是,Rac1在不同脑区的功能不尽相同,Rac1的激活参与背侧海马脑区短期记忆的消退,而在杏仁核区域Rac1的功能则完全相反,Rac1激活在杏仁核参与短期记忆的形成及巩固过程[19-20]。这些均与本研究结果一致,表明Rac1可参与病理性的记忆损伤过程。
树突棘的形态可塑性是突触可塑性的表现形式,记忆的形成和巩固一般伴随成熟树突棘数量的增加,而记忆的消退则伴有成熟树突棘的丢失[21-22]。在本研究中,酒精可使蘑菇状以及树桩样等成熟树突棘数量的减少,而对幼稚型树突棘即细丝状树突棘无影响,表明酒精可能是通过调节成熟树突棘的数量来诱导记忆损伤。当给予Rac1抑制剂时,小鼠海马区域成熟树突棘的数量较酒精处理组明显增加,表明Rac1可通过调节成熟树突棘的数量来影响记忆的过程。
综上所述,酒精可激活Rac1、上调Rac1-GTP水平,导致成熟型树突棘数量减少、突触可塑性病理改变,最终导致记忆损伤;而抑制Rac1激活可明显缓解酒精导致的记忆损害。因此,抑制Rac1可作为酒精导致记忆损伤的潜在靶点,为临床上开发Rac1抑制剂治疗酒精导致的记忆损害提供了研究基础。
