神经外科术后颅内感染患者接受利奈唑胺治疗方案的疗效及安全性探讨
2021-04-11刘振旭
刘振旭
微山县人民医院神经外科,山东济宁 277600
神经外科术后感染主要分为两种,一种是表浅感染,以切口感染为主;一种是深部感染,以帽状腱膜下、脑膜、颅骨和脑组织等部位的感染为主[1]。 从神经外科临床实践来看,颅内感染在众多感染并发症中较为常见,不仅容易造成较为严重的后果,并且较难进行控制[2]。利奈唑胺属于恶唑烷酮类合成抗菌药物,可通过对70S 始动复合物形成抑制,达到阻碍细菌蛋白质有效合成的目的[3]。 同时,现代医学研究表明,利奈唑胺具有良好的脑脊液组织穿透能力,并且对于传统药物万古霉素表现不理想的屎肠球菌和粪肠球菌作用明显,因此在神经外科术后颅内感染患者中有较好的应用前景[4]。 该文即采用回顾性分析方法,择选40例2017 年1 月—2019 年1 月该院神经外科收治的术后颅内感染患者为研究对象,就利奈唑胺治疗方案的疗效和安全性进行了分析,现报道如下。
1 资料与方法
1.1 一般资料
采用回顾性分析方法,40 例于该院神经外科接受治疗的颅内感染患者为研究对象,所有患者均接收利奈唑胺治疗方案,其中男性患者和女性患者分别为22 例和18 例;最小年龄8 岁,最大年龄68 岁,平均年龄(43.21±5.49)岁。 40 例患者的疾病分布情况中,脑膜瘤、胶质瘤、听神经瘤、颅脑外伤、神经鞘瘤、脑出血、脑脓肿各6 例、5 例、5 例、7 例、3 例、8 例、6 例。
纳入标准:研究时间区间内,该院神经外科收治的颅内感染患者,包括急诊患者、神经外科术后并发颅内感染患者。 所有患者均符合颅内感染诊断标准,即术后CSF 细菌培养结果呈阳性的患者, 如患者未做培养或CSF 培养结果为阴性,满足如下标准,也可以确诊为颅内感染患者:①体温升高持续到手术后3 d,体温超过38.5℃, 同时表现有颅内感染相关体征,包括颈项强直、头痛等;②术后CSF 检测结果,白细胞数超过10×109/L 标准, 多核白细胞超过50.0%标准, 外周血白细胞超过10×109/L 标准, 葡萄糖低于2.25 mmol/L 标准。
该组研究经该院伦理委员会审核通过,患者对研究内容全部知情,且在知情同意书上签字。
1.2 方法
40 例患者颅内感染确诊后, 首先遵照指南接受经验性治疗, 经验性治疗方案无效或疗效不显著,再转为利奈唑胺治疗方案。
经验性治疗方案分为3 种,分别是万古霉素(国药准字H20084269) 联合头孢他啶 (国药准字H20063528)治疗方案、万古霉素联合美罗培南(国药准字H20093466)治疗方案,以及万古霉素联合头孢呋辛(国药准字H20073248)治疗方案。 40 例患者中,以上3 种方案分别有11 例、13 例和16 例。
1.3 观察指标
分别记录患者接受利奈唑胺(国药准字H20163338)治疗方案前后颅内感染各项临床症状的变化情况,CSF 的生化变化情况。 其中临床症状以体温变化情况、痰培养结果、以及CSF 培养结果为主。CSF 培养结果包含白细胞数、多核白细胞比例、白细胞介素-1 和葡萄糖等指标。
记录40 例患者药物相关不良反应的发生情况,常见反应有腹泻、血小板减少、白细胞减少、贫血等,计算不良反应发生率。
分别就40 例患者接受利奈唑胺治疗前后的体温、体征、症状、CSF 检测指标等结果进行对比,以无效、有效、显效3 级评定方法,评断40 例患者的治疗总有效率。
1.4 统计方法
采用SPSS 21.0 统计学软件对各项数据进行检验。 计量资料以(±s)表示,组间差异比较以t检验;计数资料以频数及百分比%表示,组间差异比较以χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效评价结果
该组研究中,40 例患者确诊颅内感染后均先接受经验性治疗方案,经验性治疗方案无效或疗效不显著,再转换为利奈唑胺治疗方案。 40 例患者接受万古霉素为主的经验性治疗的平均时间为6 d, 转为利奈唑胺治疗方案的治疗平均时间(13.2±5.6)d。改为利奈唑胺治疗方案后,患者各项临床症状普遍出现明显好转,仅1 例患者表现为无效,有效17 例,显效22 例,治疗总有效率为97.5%。
2.2 利奈唑胺治疗方案后1 周患者实验室指标变化情况
40 例患者接受利奈唑胺治疗方案1 周后, 与治疗前相比,治疗后实验室指标变化明显,差异有统计学意义(P<0.05),见表1。
表1 利奈唑胺治疗前后40 例患者实验室指标变化结果对比(±s)
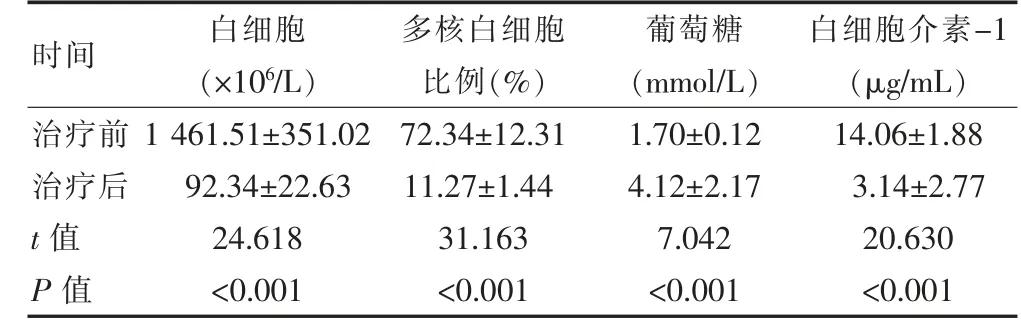
表1 利奈唑胺治疗前后40 例患者实验室指标变化结果对比(±s)
时间 白细胞(×106/L)多核白细胞比例(%)葡萄糖(mmol/L)白细胞介素-1(μg/mL)治疗前治疗后t 值P 值1 461.51±351.02 92.34±22.63 24.618<0.001 72.34±12.31 11.27±1.44 31.163<0.001 1.70±0.12 4.12±2.17 7.042<0.001 14.06±1.88 3.14±2.77 20.630<0.001
2.3 利奈唑胺治疗安全性评价
统计40 例患者接受利奈唑胺治疗方案后的不良反应发生率,无一例患者出现腹泻、血小板减少、白细胞减少、贫血等不良反应,不良反应发生率为0.0%。
3 讨论
中枢神经系统是人体的重要系统,在机体内拥有多重保护,包括脑膜、血脑屏障、颅骨、头皮等,一般情况下不容易出现感染[5-6]。同时,抗菌药物不科学使用、耐药菌株种类不断增多等因素,进一步增加了神经外科患者的术后颅内感染风险。
如神经外科患者术后发生颅内感染,如何选择抗菌药物是一个重要课题,其直接决定了治疗的有效性和安全性。 鉴于血脑屏障的特殊作用,选择一般的抗菌药物, 患者中枢神经系统、CSF 中的药物浓度很难达到理想的水平,因此抗菌效果和治疗效果不佳[7]。现代动物实验结果表明[8],抗菌药物在CSF 中的浓度只有达到致病菌最低杀菌浓度的10~20 倍,才能起到理想的杀菌效果。 在传统的抗菌药物中,β-内酰胺类药物属于非脂溶性药物, 其在炎性CSF 中的浓度很难达到10~20 倍的水平,而万古霉素、四环素、庆大霉素等药物, 很难实现对炎性CSF 的有效渗透。 其他药物,如氯霉素、磺胺类药物,虽然可以有效渗透CSF,但对于部分病原菌的杀灭效果有限,因此在药物选择上存在一定的困难[9]。 利奈唑胺属于近几年新兴的抗菌药物,具有口服吸收迅速的优点,血浆蛋白结合率超过30%, 患者服药2 h 就可以达到血浆峰浓度,且药物呈非浓度依赖性,无论是口服用药或是静脉滴注给药,均没有剂量调整的需求。同时,利奈唑胺具有良好的组织穿透性,可以有效穿过血脑屏障[10]。 对于部分肾功能存在缺陷的患者,或由于年龄原因肾功能水平下降的患者,不需要调整利奈唑胺的药物剂量。 鉴于以上优点,利奈唑胺是神经外科术后颅内感染患者新的抗菌药物选择。目前关于利奈唑胺的药物不良反应,仍存在一定的争议,部分研究指出利奈唑胺可能导致血小板减少等不良反应, 停药后不良反应消失。但从临床的角度,引发重症患者血小板减少的原因众多,并不能确定利奈唑胺就是造成血小板减少等不良反应的直接原因。
该组研究中,神经外科术后颅内感染患者接受利奈唑胺治疗方案后,结果显示:各项临床症状均出现好转,40 例患者中仅有1 例患者表现为“无效”,治疗总有效率为97.5%;接收治疗1 周后,患者脑脊液白细胞指标为(92.34±22.63)×106/L,葡萄糖指标(4.12±2.17)mmol/L,多核白细胞比例(11.27±1.44)%。优于治疗前的(1 461.51±351.02)×106/L、(1.70±0.12) mmol/L(P<0.05);不良反应发生率为0.0%。 以上结果证明,利奈唑胺药物对于神经外科颅内感染患者疗效显著,可有效改善患者各项临床症状, 同时不易导致腹泻、血小板减少等不良反应,具有较高的安全性,在万古霉素为主的经验性治疗方案无效或疗效不显著时,可以作为替代治疗方案, 或直接作为首选治疗方案使用。这与娄志刚等[9]的研究结果,采用利奈唑胺注射液治疗的有效率为95.6%基本一致。
综上所述,给予神经外科颅内感染患者利奈唑胺治疗,可有效改善患者各项临床症状,提高患者治疗有效率,同时患者不容易出现不良反应,具有较高的安全性,适合临床应用和推广。
