万古霉素血药浓度与肾功能指标间的关系
2020-11-06李建军张虎吴薇
李建军 张虎 吴薇

[摘要]目的 探讨静脉应用万古霉素后首次测定万古霉素谷浓度时的肾功能变化情况,评估万古霉素血药浓度与肾功能指标的相关性。方法 收集2015年1月~2017年12月在解放军第904医院(原101医院)神经重症监护室住院的61例重度脑损伤合并革兰阳性(G+)球菌肺炎患者,测定万古霉素用藥前及用药48 h后的血生化指标,包括尿素氮(BUN)、血肌酐(SCr)、β2微球蛋白(β2-MG)、α1微球蛋白(α1-MG)、胱抑素C(Cys-C),采用MDRD计算肾小球滤过率(eGFR)及万古霉素谷浓度。对用药前后的肾功能指标进行统计学分析,采用多元相关分析和多元线性回归分析对万古霉素血药浓度及肾功能指标的相关性进行分析。结果 用药后的β2-MG、Cys-C水平高于用药前,差异有统计学意义(P<0.05);用药前后的BUN、SCr、α1-MG水平比较,差异无统计学意义(P>0.05);用药后的eGFR水平低于用药前,差异有统计学意义(P<0.05)。万古霉素血药浓度与BUN、SCr、β2-MG及Cys-C水平成正相关(r=0.468、0.612、0.733、0.751,P<0.05),与eGFR水平成负相关(r=-0.575,P<0.05),与α1-MG水平无相关性(P>0.05)。结论 应用万古霉素48 h后即可出现血β2-MG、Cys-C等指标的明显增高及eGFR水平降低,提示β2-MG、Cys-C、eGFR是早期敏感指标。万古霉素血药浓度与BUN、SCr、β2-MG、Cys-C水平成正相关,与eGFR水平成负相关。
[关键词]万古霉素;血药浓度;β2微球蛋白;胱抑素C;肾小球滤过率
[中图分类号] R978.1 [文献标识码] A [文章编号] 1674-4721(2020)9(c)-0008-04
[Abstract] Objective To explore the changes of renal function when the Vancomycin at a minimum concentration (Cmin) was first detected after intravenous administration of vancomycin, and to evaluate the correlation between blood concentration of Vancomycin and renal function indicators. Methods A total of 61 patients with severe brain injury and Gram-positive cocci (G+) pneumonia hospitalized in the Neuro-Intensive Care Unit of the 904th Hospital of the PLA (formerly 101 Hospital) from January 2015 to December 2017 were selected. The biochemical indicators including blood urea nitrogen (BUN), serum creatinine (SCr), β2 microglobulin (β2-MG), α1 microglobulin (α1-MG), cystatin C (Cys-C) before Vancomycin and 48 hours after medication were tested. The estimated glomerular filtration rate (eGFR) and Vancomycin concentration were calculated using Modification of Diet in Renal Disease. Statistical analysis was performed on the renal function indicators before and after medication, and the correlation between Vancomycin plasma concentration and renal function indicators was analyzed using multiple correlation analysis and multiple linear regression analysis. Results After treatment, the levels of β2-MG and Cys-C were higher than those before treatment, and the differences were statistically significant (P<0.05). There were no statistical differences in the levels of BUN, SCr, and α1-MG before and after treatment (P>0.05). After treatment, the eGFR level was lower than that before treatment, and the difference was statistically significant (P<0.05). The blood concentration of Vancomycin was positively correlated with the levels of BUN, SCr, β2-MG and Cys-C (r=0.468, 0.612, 0.733, 0.751, P<0.05), negatively correlated with the level of eGFR (r=-0.575, P<0.05), and not correlated with the level of α1-MG (P>0.05). Conclusion Forty-eight hours after using Vancomycin, indicators such as β2-MG and Cys-C increases significantly and eGFR decreases, suggesting that β2-MG, Cys-C, and eGFR are early sensitive indicators. The blood concentration of Vancomycin is positively correlated with the levels of BUN, SCr, β2-MG, and Cys-C, and negatively correlated with the level of eGFR.
[Key words] Vancomycin; Blood concentration; β2 microglobulin; Cystatin C; Estimated glomerular filtration rate
万古霉素(Vancomycin,VAN)属于糖肽类抗生素,对于各种耐药的革兰阳性球菌感染有很好的治疗效果,是严重耐甲氧西林金黄色葡萄球菌(Methicillin-resistant staphylococcus aureus,MRSA)的一线治疗药物,在临床中被广泛使用。依照2011年发表的《万古霉素临床应用中国专家共识》[1],对于一般成人患者,推荐万古霉素目标谷浓度维持在10~15 mg/L,对于MRSA感染的患者,为了克服MRSA中不断增加的万古霉素最低抑制浓度(MICs),万古霉素目标谷浓度应控制为10~20 mg/L,以有效控制金黄色葡萄球菌感染。然而,随着临床中对万古霉素谷浓度要求的提高,万古霉素带来的肾损伤比例也随之增加。本研究旨在分析静脉应用万古霉素后首次测定万古霉素谷浓度时的肾功能变化情况,评估万古霉素血药浓度与用药后肾功能指标的相关性。
1资料与方法
1.1一般资料
本研究為回顾性研究,入组患者为2015年1月~2017年12月在无锡解放军第904医院(原101医院)神经重症监护室住院的61例多种病因导致的重度脑损伤合并革兰阳性(G+)球菌肺炎患者,其中男47例,女14例;年龄18~86岁,平均(53.7±14.8)岁;颅脑外伤35例,脑出血10例,蛛网膜下腔出血4例,脑梗死9例,硬脑膜动静脉瘘1例,脑干出血2例;感染的细菌为金黄色葡萄球菌58例(其中MRSA13例),耐甲氧西林葡萄球菌(Methicillin-resistant staphylococcus,MRS)3例。纳入标准:①各种原因引起的颅脑损伤(脑外伤、脑血管病、脑肿瘤、脑血管畸形)、肾功能正常的患者;②年龄>18岁;③经临床表现、实验室检查和痰液细菌培养及药物敏感试验证实为合并G+球菌肺炎,且该致病菌对万古霉素敏感的患者。排除标准:①用药前存在肾功能不全或肾脏替代治疗者;②万古霉素应用<3 d;③药物敏感试验提示细菌对万古霉素耐药者;④用药前有中性粒细胞<2.0×109/L;⑤合并可能导致肾功能损伤的药物(如氨基糖甙类)者。
1.2方法
1.2.1万古霉素给药方案及血药浓度测定 所有患者采用静脉微泵输入万古霉素注射液,初始剂量为1.0 g,每12小时1次,输入时间≥2 h。在第5次万古霉素静脉给药前30 min抽静脉血送检万古霉素谷浓度。采用美国SCIEX公司的AB SCIEX4500系统检测万古霉素血药浓度。收集万古霉素用药前后(测定万古霉素血药浓度时)的血生化指标,包括尿素氮(BUN)、血肌酐(SCr)、β2微球蛋白(β2-MG)、α1微球蛋白(α1-MG)、胱抑素C(Cys-C)。
1.2.2细菌培养及药物敏感试验 采集患者的呼吸道深部痰液进行细菌培养及药物敏感测定,采用最低抑菌浓度(MIC法)和纸片琼脂扩散法(KB法),按照2013年美国临床实验室标准化协会(CLSI)标准判读结果。
1.3观察指标及肾损伤评估标准
观察患者万古霉素谷浓度和应用万古霉素前后的肾功能指标,包括BUN、SCr、β2-MG、α1-MG、Cys-C,采用MDRD计算肾小球滤过率(eGFR)。万古霉素相关性肾毒性损伤[2]:在应用万古霉素后,连续2次以上测定SCr升高≥45 μmol/L或较基线升高50%以上,并且不能用其他原因解释。
1.4统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料采用两配对样本均数比较的t检验或者配对秩和检验;对万古霉素血药浓度及肾功能指标间的相关性采用多元相关分析和多元线性回归分析,以P<0.05为差异有统计学意义。
2结果
2.1首次万古霉素谷浓度测定结果
万古霉素谷浓度<10 mg/L者32例,10~<20 mg/L者22例,≥20 mg/L者7例。应用万古霉素后6.56%(4/61)的患者出现万古霉素相关性肾损伤,其万古霉素血药浓度均>20 mg/L。
2.2应用万古霉素前后的血生化指标的比较
比较入组患者应用万古霉素前后的BUN、SCr、β2-MG、α1-MG、Cys-C、eGFR等指标,其中BUN、SCr、eGFR符合正态分布,采用配对t检验;β2-MG、α1-MG、Cys-C不符合正态分布,采用配对秩和检验。结果显示,用药后的β2-MG、Cys-C水平高于用药前,差异有统计学意义(P<0.05);用药前后的BUN、SCr、α1-MG水平比较,差异无统计学意义(P>0.05);用药后的eGFR水平低于用药前,差异有统计学意义(P<0.05)(表1)。
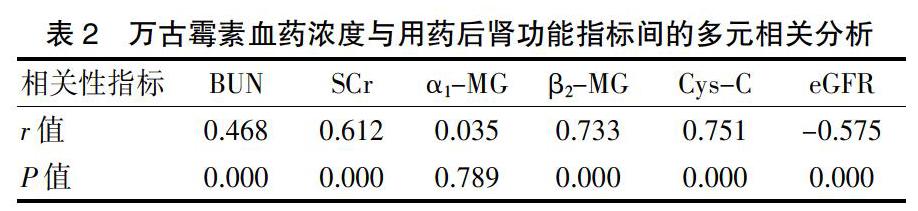
2.3万古霉素血药浓度与肾功能指标相关性的多元相关分析
万古霉素血药浓度与BUN、SCr、β2-MG、Cys-C水平成正相关(P<0.05),与eGFR成负相关(P<0.05),与α1-MG无相关性(P>0.05)(表2)。
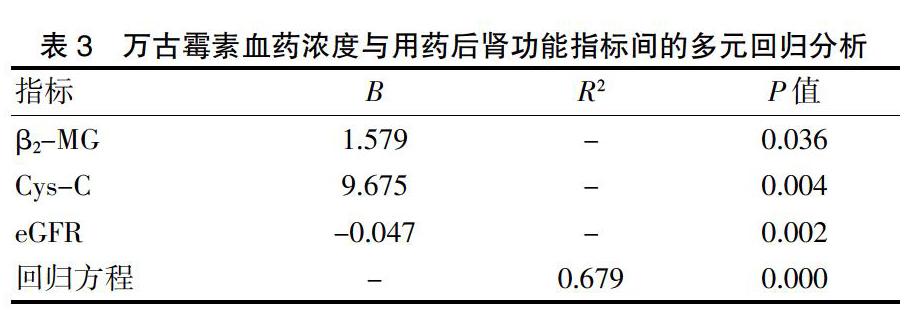
2.4万古霉素血药浓度与肾功能指标的多元回归分析
对万古霉素血药浓度与用药后肾功能指标进一步做多元回归分析,结果显示万古霉素血药浓度与用药后β2-MG、Cys-C、eGFR显著相关,差异有统计学意义(P<0.05)(表3)。
3讨论
万古霉素为一种糖肽类的亲水性抗菌药物,不能简单地扩散通过细胞膜,必须静脉给药。静脉给药后万古霉素分布于细胞外空间,体积分布为0.4~1.0 L/kg,血浆中10%~50%的药物与白蛋白相结合[3],肾功能正常半衰期为3~6 h,80%~90%的万古霉素以原形从肾小球滤过,部分药物既可近端被肾小管细胞分泌,也可被肾小管细胞重新吸收,在尿中被原型排出[4-5]。
随着制作工艺的改良,万古霉素纯度已提升到95%左右,使得肾毒性[6]明显减少。即使这样,随着万古霉素剂量、谷浓度的增高及治疗时间的延长,其肾毒性的风险也是随之增高。国外研究显示,日剂量2 g的肾毒性发生率在0~5%[7]。本研究(日剂量2 g)的肾毒性发生率为6.56%,与国外研究接近。当万古霉素日剂量≥4 g或者谷浓度>15 mg/L时,万古霉素相关肾毒性的发生率为20.0%~34.6%[8-10]。万古霉素的肾毒性的确切机制尚不清楚,多为万古霉素在近端肾小管的蓄积导致急性肾小管坏死和肾小球破坏[5],在肾活检的组织病理学研究中[11]已得到证实,其病理生理为万古霉素蓄积改变线粒体功能,在体外诱导近端小管细胞的剂量依赖性增殖[12]。多项研究已经将氧化应激作为一种潜在的肾毒性机制,而抗氧化剂对肾小管损伤具有保护作用[13],且肾毒性在大多数情况下是可逆的[14]。
在临床工作中,通常用BUN、SCr、Cys-C、eGFR等指标评价肾功能。BUN、SCr的干扰因素较多,如高蛋白饮食、高分解代谢、肌肉代谢情况及肌容量等。由于肾脏的强大储备和代偿能力,在损伤早期,BUN和SCr仍可维持正常,当BUN、SCr超过正常时,往往近2/3的腎功能已经受损,提示BUN和SCr不宜为早期肾功能损害的指标[15]。β2-MG在评价肾功能方面要优于BUN和SCr,在早期eGFR下降或肾小管受损时,即可出现β2-MG滤过及重吸收降解减少,导致β2-MG的增高,对于早期肾损伤的诊断有重要价值[16]。Cys-C是一种半胱氨酸蛋白酶抑制剂,仅在肾脏中代谢、滤过,可自由通过肾小球滤过膜,由近曲小管重吸收,重吸收后完全代谢分解,不返回血液。由于肾小管不分泌Cys-C,其血清浓度主要由eGFR决定,且体内产生速率恒定,不受个体生理因素(年龄、性别、血脂)和外在条件(饮食、炎症、肝病等因素)的影响[17]。因此,Cys-C是一个理想的反映eGFR、评估肾功能的内源性标志物,具有较高的敏感度和特异度[18]。
本研究发现,万古霉素的血药浓度与BUN、SCr、Cys-C、β2-MG成正相关,与eGFR成负相关。当肾功能正常,患者无明显的肾损伤临床表现时,Cys-C、β2-MG就明显升高,其原因与万古霉素在近端小管累积诱发急性肾小管损伤、导致eGFR下降相关,验证了其作为肾损伤早期敏感指标的特性,对急性肾损伤的早期预警具有重要意义。同时eGFR明显下降,为判断肾损伤的程度和调整用药提供了重要依据。这与回归分析发现万古霉素血药浓度与Cys-C、β2-MG和eGFR具有相关性显著相符;而通常使用BUN、SCr及尿量作为肾损伤的判断标准,往往受到肾脏的强大代偿能力和机体的代谢状态所干扰,进而延迟诊断,错失早期干预的时机。
本研究还显示,用药前的eGFR均值明显升高,分析原因与部分患者[34.4%(21/61)]存在肾功能亢进[19](augmented renal clearance,ARC)相关,即当肌酐清除率>130 ml/(min·1.73m2)时,肾脏对药物的清除能力增强。国内有研究报道,重症患者因急性应激状态及液体治疗,常伴随心输出量增加,引起肾脏前负荷增加,导致肾脏高灌注高滤过,eGFR明显升高,加速万古霉素的清除[20]。本研究入组病例多为临床危重症,且年龄偏低,基础肾功能较好,故ARC占比较大,这也是导致万古霉素谷浓度<10 mg/L占比达52%(32/61)的主要原因。
综上所述,应用万古霉素48 h后即可出现血β2-MG、Cys-C明显增高及eGFR降低,即使患者无肾功能损害的临床表现,提示血β2-MG、Cys-C和eGFR是肾损伤的早期敏感指标。万古霉素血药浓度与BUN、SCr、β2-MG、Cys-C水平成正相关,与eGFR水平成负相关。因此,作为危重症合并感染的患者,在应用万古霉素治疗过程中,不仅要监测万古霉素的谷浓度,更要重视肾功能相关指标的监测,为早期发现肾损伤、有效降低患者的肾毒性风险、及时调整用药提供依据。
[参考文献]
[1]陈佰义,管向东,何礼贤,等.万古霉素临床应用中国专家共识(2011版)[J].中国新药与临床杂志,2011,30(8):561-573.
[2]Rybak M,Lomaestro B,Rotschafer JC,et al.Therapeutic monitoring of vancomycin in adult patients:a consensus review ofthe American Society of Health System Pharmacists,the Infectious Diseases Society of America,and the Society of Infectious Diseases Pharmacists[J].Am J Health Syst Pharm,2009,66(1):82-98.
[3]Jeffres MN.The Whole Price of Vancomycin:Toxicities,Troughs,and Time[J].Drugs,2017,77(11):1143-1154.
[4]?íma M,Hartinger J,Cikánková T,et al.Importance of vancomycin loading doses in intermittent infusion regimens[J].J Infect Chemother,2018,24(4):247-250.
[5]Bamgbola O.Review of vancomycin-induced renal toxicity:anupdate[J].Ther Adv Endocrinol Metab,2016,7(3):136-147.
[6]Zaric RZ,Milovanovic J,Rosic N,et al.Pharmacokinetics of vancomycin in patients with different renal function levels[J].Open Med,2018,13(1):512-519.
[7]Hazlewood KA,Brouse SD,Pitcher WD,et al.Vancomycin-associated nephrotoxicity:grave concern or death by character assassination?[J].Am J Med,2010,123(2):182.
[8]Van Hal SJ,Paterson DL,Lodise TP.Systematic review and meta-analysis of vancomycin-induced nephrotoxicity associated with dosing schedules that maintain troughs between 15 and 20 milligrams perliter[J].Antimicrob Agents Chemother,2013,57(2):734-744.
[9]de Almeida CDC,Silva ACSE,de Queiroz Oliveira JA,et al.Vancomycin-associated nephrotoxicity in non-critically ill patients admitted in a Brazilian public hospital:a prospective cohort study[J].PLoS One,2019,14(9):e0222095.
[10]Lodise TP,Lomaestro B,Graves J,et al.Larger vancomycin doses (at least four grams per day) are associated with an increased incidence of nephrotoxicity[J].Antimicrob Agents Chemother,2008,52(4):1330-1336.
[11]Tantranont N,Obi C,Luque Y,et al.Vancomycin nephrotoxicity:vancomycin tubular casts with characteristic electron microscopic findings[J].Clin Nephrol Case Stud,2019, 7:66-72.
[12]King DW,Smith MA.Proliferative responses observed following vancomycin treatment in renal proximal tubule epithelial cells[J].Toxicol Vitro,2004,18(6):797-803.
[13]Elyasi S,Khalili H,Hatamkhani S,et al.Prevention of vancomycin induced nephrotoxicity:a review of preclinical data[J].Eur J Clin Pharmacol,2013,69(4):747-754.
[14]Pritchard L,Baker C,Leggett J,et al.Increasing vancomycin serum trough concentrations and incidence of nephrotoxicity[J].Am J Med,2010,123(12):1143-1149.
[15]李瑾,殷少军,李微,等.血清胱抑素C、尿微量蛋白联合检测在万古霉素致早期肾损害中的应用[J].实用药物与临床,2012,15(5):276-278.
[16]刘琳,李林英,潘柏莉,等.尿液α1-MG联合血清β2-MG、Cys-C检测在慢性肾小球肾炎早期诊断中的价值[J].检验医学与临床,2018,15(22):3408-3410,3414.
[17]Elsayed MS,El Badawy A,Ahmed A,et al.Serum cystatin C as anindicator for early detection of diabetic nephropathy in type 2 diabete smellitus[J].Diabetes Metab Syndr,2019, 13(1):374-381.
[18]張毕明,肖帅,吴意.胱抑素C诊断早期急性肾损伤价值的Meta分析[J].检验医学与临床,2018,15(23):3485-3491.
[19]钟晗,崔敏,张在丽,等.肾功能亢进在重症患者中的发生率及对万古霉素应用的影响[J].中国医院药学杂,2019, 39(1):57-59,105.
[20]王金龙,王皓飞,石梦娟,等.重症患者万古霉素谷浓度达标情况及其影响因素分析[J].中华内科杂志,2019,58(8):572-576.
(收稿日期:2020-07-17)
