Cu-MOF-199/多壁碳纳米管修饰玻碳电极检测食品包装中迁移的双酚A
2021-04-10黄迪惠黄小洲陈锦阳张飞吉叶瑞洪
黄迪惠,黄小洲,陈锦阳,张飞吉,叶瑞洪∗
(1.福建师范大学福清分校海洋与生化工程学院;近海流域环境测控治理福建省高校重点实验室,福建 福清350300;2.福建师范大学 生命科学学院,福建福州350117)
双酚A,学名2,2-双(4-羟基苯基)丙烷,简称双酚丙烷,又称BPA,白色晶体,熔点156~158℃,主要用于环氧树脂(约65%)和聚碳酸酯(约35%)的制备,也可用于增塑剂、阻燃剂、抗氧化剂、热稳定剂、橡胶抗氧化剂、农药、涂料等精细化工产品[1]。双酚A也是一种重要的有机化工原料,是苯酚和丙酮的重要衍生物,通常用于工业上合成聚碳酸酯(PC)和环氧树脂。自20世纪60年代以来,它被用于制造塑料瓶或奶瓶、幼儿吸盘、食品和饮料或牛奶[2]。双酚A无处不在,从矿泉水瓶、医疗器械到食品包装,基本都有它[3]。因此,其安全性问题成为了公众关注的焦点,全球每年大约生产2 700万t含有BPA的塑料。双酚A可引起内分泌紊乱,威胁胎儿儿童的健康[4]。
目前双酚A的检测方法有分光光度法、荧光分光光度法、毛细管电泳法、气相色谱法、高效液相色谱法等[5-6],但这些方法存在预处理非常复杂,仪器设备不经济,不利于快速检测等缺点。电化学传感方法具有简单、快速、便于现场检测等优点[7]。因此,本研究拟采用电化学方法用于测定BPA。虽然BPA具有电化学活性,但是玻碳裸电极对BPA的响应不高。因此为了克服这一缺点,通常在BPA电化学分析时,需要对电极进行修饰改性。碳纳米管[8]、石墨烯[9]、壳聚糖[10]等材料已经成功运用于BPA的电化学分析检测。金属-有机框架(MOFs)[11]是近几十年发展起来的一种新型多孔材料,并且其具有孔径可调节性、比表面积超高及易于功能化等特点[12],被广泛用于气体吸附分离,气体储存,催化等领域。近年来,MOFs材料也广泛用于传感器制备,由于大多数MOFs材料属于绝缘材料,其导电性差[13-14]使MOFs材料很难产生电化学信号。因此,探索用于电化学传感应用的稳定且导电的MOF基复合材料是非常重要的。三维的Cu-MOF-199具有较大的比表面积,并且可以起到吸附大量BPA分子的作用。多壁碳纳米管(MWCNTs)具有良好的电导性,经常用作电化学传感器的修饰材料[15],而将MWCNTs与Cu-MOF-199材料相结合,可大大提升MWCNTs的导电性能和电催化性能。所以本研究采用Cu-MOF-199/MWCNTs复合材料修饰电极,建立了一种Cu-MOF-199/MWCNTs复合材料修饰玻碳电极的制备方法,并将其应用于BPA的电化学检测。
1 实验部分
1.1 仪器与设备
电化学工作站,CHI660E型,上海辰华仪器公司,采用三电极系统,玻碳电极(GCE)为工作电极,铂电极(上海辰华仪器公司)为对电极,饱和甘汞电极(上海辰华仪器公司)为参比电极;电恒温鼓风干燥箱,GZX-GF101-3-BS-Ⅱ型,上海跃进理疗机械有限公司;扫描电镜,Q250型,美国赛默飞科技有限公司;透射电子显微镜,TECNAI G2 F20型,美国FEI科技有限公司。
1.2 主要试剂
双酚A,阿拉丁试剂(上海)有限公司;多壁碳纳米管(MWCNT),南京先丰纳米材料科技有限公司;1,3,5-苯三甲酸,阿拉丁试剂(上海)有限公司;硝酸铜,阿拉丁试剂(上海)有限公司;Nafion·D-521,阿法埃莎(中国)化学有限公司;N,N-二甲基甲酰胺,国药集团化学试剂有限公司;铁氰化钾,国药集团化学试剂有限公司;十二水合磷酸氢二钠,国药集团化学试剂有限公司;二水合磷酸二氢钠,国药集团化学试剂有限公司。
1.3 实验方法
1.3.1 碳纳米管羟基化
MWCNT材料在90℃下,用浓硫酸回流3 h,制得羧基化MWCNT(MWCNTs-COOH)冷却至室温,将混合物过滤。接下来用超纯水洗涤至溶液p H=7,最后通过冷冻干燥制得样品。
1.3.2 Cu-MOF-199/MWCNTs复合材料的制备
Cu-MOF-199的制备在先前的研究基础上进行修改[16]。首先使用58.33 mg的Cu(NO3)2·3 H2O溶于8 m L的DMF中、28 mg的1,3,5-苯甲酸溶于8 m L的乙醇中,然后将其混合在120℃烘箱加热12 h,再将其移入25 m L高压反应釜通过水热反应制得Cu-MOF-199。取10 mg制好的MWCNT,2 mg制 好 的Cu-MOF-199,20μL Nafion·D-521分散于10 m L DMF溶液中,即可制得Cu-MOF-199/MWCNTs复合材料。
1.3.3 电极的前处理
分别用0.3和0.05μm的氧化铝粉打磨电极,将打磨好的玻碳电极用铁氰化钾测定(循环伏安法电位范围为-0.2~0.6 V)来测定其电位差,直至电位差在90 V以下即可使用,测定后将玻碳电极置于超纯水中超声1 min去除表面上的残余铝粉,至其干燥表面无水痕后待用。制备好的玻碳电极应该现磨现用,以防其表面再次积尘与氧化。
1.3.4 修饰电极的制备
用10μL移液枪准确移取8μL Cu-MOF-199/MWCNTs复合材料电极修饰液,均匀滴在玻碳电极表面,放置在调至恒温55℃的烘箱内烘干(30 min)后用于电化学检测。
1.3.5 样品的制备
购买超市中的康师傅矿泉水取其瓶,加入p H=7的缓冲液,用恒温水浴锅模拟暴晒11 d。
2 结果与讨论
2.1 Cu-MOF-199的表征
图1和图2为合成的Cu-MOF-199的扫描电子显微镜(SEM)图片和透射电子显微镜(TEM)图片。通过图1(a)可以明显看出,合成的Cu-MOF-199具有典型且规则的晶体学几何结构,呈现为规则的多面体结构,大小在4μm左右。图1(b)的晶体全貌SEM图与单晶体的结构一致,MOF材料规则的结构,在与MWCNTs复合形成复合材料时可以吸附更多的双酚A,从而提高复合材料的电催化能力。图2为Cu-MOF-199的透射电子显微镜(TEM)图。通过TEM图可以进一步的观察合成的Cu-MOF-199的形态和结构特点,可以明显看出所呈现的也是规则的多面体结构,与SEM图像一致。图3为Cu-MOF-199的XRD谱图,图中尖锐的特征峰进一步证明Cu-MOF-199的晶体结构。

图1 Cu-MOF-199的SEM图片Fig.1 SEM images of the synthesized Cu-MOF-199

图2 Cu-MOF-199的TEM图片Fig.2 TEM images of the synthesized Cu-MOF-199
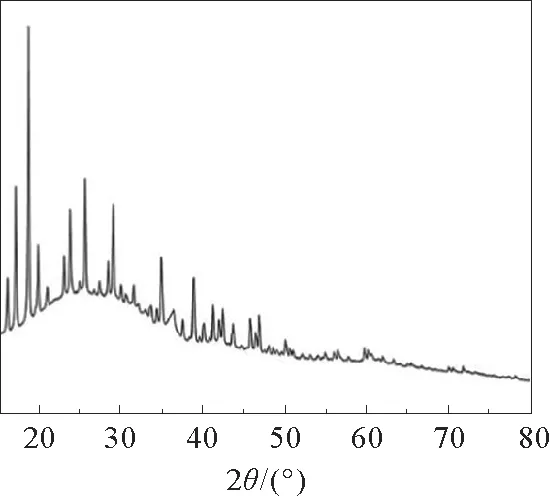
图3 Cu-MOF-199的XRD谱图Fig.3 XRD spectrum of the synthesized Cu-MOF-199
2.2 可行性分析
采用循环伏安法取测定裸电极、碳纳米管、Cu-MOF-199/MWCNTs复合材料修饰下的玻碳电极测定1×10-4mol·L-1BPA磷酸盐缓冲液中峰电流值的响应情况。电化学工作站采用电位范围为0.2~0.8 V,扫描速度为0.1 V·s-1,p H=7.0的1×10-4mol·L-1的BPA磷酸盐缓冲溶液下扫描,结果见图4。
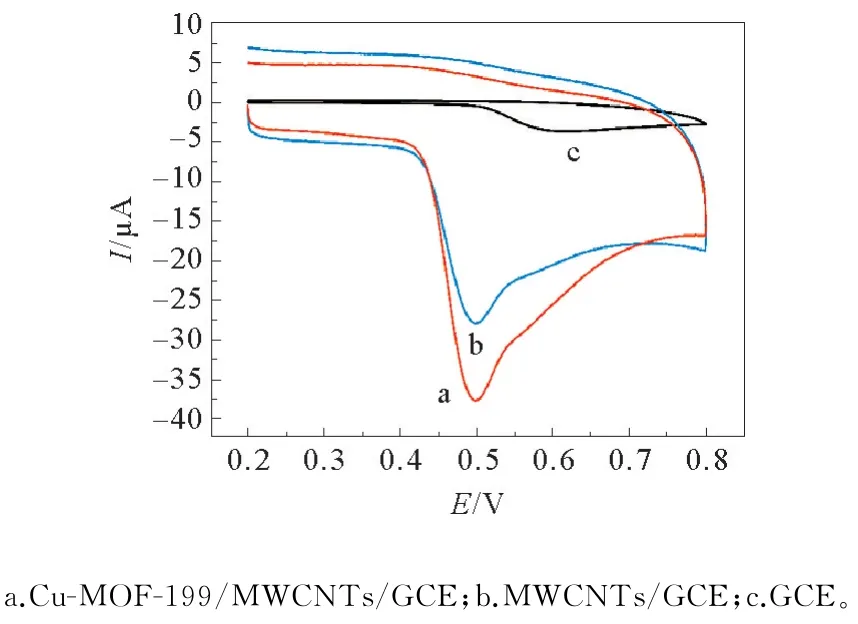
图4 Cu-MOF-199/MWCNTs/GCE、MWCNTs/GCE和GCE在0.1 mmol·L-1 BPA(p H=7.0)的循环伏安图Fig.4 Cyclic voltammograms of Cu-MOF-199/MWCNTs/GCE,MWCNTs/GCE and bare GCE in presence of 0.1 mmol·L-1 BPA at p H=7.0
从图4可以很明显看出,玻碳电极在无修饰材料时峰电流很低,在修饰了碳纳米管后峰电流显著提高,在修饰了Cu-MOF-199/MWCNTs复合材料后峰电流值显著增加。说明通过修饰Cu-MOF-199/MWCNTs复合材料可以很大程度提高检测BPA的灵敏度。电极在BPA缓冲溶液中仅仅出现一个氧化峰,并且反扫时无还原峰,说明BPA的电化学氧化是一个完全不可逆过程[16]。
2.3 修饰电极的电化学表征
将裸电极、修饰碳纳米管、修饰Cu-MOF-199/MWCNTs复合材料的电极放入铁氰化钾溶液中测定,得到的循环伏安图见图5。由图5可见,修饰Cu-MOF-199/MWCNTs复合材料的电极峰电流值最高。
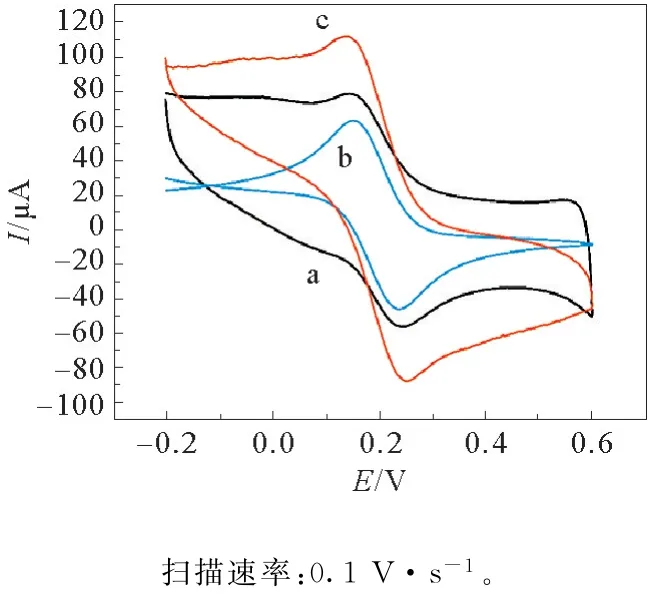
图5 GCE,MWCNTs/GCE和Cu-MOF-199/MWCNTs/GCE在含0.1 mol·L-1 KCl的5 mmol·L-1[Fe(CN)6]3-/4-溶液中的循环伏安图Fig.5 Cyclic voltammograms of bare GCE,MWCNTs/GCE and Cu-MOF-199/MWCNTs/GCE in 5 mmol·L-1[Fe(CN)6]3-/4-containing 0.1 mol·L-1 KCl
2.4 涂层优化
在准备好的玻碳电极上滴涂MOF修饰材料,研究了不同Cu-MOF-199/MWCNTs纳米复合材料层数对BPA氧化峰值电流Ip的影响见图6。
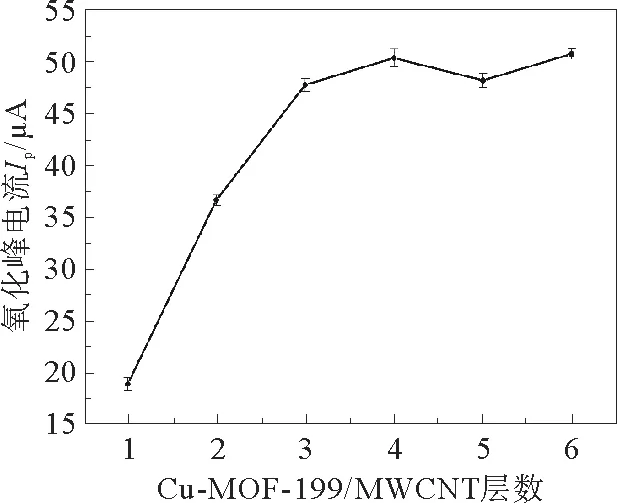
图6 Cu-MOF-199/MWCNTs纳米复合材料层数对0.1 mmol·L-1 BPA氧化的电流响应的影响Fig.6 Dependence of current response for 0.1 mmol·L-1 BPA oxidation on the number of layers of Cu-MOF-199/MWCNTs nanocomposite
从图6可明显观察到BPA的峰值电流随着滴涂层数的增加而增加,说明修饰材料可以提高玻碳电极的电催化能力。当进一步地增加滴涂层数,BPA氧化峰电流逐渐趋于平稳状态,这说明进一步增加薄膜厚度对氧化峰电流的影响不大。因此,选择了3层Cu-MOF-199/MWCNTs纳米复合材料作为构建修饰电极的最佳层数。
2.5 缓冲液种类的选择
实验为探究不同缓冲液对BPA的检测是否产生不同的影响,用磷酸盐缓冲液以及硝酸、硫酸、盐酸三酸混合液缓冲液,磷酸氢二纳-柠檬酸缓冲溶液测试,用循环伏安法扫描,电位范围区间为0.2~0.8 V,设置参数速率为0.1 V·s-1。结果如图7所示。从图7可明显看出,电极在磷酸盐缓冲液中电流值最高,可能因为磷酸盐缓冲溶液对电极吸附BPA的影响最小,所以,最终选择了磷酸盐缓冲液为最终的缓冲液。

图7 不同缓冲液对BPA电化学响应的影响Fig.7 Effect of different buffers on the electrochemical response of BPA
2.6 缓冲液p H的优化
磷酸缓冲溶液的酸碱度对检测BPA的电化学性质有很大的影响,所以很有必要考察最优p H值,寻求最优检测BPA的条件。本次实验设计了不同p H值的磷酸缓冲液,p H值分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5。采用线性伏安扫描法,对修饰3层MOF修饰材料进行电化学测定结果见图8。不同p H值和BPA氧化峰值电流之间的关系见图9。由图9可知,随着p H值的增大,峰电流先增大后降低,当p H值达到7时,峰电流最大。
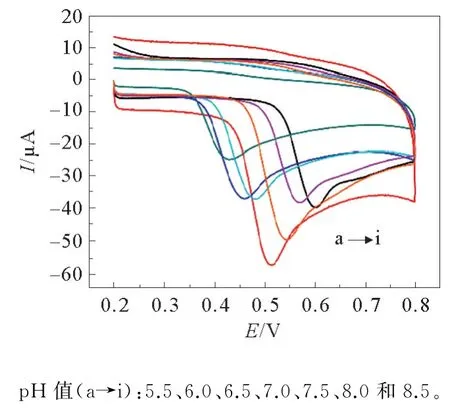
图8 Cu-MOF-199/MWCNTs/GCE在不同p H值下0.2 mol·L-1 PBS中存在0.1 mmol·L-1 BPA的循环伏安图Fig.8 Cyclic voltammograms of the Cu-MOF-199/MWCNTs/GCE in the presence of 0.1 mmol·L-1 BPA in 0.2 mol·L-1 PBS at different p H values
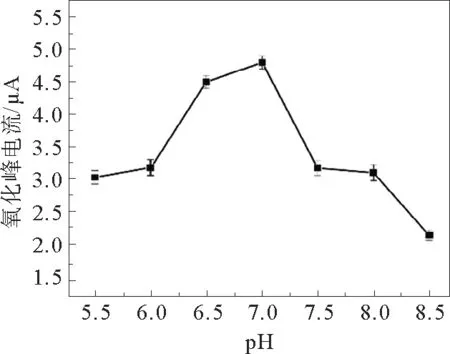
图9 不同p H值和BPA氧化峰值电流之间的关系Fig.9 Relationship between the different p H values and oxidation peak current of BPA in 0.2 mol·L-1 PBS
不同p H值与氧化峰电位之间的关系见图10。通过测定其峰电位值发现,随着p H值的增加峰电位明显负移。从图10中可以明显看出,随着p H值的增加,峰电位不断负移,说明BPA的氧化过程质子也参与了。氧化峰电位与p H值呈良好的线性关系,标准曲线方程:Ep=-0.056 9×p H+0.912 4(R2=0.996 3)。对于有质子参与的反应,存在Nernst方程:-0.059(m/n)p H。由能斯特方程可得,m为参与反应的质子数,n为参与反应的电子数,结合式可得:0.056 9=0.059(m/n),所以m/n≈1。说明BPA在该电极上是一个等电子等质子参与的不可逆氧化反应。
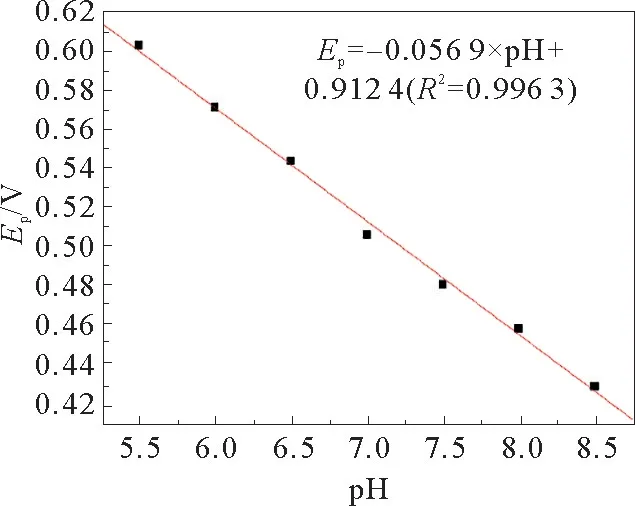
图10 不同p H值与BPA氧化峰电位之间的关系Fig.10 Relationship between the different p H values and oxidation peak potential of BPA in 0.2 mol·L-1 PBS
2.7 扫描速度的优化
富集时间为100 s,富集电位为0.3 V,修饰三层的玻碳电极在p H=7的磷酸盐缓冲液中不同扫描速率情况下的循环伏安图见图11。由图11可以发现,随着扫描速率的增加,氧化峰电流值也在不断增加。不同扫描速率与BPA氧化峰值电流之间的关系见图12。较小的扫描速率会产生较小的氧化峰电流,测得的结果不稳定,且测定时间较长所以实验的灵敏度会大大降低,影响到实验结果;反之如果扫描速度很大,反应很快,涂层会不稳定,修饰物很容易脱落。通过测其峰电流,得出回归直线见图13。实验最终选择扫描为100 m V·s-1。
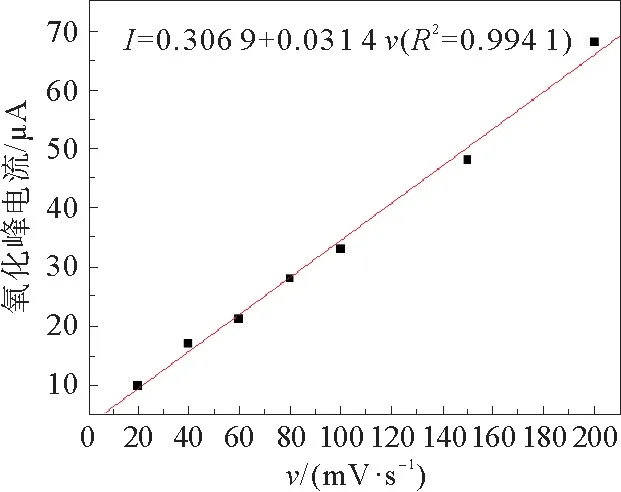
图12 不同扫描速率与BPA氧化峰值电流之间的关系Fig.12 Relationship between different scan rates and oxidation peak current of BPA
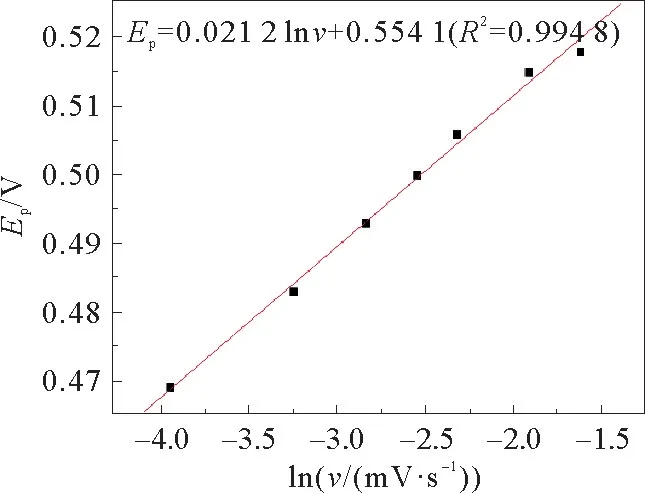
图13 在0.2 mol·L-1 PBS(p H=7.0)反应溶液中BPA的峰电位与扫描速率的自然对数之间的关系Fig.13 Relationship between the peak potential and natural logarithm of scanning rates for BPA(The reaction solution was 0.2 mol·L-1 PBS(p H=7.0))
2.8 富集电位和富集时间的影响
富集时间和富集电位会对BPA的检测产生一定的影响,所以本次实验需要优化富集时间和富集电位。将修饰了3层的修饰电极放入p H=7的磷酸盐缓冲液中检测。先将富集时间设置为50 s,进行富集电位的检测。依次进行了6组富集电位的测定结果见图14(a)。由图14(a)可明显看出,当富集电位为0.3 V时,峰电流值最高,所以就以0.3 V作为本次实验的富集电位。
接下来将富集电位设置为0.3 V,进行富集时间的测定。将修饰了3层的修饰电极放入p H=7的磷酸盐缓冲液中。进行5组富集时间的测定,结果见图14(b)。由图14(b)可明显看出,当富集时间达到200 s时,峰电流值最高,但是由于时间效率问题,所以实验最终选择0.3 V为最优富集电位,100 s为最优富集时间。
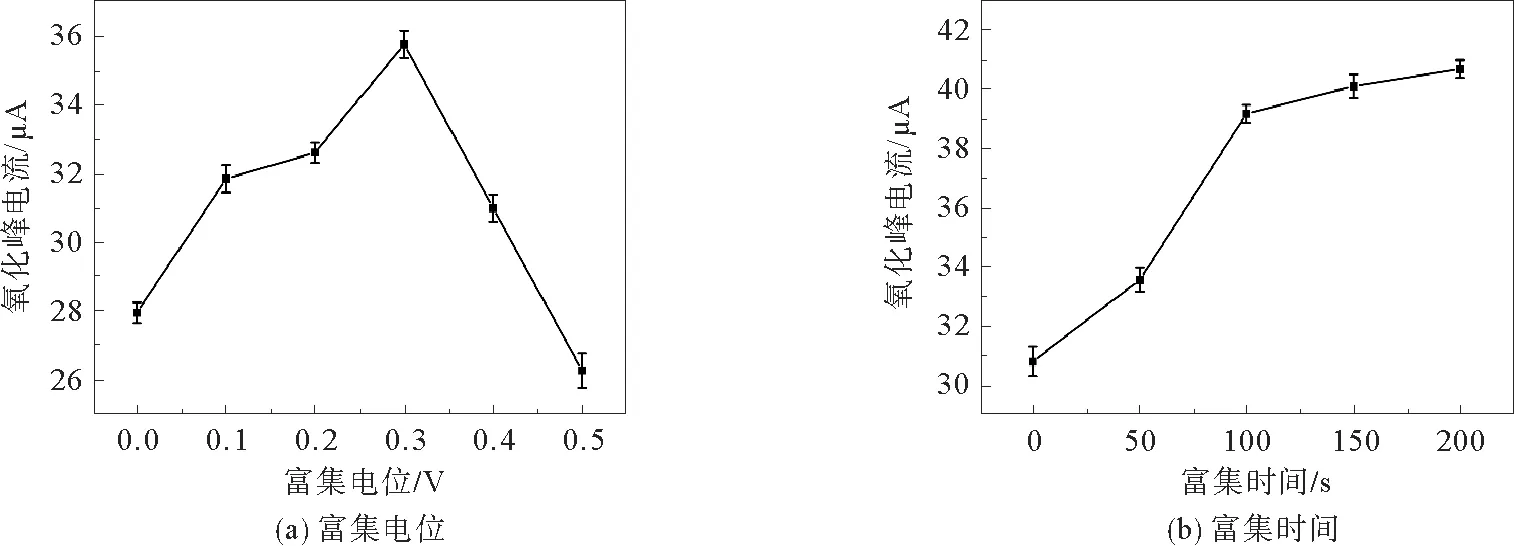
图14 富集电位和富集时间对0.1 mmol·L-1 BPA氧化峰电流的影响Fig.14 Dependence of current response for 0.1 mmol·L-1 BPA oxidation on deposition potential and deposition time
2.9 标准曲线的绘制
以富集时间为100 s,富集电位为0.3 V,修饰3层,扫描速度为100 m V·s-1的最优条件测定不同浓度的BPA样品溶液得到的CV见图15。可以发现,随着BPA浓度的增加,氧化峰电流也在增加。绘制标准曲线,见图16。
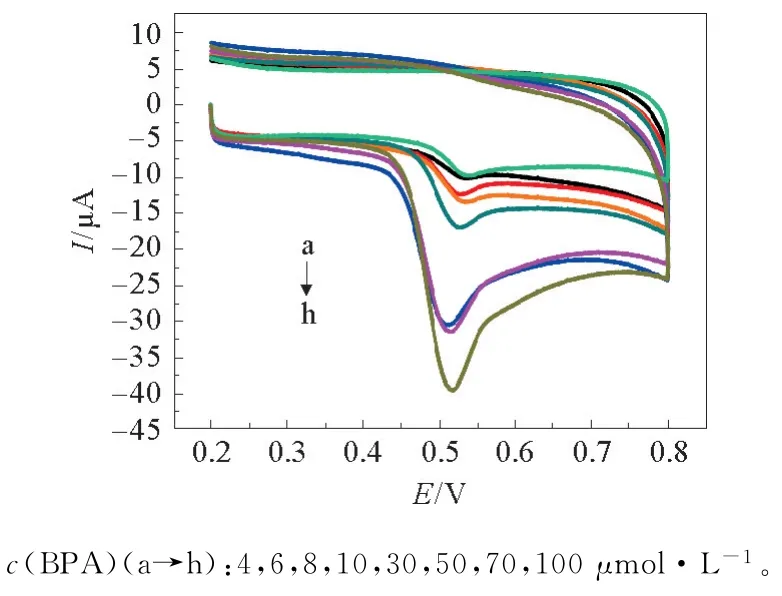
图15 不同浓度的BPA的循环伏安图Fig.15 Cyclic voltammogram curves of increasing concentration of BPA in 0.2 mol·L-1 PBS(p H=7.0)using the electrochemical sensor

图16 氧化峰电流与BPA浓度之间的关系(n=5)Fig.16 Relationship of the oxidation peak current with the target concentration
从回归方程中可以看到,BPA的氧化峰电流在5.0×10-5~1×10-4mol·L-1范围内有较好的线性关系。其中线性回归方程Ip=3.933 11+0.307 16c(R2=0.993 8)。在上述所最终确定的最优条件下,用线性扫描法对不同浓度的BPA进行8次连续测定,可以计算出得出相对偏差值为S=1.80×10-9,由上述标准曲线的方程可知斜率K=0.307 16,将S和K代入公式进行计算得:DL=3S/K=1.75×10-8mol·L-1。该结果与相关文献对比(表1),其检测限跟现阶段致力于建立检测BPA新方法的课题组相接近或者超越部分课题组,因此证明该修饰电极作为检测BPA具有一定的可行性和推广性。

表1 比较电化学方法检测分析双酚ATable 1 Comparison of some electrochemical for BPA detection
2.10 重复性,稳定性和抗干扰性
在上述所确定的最优条件下,用修饰过的玻碳电极对浓度为1×10-4mol·L-1的BPA缓冲液进行5次重复检测,其峰形基本没有发生变化,氧化峰电流轻微下降,通过计算其相对标准偏差(RSD)为4.3%范围内。从实验结果来看,修饰材料的重现性还是很好的。
在上述所确定的最优条件下,制备多根修饰电极,分别放置1,2,3 d,将放置后的修饰电极分别用1×10-4mol·L-1BPA缓冲液测定,每个时长做3个平行实验。通过数据,可以算出它们的RSD基本稳定在4.9%范围内。所以,此修饰材料还是有很好的稳定性的。
本实验的目的在于检测环境中的BPA。但是在实际检测中,检测过程往往会受到其他离子的干扰导致实验结果不准确或者有误。所以本次实验针对这一特性,并参考文献资料[19-20],选择环境中的Mg2+、Cl-、K+、SO2-4、Na+、NO-2、NO-3离子以及P-Nitrophenol等试样进行干扰实验测定。分别将1×10-2mol·L-1MgCl、8×10-3mol·L-1K2SO4、8×10-3mol·L-1NaNO3、8×10-3mol·L-1Na NO2、8×10-5mol·L-1对硝基酚加入BPA缓冲液中进行测定,测定结果见表2。由表2可以看出,当加入这些干扰离子时,对检测BPA的影响并不大。所以说明该方法对于检测环境中的BPA还是很有效果的。
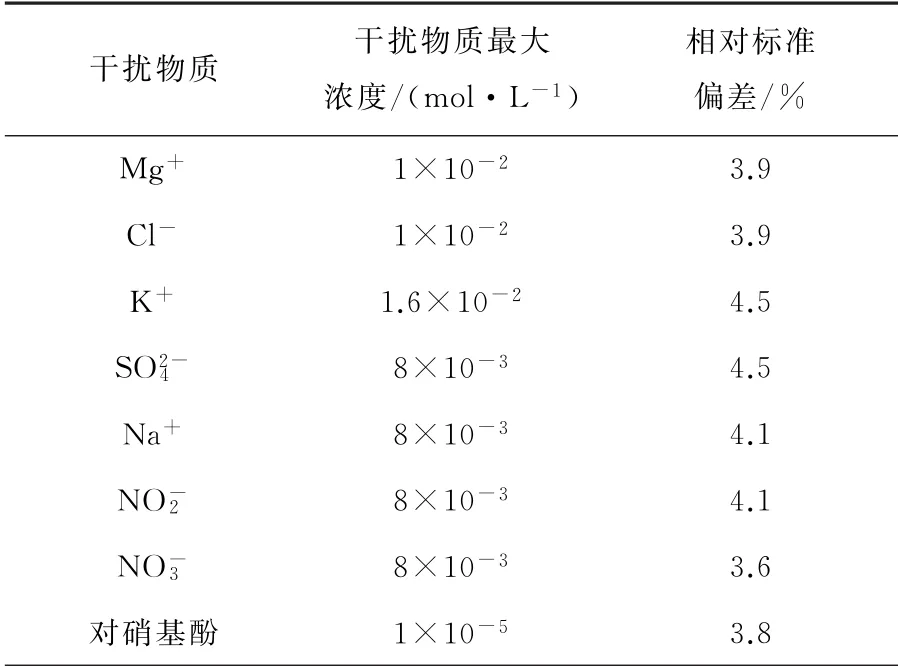
表2 共存干扰物质对BPA测定的影响(n=3)Table 2 Maximum tolerable concentration of coexisting substances with BPA(n=3)
2.11 样品的加标检测
通过加标来测定其回收率,在上述所确定的最优条件下,用线性扫描法测定从超市购买的康师傅矿泉水瓶中BPA,即矿泉水瓶的迁移量。每个样品都做3个平行实验。分别取0.2、0.3、0.4的1×10-2mol·L-1BPA于50 m L的容量瓶中,用暴晒过的矿泉水瓶中p H=7的缓冲液定容。先测矿泉水瓶中的缓冲液,未检测出BPA。然后对上述3种不同浓度的溶液的浓度进行测定,结果见表3。
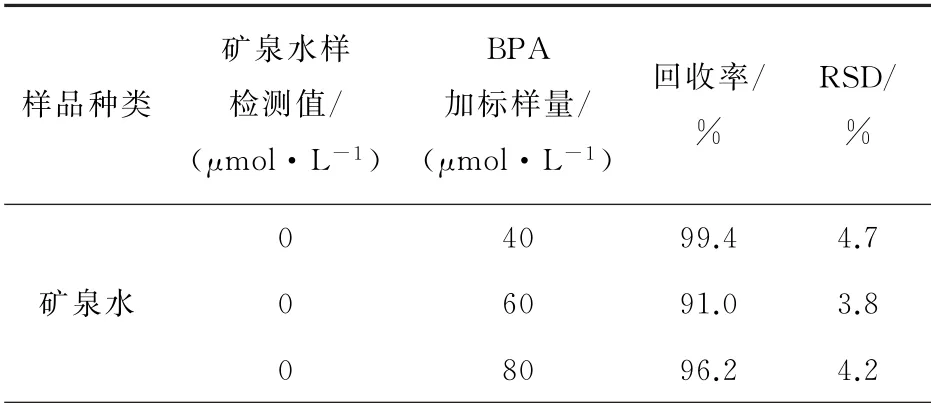
表3 矿泉水样品中BPA的测定Table 3 Determination of BPA in packaging drinking water samples
如表3所示,通过检测矿泉水瓶样液,显示结果为0,不在检出限范围内,说明该矿泉水是安全的。加入BPA标准样液40μmol·L-1,出现氧化峰分别是16.15μA,回收率99.4%。加入BPA标准样液60μmol·L-1测得氧化峰为20.70μA,回收率为91.0%。加入BPA标准样液80μmol·L-1,测得氧化峰27.56μA,回收率为96.2%。所以含有BPA的塑料瓶回收率范围为91.0%~99.4%,具有良好的回收率,所以本次实验可以用于实际塑料瓶装水BPA的测定。
3 结 论
在进行实验可行性分析时,通过对比空白,碳纳米管,Cu-MOF-199/MWCNTs复合材料修饰过的玻碳电极的峰电流,发现Cu-MOF-199/MWCNTs复合材料对于检测BPA具有很好的效果。可以进行实验。
通过对玻碳电极进行修饰层数时发现,在修饰3层时峰电流有明显的变化,3层之后变化没有很明显,由于实验时间以及效率问题,最终选择了三层作为最优修饰层数。由于p H对于检测BPA的影响较大,对于p H进行了优化,p H=7.0时,峰电流最高,所以选择了p H=7的磷酸盐缓冲液。在p H=7.0的BPA缓冲溶液中用扫描速率为100 m V·s-1电化学测定,在4×10-6~1×10-4mol·L-1区间内,峰电流和双酚A浓度具有良好线性曲线Ip=3.933 11+0.307 16c(R2=0.993 8),检出限为1.75×10-8mol·L-1。在最优条件下测定4次,其重现性良好相对偏差为4.2%。在检测其他物质对双酚A测定的干扰,发现Mg+、Cl-、K+、、Na+、离子以及对硝基酚对检测干扰较小。
在对矿泉水的测定中,回收率为91.0%~99.4%,具有比较好的回收率。该方法成本低,检测速度快,灵敏度高,对双酚A在电化学上的检测研究意义重大。
