Xp11.2易位/TFE3基因融合相关性肾癌3例临床病理学分析
2021-04-09翟晓茜吴开祥张树鹏
翟晓茜 吴开祥 张树鹏
山东第一医科大学第二附属医院病理科,山东 泰安 271000
Xp11.2易位/TFE3基因融合相关性肾癌恶性程度较高,临床罕见,主要发生于青少年,其在预后、治疗、分子遗传学等方面均显著异于其他肾细胞癌。Xp11.2肾细胞癌的发病机制为Xp11.2肾细胞癌的基因组具有Xp11.2位点平衡易位,形成TFE3融合基因,导致TFE3蛋白过表达,影响对转录调节的干扰作用,促进肿瘤形成[1]。本研究选择2016—2019年在本院明确诊断的3例Xp11.2易位/TFE3基因融合相关性肾癌,观察Xp11.2易位/TFE3基因融合相关性肾癌的临床病理特征和预后转归,现报道如下。
1 资料和方法
1.1 临床资料
收集2016—2019年在本院明确诊断的3例Xp11.2易位/TFE3基因融合相关性肾癌病例3例,均为男性。
1.2 方法
标本经10%中性福尔马林固定,石蜡包埋,切片厚3~4 μm,组织常规HE染色及免疫组织化学染色,光镜观察。免疫组织化学染色采用EnVision两步法,检测抗体包括肾细胞癌标记(RCC)、上皮性钙粘附蛋白(E-cad)波形蛋白(Vimentine)、细胞角蛋白7(CK7)、黑色素瘤(HMB45)、黑色素-A(Melan-A)、CD10、TFE3、Ki-67及CD117,均购于福州迈新生物技术开发有限公司。
1.3 免疫组化结果评估标准
TFE3、Ki-67在细胞核内表达,阳性细胞为棕黄色细胞核染色;E-cad、CD10在细胞膜上表达,阳性细胞为棕黄色细胞膜染色;CD117、Melan-A、HMB45、RCC 、Vimentin、CK7在细胞质表达,阳性细胞为细胞质内出现棕黄色颗粒。
2 结 果
2.1 临床资料特征
病例1,男,45岁,因查体发现左肾占位入院,查体一般状况可,CT检查发现左肾上极椭圆形等密度影,大小约35 mm×28 mm×28 mm,边界尚清晰。增强后皮质期、髓质期呈不均匀强化,排泄期强化减低。后行后腹腔镜下左肾部分切除术。
病例2,男,68岁,因无痛性肉眼血尿20天余入院,查体一般状况可,CT检查发现右肾实质内可见类圆形混杂密度肿块影,局部向肾窦内生长,病灶大小约60 mm×54 mm×69 mm,后行经后腹腔镜根治性右肾切除术。
病例3,男,62岁,因查体发现左肾占位入院,CT检查发现左肾下极实质内类圆形异常信号影,边界清晰,大小约35 mm×35 mm×42 mm,病灶部分突出于肾轮廓之外(图1),后行后腹腔镜下左肾部分切除术。
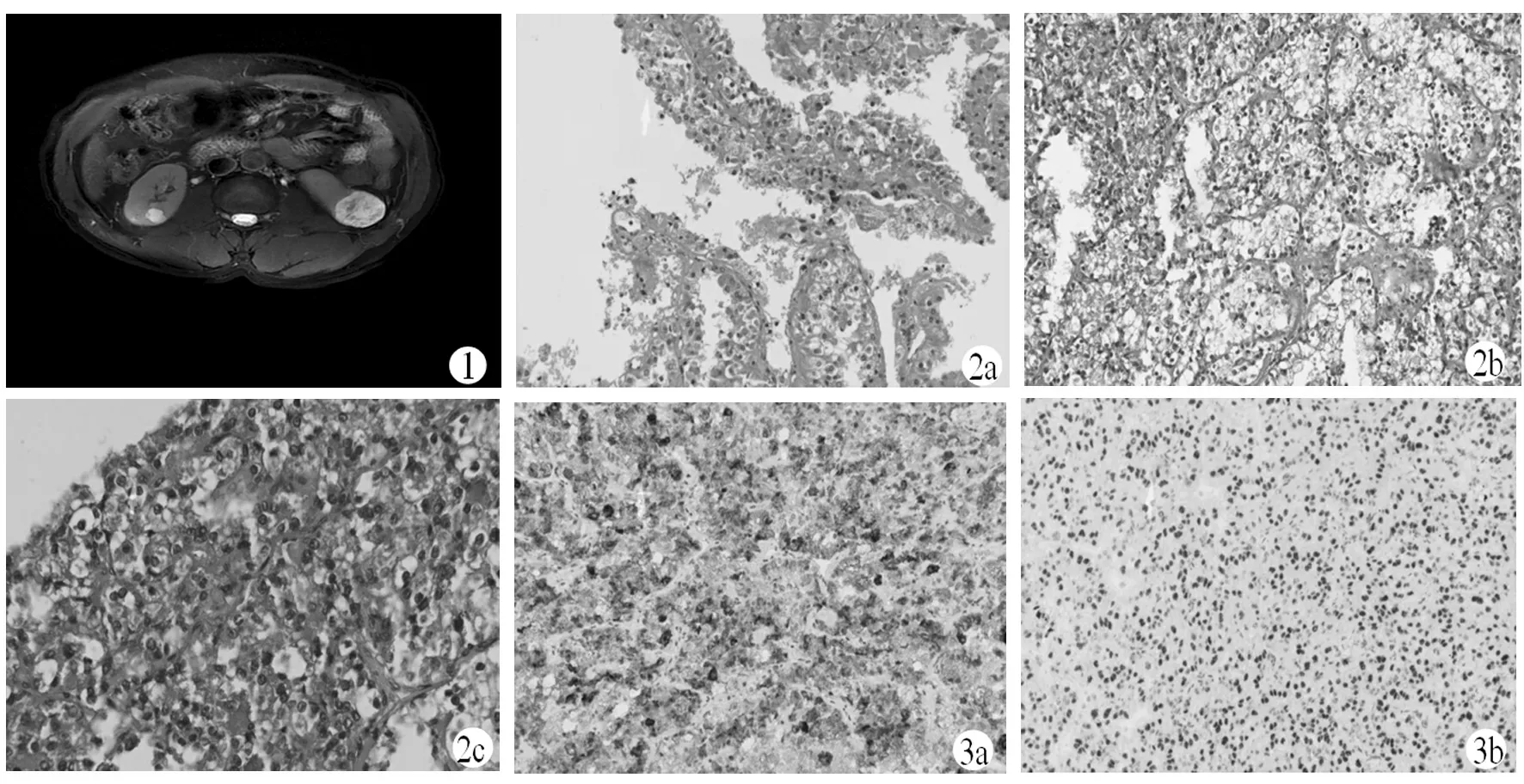
图1 病例CT影像学检查图像(T2WI-1呈高信号,内见多发低信号分隔);图2 肿瘤细胞HE染色(a.肿瘤细胞排列成乳头状,×100;b.肿瘤细胞呈上皮样,胞浆透明,×200;c.肿瘤细胞胞浆内含有黑色素颗粒,×200 );图3 Xp11.2易位/TFE3基因融合相关性肾癌免疫组化表现(a.肿瘤细胞Melan-A阳性,EnVision法×200;b.肿瘤细胞TFE3阳性,EnVision法×200)
2.2 巨检
肿瘤边界不清或尚清,左肾上极1例,下极1例,右肾1例;肿瘤呈圆形,直径3.2~5.0 cm,平均直径4 cm;肿块切开切面为灰黄或灰红色,大体标本呈实性,部分区域出现出血。1例大体标本为囊实性,假包膜不完整,出现坏死及出血区域,囊腔内为清亮暗红色液体,囊壁稍增厚。
2.3 镜检
肿物与邻近正常肾组织边界清晰,邻近出现残余肾小管和肾小球结构;瘤细胞为腺泡状、巢状、乳头状生长方式;腺泡状结构的瘤细胞内胞质为嗜酸性或透明,腺泡腔内出现出血;巢状结构内细胞胞质为淡嗜酸性或透明性;乳头状结构可见纤细的纤维血管轴心;肿瘤细胞间质纤维化,出现局灶性泡沫细胞集聚、炎细胞浸润;肿瘤细胞和间质内出现砂砾体,数量不等,呈散在或弥漫性分布,高倍下,细胞未见分裂像,可见核仁,居中,核圆。见图2。
2.4 免疫组化
3例肿瘤细胞TFE3、vimentin均呈弥漫性阳性,HMB45、Melan-A、CD10、RCC、E-cad不同程度阳性, CD117、CK7均为阴性,Ki67阳性率平均10%。见图3。
2.5 随访情况
病例1术后行白介素2免疫治疗,随访至今,预后良好。病例2术后行白介素2免疫治疗,16个月后出现肺部转移,后服用靶向药物舒尼替尼,2个月后出现鼻出血,后诊断为获得性血友病A,后无随访。病例3出院后无随访。
3 讨 论
MiT家族易位性肾细胞癌是2016版WHO 肾脏细胞肿瘤的新分类,它首次提出了小眼畸形转录因子(microphthalmia-associated transcription factor,MiT)家族,该家族编码4个不同的基因,分别为MiTF、TFEB、TFE3和TFEC,其中TFE3或TFEB的基因融合是引发MiT家族易位性肾细胞癌和腺泡状软组织肉瘤的根源[1]。根据2016版WHO解析,MiT家族易位性肾细胞癌目前包含Xp11易位性肾细胞癌和t(6;11)易位性肾细胞癌,两者均可发生TFE3或TFEB的基因融合,其中最常见的是Xp11.2易位/TFE-3 基因融合相关性肾癌[2]。
3.1 临床特点
目前,MIT家族易位性肾细胞癌的病因学研究较少,其发病机制尚不清楚,由于化疗引起的细胞毒性是唯一已知的高危因素。研究发现,高达15%的Xp11.2易位性肾细胞癌患者有行化疗的病史[3],相关研究表明 Xp11.2易位性肾细胞癌在化疗后 2 年内发生者最为常见[4]。Xp11.2易位性肾细胞癌好发于儿童,其发病率约占40%,成人的发病率约占1.6-4%,且好发于青年人,平均年龄为31岁[5]。与Xp11.2易位性肾细胞癌相比,t(6;11)易位性肾细胞癌不太常见;全世界文献中仅报道约50例[6]。
3.2 组织学特征
MiT家族易位性肾细胞癌没有很特殊的大体外观,与透明细胞性肾癌类似,多为孤立性肿瘤,呈膨胀性生长,有厚的纤维包膜,切面常显示灰黄色,也可呈灰红灰褐,可有出血、坏死、囊性变等[7]。其中Xp11.2易位性肾细胞癌最具特征性的的组织学类型是上皮样透明细胞组成的乳头状肿瘤,具有丰富的砂砾体[8]。Xp11.2易位性肾细胞癌组织学特点也可与其他肾细胞肿瘤相似,包括低恶性潜能的多房囊性肾肿瘤、透明细胞性肾癌、乳头状肾癌等[8]。有些Xp11.2易位性肾细胞癌含有黑色素,可与TFE3重排的血管周上皮样细胞肿瘤有相似的组织学结构[9]。然而,t(6:11)易位性肾细胞癌的组织学类型是两种肿瘤细胞形态,大的肿瘤细胞呈上皮样,胞浆淡红色、透亮,界限清楚,小的肿瘤细胞常围绕在基底膜样物周围排列成假菊形团样结构,肿瘤细胞呈巢团状或腺泡状生长方式[10]。
3.3 免疫表型
与大多数肾细胞癌不同的是,MIT家族易位性肾细胞癌欠缺细胞角蛋白(CK)和上皮膜抗原(EMA)等上皮标志物的表达,但它们恒定表达PAX8,RCC等肾小管来源标记。其中t(6;11)易位性肾细胞癌常表达黑色素标记物MelanA和HMB45,而只有部分Xp11.2易位性肾细胞癌表达这两项黑色素细胞标记[11]。TFE3免疫组化核强阳性对Xp11.2易位性肾细胞癌具有高度敏感性和特异性[12]。同样,TFEB免疫组化核强阳性对t(6;11)易位性肾细胞癌具有高度敏感性和特异性[11]。本组病例中,TFE3、vimentin均呈弥漫性阳性,HMB45、Melan-A 、CD10、RCC、E-cad不同程度阳性, CD117、CK7均为阴性,符合Xp11.2易位/TFE3基因融合相关性肾癌的免疫表型,这与国内相关学者的报道相似[13]。
3.4 预后
Xp11.2易位性肾细胞癌患者的存活率与透明细胞性肾细胞癌患者相似,预后较好,但均比透明细胞乳头状肾细胞癌患者预后差。有关研究表明,与儿童患者相比,成年患者且伴有远处转移者预后较差,术后生存时间约2年[14]。 然而,t(6;11)易位性肾癌通常比Xp11.2易位肾癌更具有惰性[15]。 总之,MiT家族易位性肾细胞癌肿瘤细胞增殖指数较低,有可能在诊断后20或30年后才发生晚期转移。鉴于国内对MiT家族易位性肾细胞癌报道较少,其发病机制、临床特征及预后值得进一步研究和探讨。
