用软锰矿渣陶粒从废水中吸附去除Ni2+
2021-04-08张钰珏丁桑岚孙维义苏仕军
张钰珏,鄢 然,丁桑岚,孙维义,苏仕军
(四川大学 建筑与环境学院,四川 成都 610065)
从废水中去除Ni+有多种方法[1-6],吸附法因材料易得价廉、处理效果好而被广泛应用[7-8]。软锰矿渣是软锰矿经二氧化硫浸出、回收锰之后得到的固体废渣,其主要成分为SiO2、Al2O3和Fe2O3[9]。将软锰矿脱硫尾渣、粉煤灰及活性炭混合并在高温下焙烧可制备陶粒,这种陶粒可用于从废水中吸附去除铅离子[10]。目前,这种陶粒吸附去除铅离子的热力学和动力学特性并未有深入研究,从废水中吸附去除Ni2+的性能也未见报道。
试验研究了用焙烧软锰矿渣所得陶粒从废水中吸附去除Ni2+,并探讨其吸附过程的动力学和热力学,旨在明确陶粒对Ni2+的吸附特性,为软锰矿渣的资源化利用提供技术参考。
1 试验部分
1.1 软锰矿渣陶粒的制备
以软锰矿渣作骨料,粉煤灰作助溶剂,活性炭作造孔剂,水为黏结剂,控制物料配比为40%粉煤灰+5%活性炭+55%软锰矿渣,干燥时间及温度控制在2 h、105 ℃,然后在400 ℃下预热20 min,并在1 050 ℃下焙烧5 min[10]。
1.2 试验材料
试验所用软锰矿渣为在JBR反应器中与SO2反应后的软锰矿浆离心脱水后的渣,干燥研磨过100目筛;粉煤灰取自四川某燃煤电厂,过100目筛;颗粒活性炭由科隆精细化工提供,研磨过100目筛。
室温下,用硝酸镍和去离子水在1 L容量瓶中配制初始浓度1 mol/L的硝酸镍溶液(模拟废水),试验时按要求稀释。吸附试验以360 min为一批次。
硝酸镍,氢氧化钠,硝酸,丁二酮肟,过硫酸铵,均为分析纯。
1.3 试验仪器及设备
JJ-1型精密增力电动搅拌器,DK-98-ⅡA型电热恒温水浴锅,101-2AB型电热鼓风干燥箱,PHS-3C型雷磁pH计,SX-G12123型马弗炉,SX-G12123型节能箱式电炉。
1.4 陶粒吸附Ni2+
吸附试验在锥形瓶中进行。锥形瓶中加入一定量陶粒和500 mL模拟废水。调废水pH后将锥形瓶置于恒温水浴锅中搅拌,每隔一段时间取样1次至反应平衡。分析所取水样中Ni2+质量浓度,计算Ni2+吸附去除率。利用试验数据拟合Langmuir、Freundlich等温吸附模型及准一级、准二级、颗粒内扩散动力学模型,并通过计算热力学参数探讨陶粒对Ni2+的吸附性能及作用机制。
Ni2+吸附去除率及陶粒对Ni2+的吸附量计算公式分别为:
(1)
(2)
式中:ρ0—模拟废水Ni2+初始质量浓度,mg/L;ρe—模拟废水瞬时Ni2+质量浓度,mg/L;η—Ni2+吸附去除率,%;V—模拟废水体积,mL;m—陶粒质量,g;qe—吸附平衡时陶粒对Ni2+的吸附量,mg/g。
2 试验结果与讨论
2.1 陶粒对Ni2+的吸附性能
2.1.1 陶粒投加量对吸附的影响
温度20℃,模拟废水中Ni2+初始质量浓度40 mg/L,溶液初始pH=6.0,吸附时间6 h,陶粒投加量对陶粒吸附去除Ni2+的影响试验结果如图1所示。
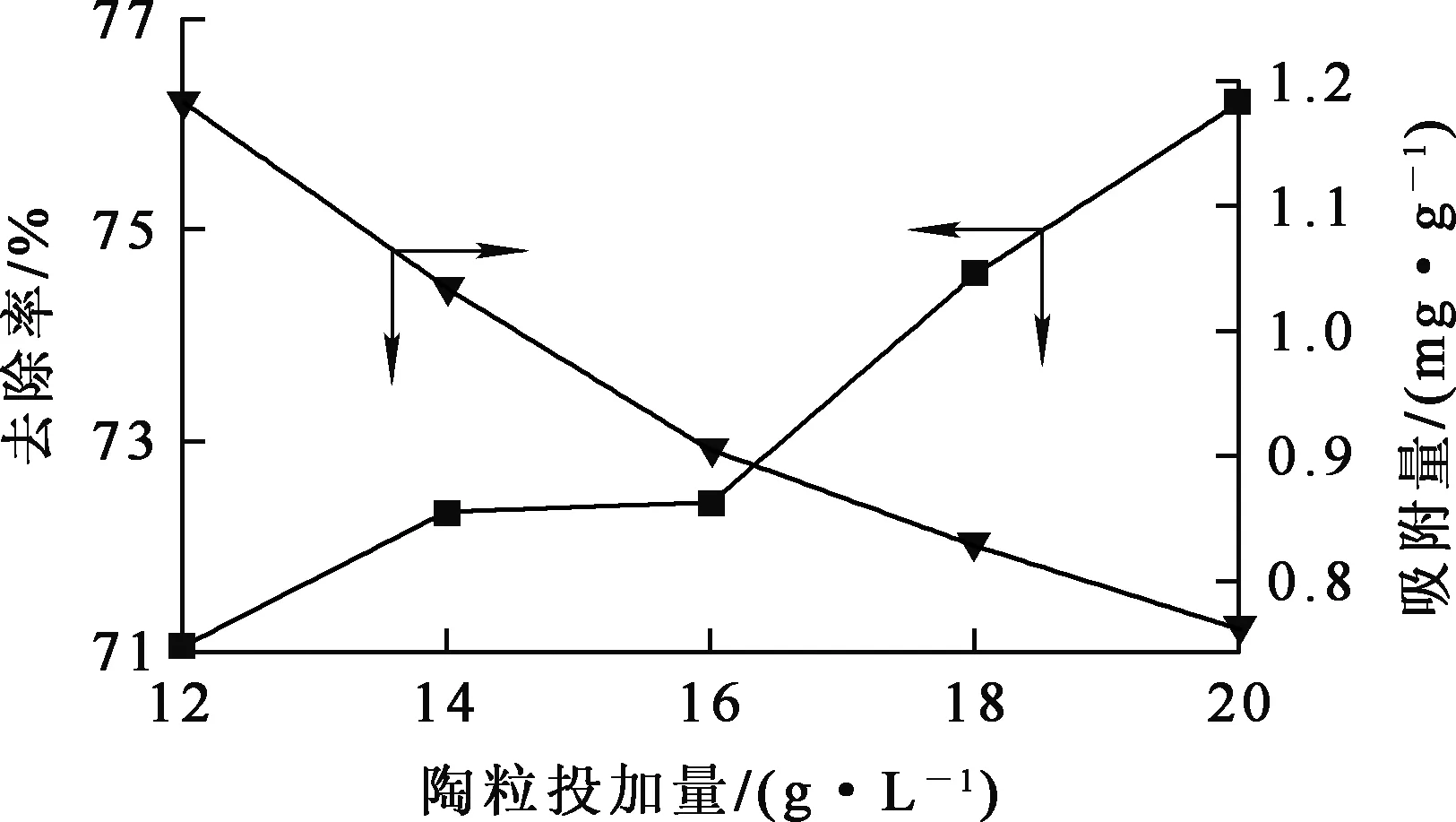
图1 陶粒投加量对陶粒吸附去除Ni2+的影响
由图1看出,随陶粒投加量增加,Ni2+去除率提高,单位陶粒对Ni2+吸附量降低。废水中Ni2+浓度一定时,加大陶粒投加量,即增大不饱和吸附位点,Ni2+去除率升高[11],溶液中Ni2+浓度降低。根据吸附平衡原理,陶粒对于Ni2+的吸附量也随之降低,陶粒表面活性点位不能被充分利用,造成浪费。综合考虑,确定陶粒投加量以18 g/L为宜。
2.1.2 溶液初始pH对吸附的影响
陶粒投加量18 g/L,温度20 ℃,溶液初始pH=6.0, 吸附时间6 h,模拟废水中Ni2+初始质量浓度40 mg/L,用0.5 mol/L硫酸和0.5 mol/L氢氧化钠溶液调模拟废水pH,考察溶液初始pH对陶粒吸附去除Ni2+的影响。试验结果如图2所示。
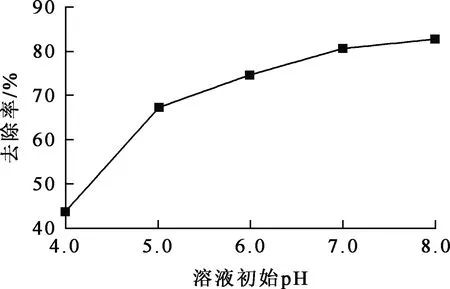
图2 溶液初始pH对陶粒吸附去除Ni2+的影响
由图2看出,Ni2+去除率随废水pH升高而提高。pH较低时,溶液中的H+较多,陶粒官能团质子化明显,对Ni2+的吸引力较低,使得Ni2+吸附去除率较低[12-13]。随溶液pH升高,溶液中H+浓度降低,陶粒官能团质子化程度减弱,对Ni2+的吸附能力增强,Ni2+去除率随之提高,此时,Ni2+也会向Ni(OH)2转化,Ni(OH)2的形成也有利于提高Ni2+去除率。但是,吸附和沉淀作用共存使得Ni2+去除过程变得复杂,难以获得吸附去除Ni2+的真实规律[14]。因此,为避免由于Ni2+沉淀而造成的吸附去除率偏差,后续试验均在pH=6.0条件下进行。
2.1.3 Ni2+初始质量浓度对吸附的影响
陶粒投加量18 g/L,温度20 ℃,废水pH=6.0,吸附时间6 h,Ni2+初始质量浓度对陶粒吸附去除Ni2+的影响试验结果如图3所示。

图3 Ni2+初始质量浓度对陶粒吸附去除Ni2+的影响
由图3看出:随Ni2+初始质量浓度增大,Ni2+去除率呈下降趋势;Ni2+初始质量浓度为40 mg/L 左右时,Ni2+去除效果最好,去除率为74.59%左右。Ni2+质量浓度较低时,溶液中离子相互之间的作用较弱,Ni2+质量浓度变化对吸附率的影响较小;而Ni2+质量浓度升高后,抑制其从本体溶液向陶粒表面迁移的传质阻力的驱动力增大,陶粒吸附能力相对减弱[13,15]。根据吸附平衡原理,溶液中Ni2+质量浓度升高使平衡吸附量增大,但溶液中残留的Ni2+质量浓度也随之升高,导致Ni2+去除率下降。
2.1.4 温度对吸附的影响
其他条件不变,温度对陶粒吸附去除Ni2+的影响试验结果如图4所示。
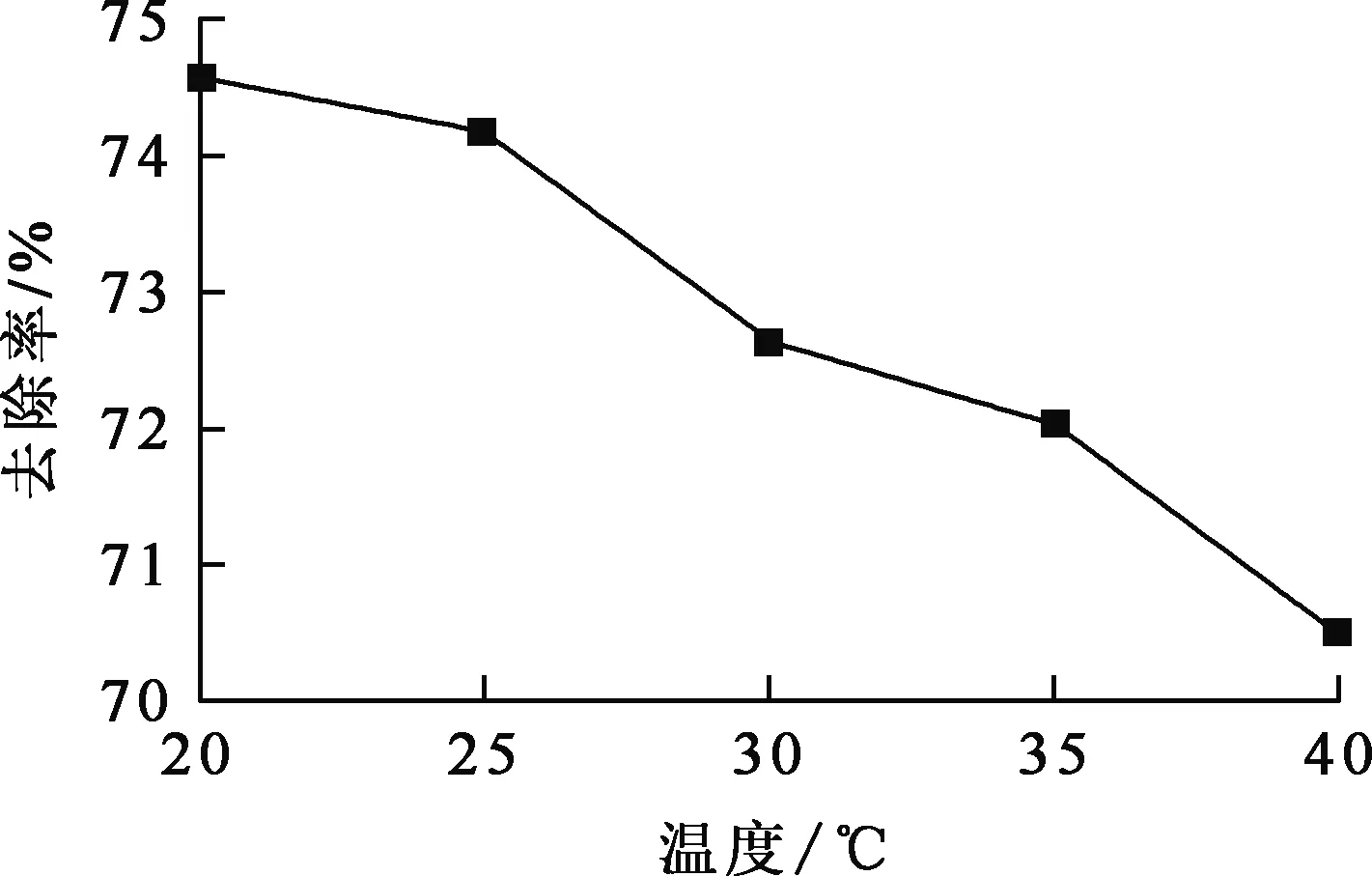
图4 温度对陶粒吸附去除Ni2+的影响
由图4看出:在20~40 ℃范围内,随温度升高,Ni2+吸附去除率逐渐降低;温度为20 ℃时,Ni2+吸附去除率较高,为74.59%。这可能是随温度升高,被吸附的Ni2+又脱附下来[16]所致。综合考虑,确定适宜温度为20 ℃。
2.2 吸附反应热力学
2.2.1 吸附等温线
Freundlich等温吸附式为
(3)
Langmuir等温吸附式为
(4)
式中:t—吸附时间,min;qe—平衡吸附量,mg/g;ρe—吸附平衡时溶液中Ni2+质量浓度,mg/L;qm—最大吸附量,mg/g;kF—Freundlich等温吸附常数,L/g;kL—Langmuir温吸附常数,L/mg;1/n—常数。
软锰矿渣陶粒对Ni2+的等温吸附模型拟合曲线如图5所示,拟合参数见表1。可以看出:不同温度下,陶粒吸附Ni2+的Freundlich和Langmuir方程的拟合系数均大于0.92,表明这2种模型均能很好描述吸附行为;Langmuir方程的拟合系数更高,在0.996以上,表明吸附属于单层吸附。
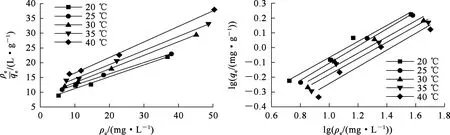
a—Freundlich;b—Langmuir。图5 陶粒对Ni2+的等温吸附模型时的合曲线
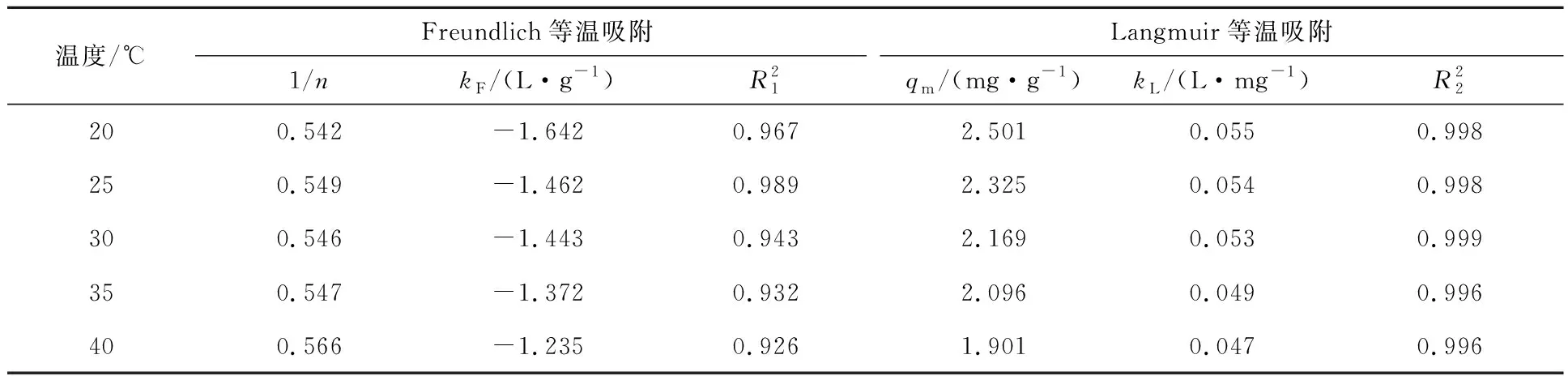
表1 陶粒吸附Ni2+的吸附等温方程参数
2.2.2 吸附反应热力学
热力学主要参数为熵(ΔS0)、焓(ΔH0)和吉布斯自由能(ΔG0),计算公式如下:
(5)
(6)
ΔG0=ΔH0-T·ΔS0。
(7)
式中:ρe—吸附平衡时Ni2+质量浓度,mg/L;qt—吸附t时间时的吸附量,mg/g;ρe—吸附平衡时的吸附量,mg/g;ρt—吸附t时间时Ni2+质量浓度,mg/L;T—热力学温度,K。
以lnkd为纵坐标,1/T为横坐标绘图,结果为一条直线(图6),ΔH0、ΔS0可通过此直线斜率和截距得到[17]。由表2看出:ΔG0>0,ΔH0<0,表明反应为非自发放热反应,升高温度不利于吸附反应进行;ΔS0<0,符合吸附交换理论[18]。
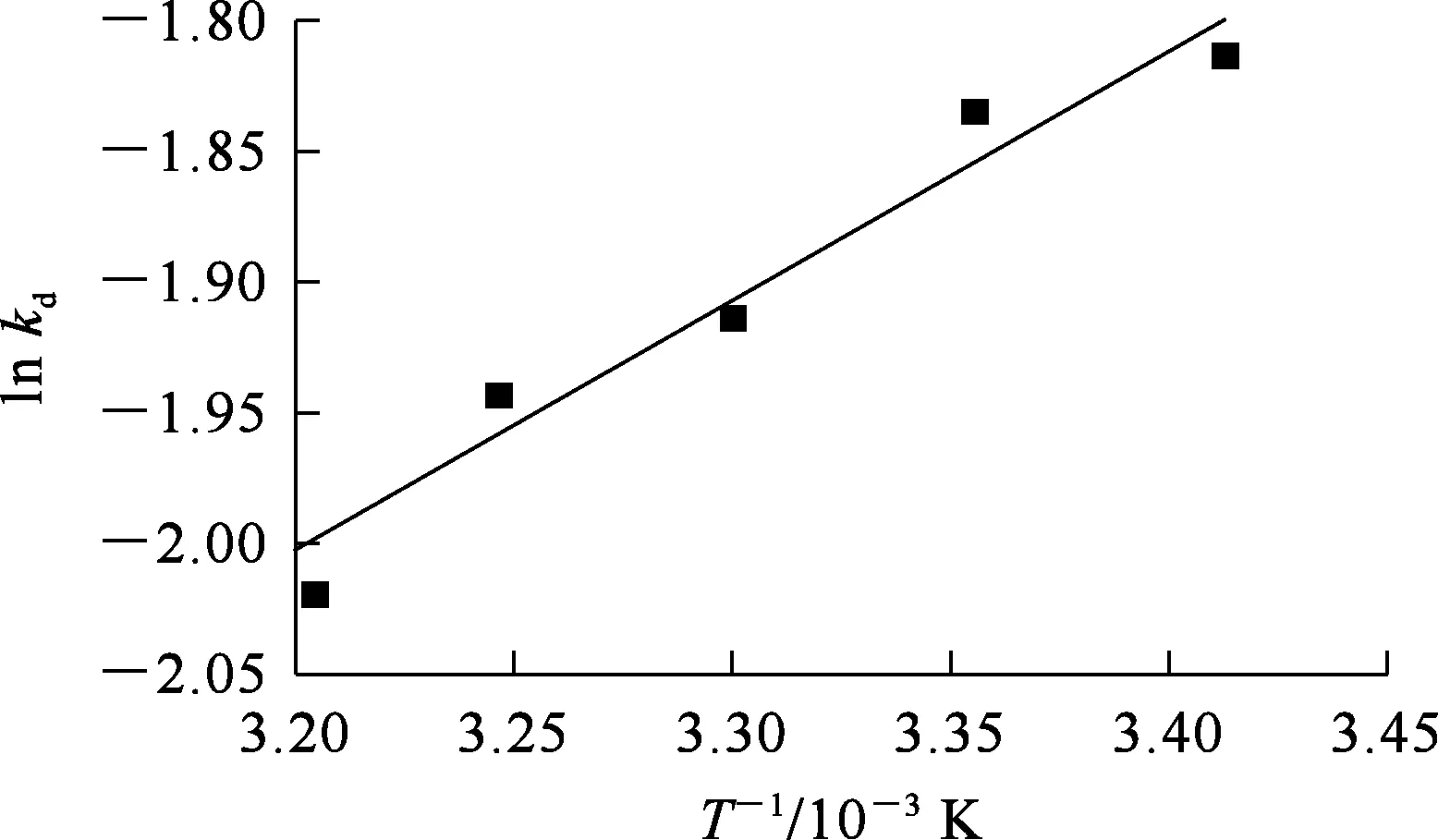
图6 陶粒对Ni2+的吸附热力学拟合曲线

表2 陶粒对Ni2+的吸附反应热力学参数
2.3 吸附反应动力学
准一级动力学方程,
(8)
准二级动力学方程,
(9)
颗粒内扩散方程,
qt=kpt1/2+c。
(10)
式中:t—吸附时间,min;qt—吸附t时间时的吸附量,mg/g;qe—吸附平衡时的吸附量,mg/g;k1—准一级动力学常数,min-1;k2—准二级动力学常数,g/(mg·min);kp—颗粒内扩散为常数,g/(mg·min1/2);c—无量纲常数。
针对不同Ni2+初始质量浓度的模拟废水,陶粒对Ni2+的吸附反应的准一级动力学、准二级动力学及颗粒内扩散模型拟合结果如图7所示,拟合参数见表3、4。由图7看出:图7(a)、7(b)拟合曲线均显示为线性关系,但准二级方程的相关系数略大于准一级方程的相关系数,表明准二级方程能更好地描述陶粒对Ni2+的吸附动力学行为。表3中,准二级方程的平衡吸附量与试验值相差不大,表明准二级动力学模型能够较真实地反映Ni2+在陶粒上的吸附行为。
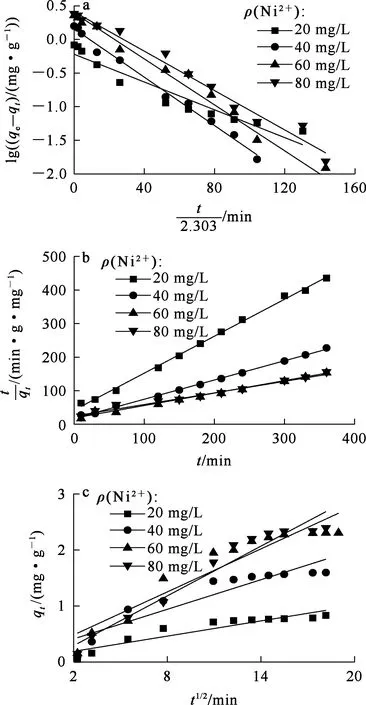
a—准一级动力学模型;b—准二级动力学模型;c—颗粒内扩散模型。图7 陶粒对Ni2+的吸附动力学模型拟合曲线
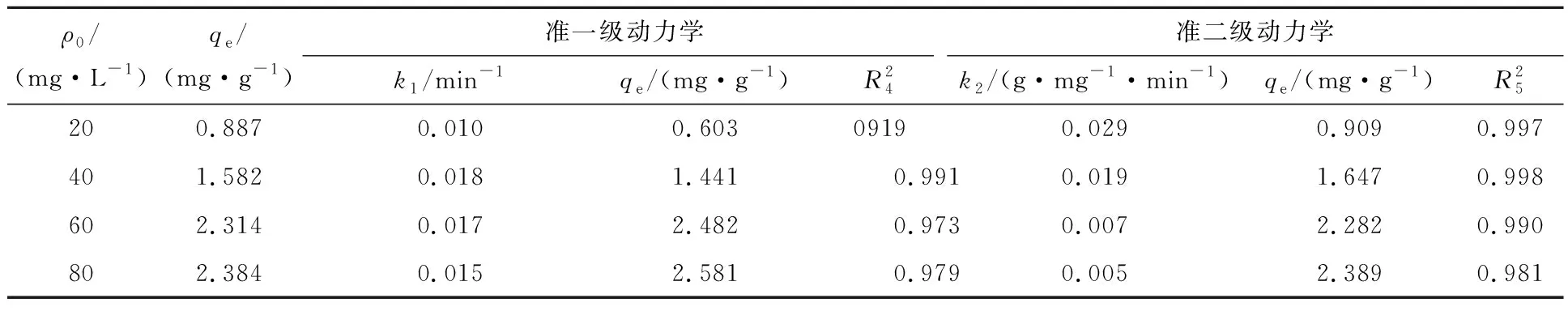
表3 陶粒对Ni2+的吸附动力学拟合参数

表4 陶粒吸附Ni2+的颗粒内扩散模型参数
2.4 陶粒的再生
根据溶液pH降低、Ni2+吸附量下降的特性,用硝酸溶液进行解吸[19]。陶粒在最优条件下饱和吸附Ni2+后静置去除上清液并烘干,分别用不同浓度硝酸溶液解吸2 h,之后用去离子水清洗至中性;然后再用于从模拟废水中吸附Ni2+,如此循环。根据Ni2+去除率判断陶粒的解吸再生性能。
由图8看出:随硝酸浓度增大,再生后的陶粒对Ni2+的吸附去除率逐渐提高,硝酸浓度为2.0 mol/L 时,陶粒基本恢复到使用前的状态。与硝酸溶液接触后,陶粒表面结合大量H+,表面吸附平衡被打破,吸附的Ni2+发生脱落,陶粒恢复一定吸附能力。用2.0 mol/L硝酸溶液解吸,陶粒经4次吸附、解吸循环后,吸附率有所下降,但仍保持在65%以上(图9),表明陶粒的再生性能较好,可多次重复利用。
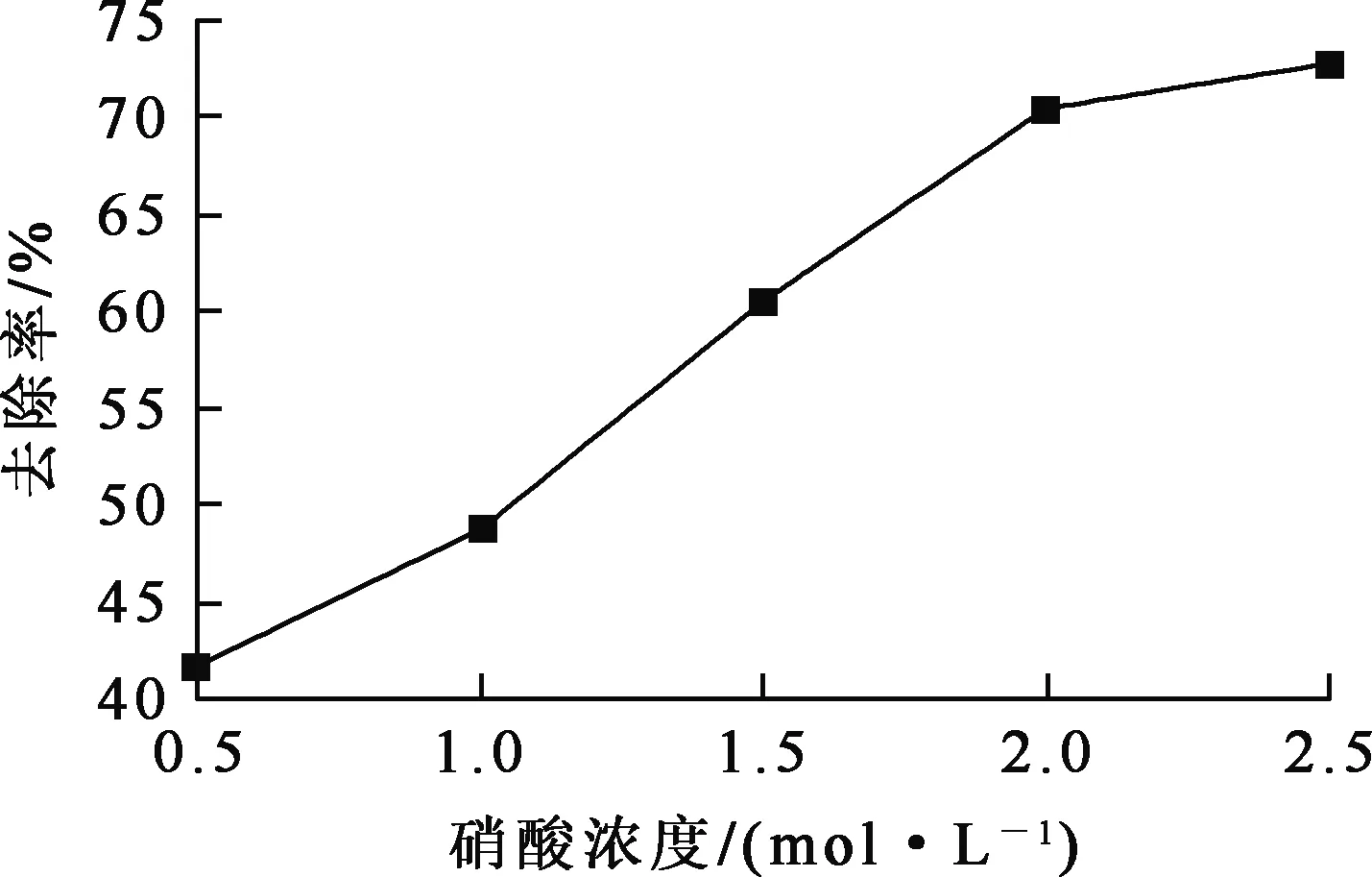
图8 硝酸浓度对陶粒再生的影响
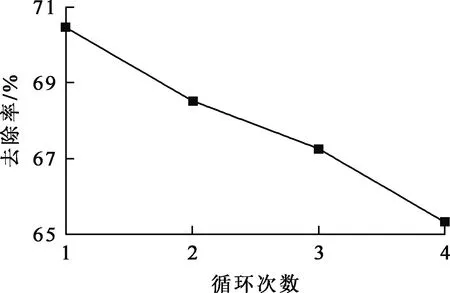
图9 吸附、解吸循环次数对陶粒吸附去除Ni2+的影响
3 结论
用软锰矿渣作骨料,粉煤灰作助溶剂,活性炭作造孔剂,水作黏结剂,可获得软锰矿渣陶粒。用此陶粒从废水中吸附去除Ni2+,适宜条件下,对Ni2+的吸附去除率可达74.59%。
陶粒对Ni2+的吸附行为更符合Langmuir等温吸附模型,吸附反应属于单层吸附。吸附过程符合准二级动力学方程,反应为非自发放热反应,升高温度不利于吸附反应进行。
吸附了Ni2+的陶粒可用硝酸溶液再生,实现重复利用。
