从风化壳淋积型稀土矿除杂渣中酸浸稀土和铝
2021-04-08何正艳林展同聂文蕊常丽嘉徐志高池汝安
何正艳,林展同,左 琴,周 洁,聂文蕊,常丽嘉,徐志高,池汝安
(1.中南民族大学 催化材料科学国家民委教育部重点实验室,湖北 武汉 430074;2.武汉工程大学 绿色化工过程教育部重点实验室,湖北 武汉 430073)
风化壳淋积型稀土矿中的稀土主要以水合或羟基水合离子形式吸附在黏土矿物表面,故利用电解质溶液,以离子交换方式便可轻易将稀土从固相转移到液相,然后进一步回收[1-2]。但浸出过程中,除稀土外,矿石中的铝、铁、镁、钙等也会一起被浸出到溶液中[3-4]。这些杂质离子的存在会影响后续稀土沉淀物的纯度,也会加大沉淀剂用量,并影响晶型碳酸稀土沉淀的形成,故必须在沉淀稀土之前,对浸出液进行除杂处理[5-6]。通常用碳酸氢铵调节浸出液pH至5.0~5.5,使铝、铁等杂质离子水解形成氢氧化物沉淀,而此条件下稀土不沉淀,通过固液分离可获得稀土溶液和沉淀物,实现杂质离子分离[7-8]。该沉淀物即除杂渣,其中含氢氧化铝20%~50%,碳酸稀土2%~6%;稀土含量远高于天然矿石中的含量,且易溶于酸,回收难度和成本也远低于天然矿石[9]。
试验研究了用盐酸处理含稀土固体除杂渣,并进一步优化稀土和铝的酸浸条件。
1 试验部分
1.1 试验原料
除杂渣取自江西定南某风化壳淋积型稀土矿加工厂,主要化学组成见表1,其中稀土(REO)质量分数约3.12%,Al2O3质量分数约29.01%。
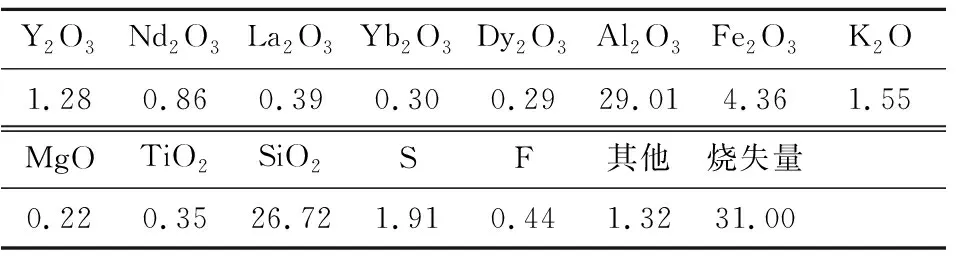
表1 除杂渣的主要化学组成 %
除杂渣中的稀土有15种,逐个分析过于繁冗重复,试验仅选择占比较大的Y3+和La3+为重稀土和轻稀土代表,探索稀土酸浸规律,确定酸浸最佳工艺参数。同时,考察盐酸对主要杂质离子Fe3+、K+、Mg2+的浸出效果,尽可能减少杂质离子浸出,进一步优化稀土和铝的浸出条件。
1.2 试验原理及方法
除杂渣中稀土以碳酸盐形式存在,铝以氢氧化物形式存在,二者均可用酸从固相溶解入液相,再通过分步沉淀法分步回收。常用的无机酸有硝酸、盐酸和硫酸。硝酸价格较高且氧化性较强,对设备要求较高;而氯化稀土的溶解度大于硫酸稀土的溶解度,且盐酸较硫酸能更有效地溶解稀土,因此选择盐酸作为浸出剂更合适。
盐酸从除杂渣中浸出稀土和铝的反应式为:

(1)

(2)
碳酸氢铵从酸浸液中分步沉淀稀土和铝的化学反应式为:

(3)
(4)
高温煅烧反应式为:

(5)

(6)
除杂渣与盐酸溶液混合后置于恒温水浴锅中,在300 r/min速度下搅拌浸出。浸出结束后冷却至室温,用注射器抽取部分上层溶液,滤膜过滤后,用电感耦合等离子体质谱仪分析其中各元素质量浓度,并计算浸出率。所有酸浸试验至少重复3次,所得浸出率取平均值。
2 试验结果与讨论
2.1 盐酸浓度对各元素浸出的影响
在液固体积质量比10/1、浸出温度40 ℃、浸出时间30 min条件下,盐酸浓度对各元素浸出率的影响试验结果如图1所示。可以看出,随盐酸浓度增大,各元素浸出率均提高,达到最大值后保持平衡。盐酸浓度越大,与除杂渣中各物质反应的H+越多,反应越完全[10];但盐酸浓度进一步增大至H+相对过量,酸溶性物质已完全溶解进入溶液,浸出率不再提高[11]。盐酸浓度为1 mol/L时:稀土和铝基本浸出完全;K+最大浸出率较低,不高于10%;但Fe3+、Mg2+浸出率变化幅度较大。盐酸浓度从0.5 mol/L增至6 mol/L, Fe3+浸出率从1.74%提高到61.59%。盐酸浓度进一步增大,会显著提高杂质离子浸出率,不利于后期稀土和铝的回收及提纯。此外,盐酸浓度越大,其挥发性和腐蚀性越强,不利于生产,综合考虑,确定适宜盐酸浓度为1 mol/L。相同条件下,稀土浸出率一直高于铝浸出率,这可能是稀土离子在溶液中稳定存在的pH范围更宽的缘故,pH小于7.9即可,而铝则要求pH小于3.5[12]。
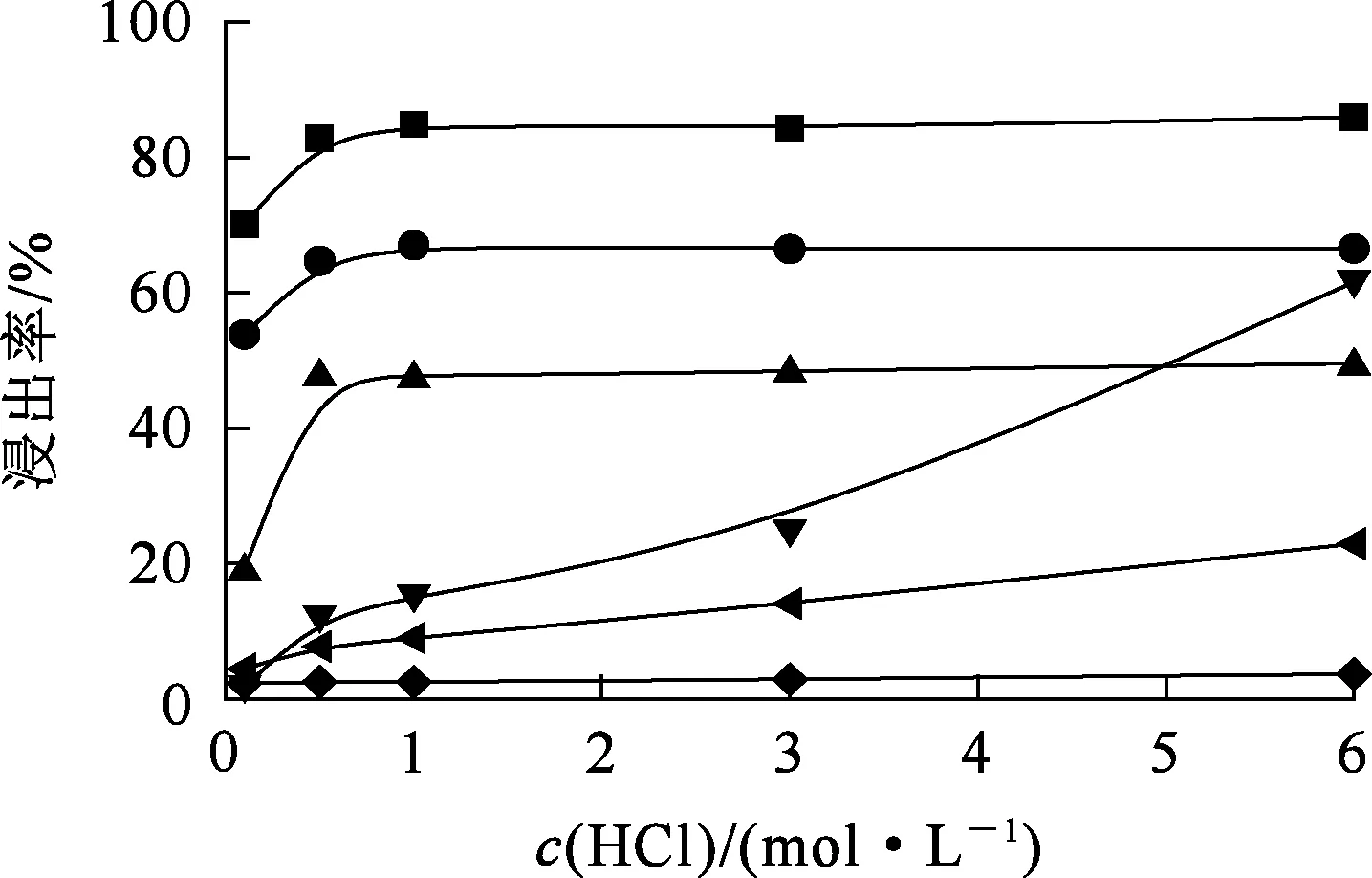
—■—La3+;—●—Y3+;—▲—Al3+;—▼—Fe3+;—◀—Mg2+;—◆—K+。图1 盐酸浓度对各元素浸出率的影响
2.2 浸出温度对各元素浸出的影响
在液固体积质量比10/1、浸出时间30 min条件下,浸出温度对各元素浸出率的影响试验结果如图2所示。
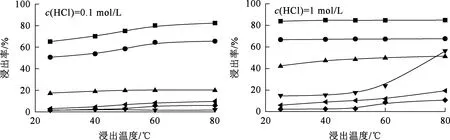
—■—La3+;—●—Y3+;—▲—Al3+;—▼—Fe3+;—◀—Mg2+;—◆—K+。图2 浸出温度对各元素浸出率的影响
由图2看出,温度升高有助于各物质的浸出。温度越高,离子热运动越快,扩散性越强,即H+从溶液中扩散到除杂渣颗粒表面的速度与金属离子从除杂渣扩散到溶液中的速度均增大,浸出速度加快,浸出率提高[13]。对于稀土的浸出:当盐酸浓度较低,为0.1 mol/L时,温度对其影响较大,随温度升高,La3+浸出率从65.21%提高至85.00%,Y3+浸出率从50.65%提高至66.10%;但随盐酸浓度增大,温度对浸出的影响减弱,HCl浓度为1 mol/L时,升温对浸出基本无影响。对于Al3+和杂质离子(Fe3+、K+、Mg2+)的浸出:盐酸浓度较低时,温度对浸出影响较小;随HCl浓度增大,温度的影响有增大趋势;对Fe3+浸出的影响最明显,HCl浓度为0.1 mol/L时,Fe3+浸出率随温度升高几乎不变;HCl浓度为1 mol/L时,Fe3+浸出率随温度升高,从14.55%提高至56.11%。由此看来:升温对稀土和铝浸出的影响要弱于对杂质离子浸出的影响;温度过高,会加剧HCl挥发,不利于生产和环保。综合考虑,确定40 ℃为浸出适宜温度。
2.3 液固体积质量比对各元素浸出的影响
在盐酸浓度1 mol/L、浸出温度40 ℃、浸出时间30 min条件下,液固体积质量比对各元素浸出的影响试验结果如图3所示。
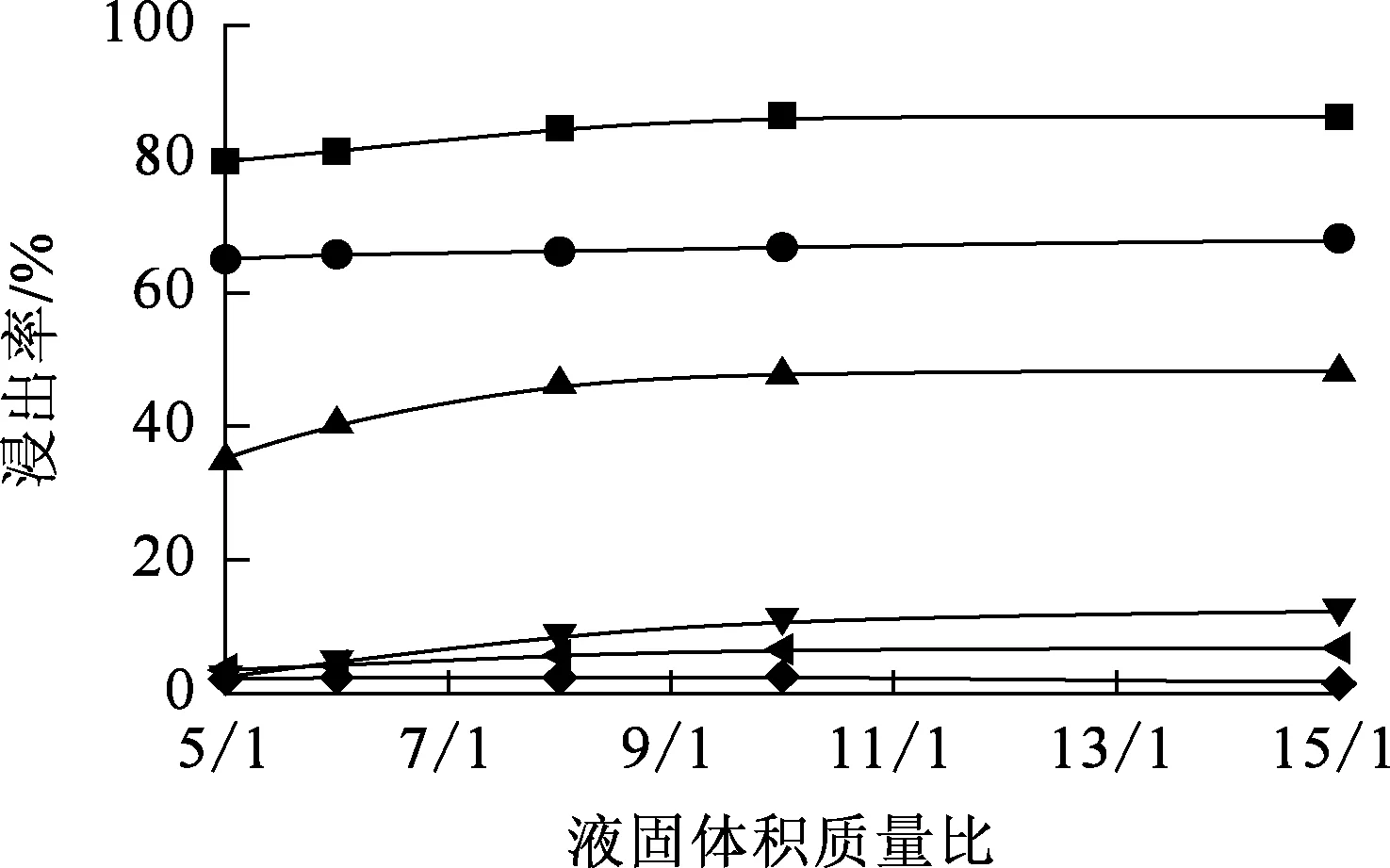
—■—La3+;—●—Y3+;—▲—Al3+;—▼—Fe3+;—◀—Mg2+;—◆—K+。图3 液固体积质量比对各元素浸出率的影响
由图3看出:随液固体积质量比增大,各元素浸出率均有不同程度提高;但液固体积质量比增至10/1后,各元素浸出率基本保持不变。液固体积质量比越大,与除杂渣中各物质反应的H+越多,酸溶反应越彻底,浸出率越大[14];而且,液固体积质量比越大,浆料黏度越小,外扩散阻力越小,有利于溶液中H+向除杂渣颗粒扩散,加快反应速度[15];但液固体积质量比增至一定值后,相对于待酸溶物质,溶液中H+已过量,再增大液固体积质量比,各元素浸出率不再提高。因此,确定适宜的液固体积质量比为10/1,此时,Fe3+、K+、Mg2+浸出率均较低,不超过12%。
2.4 浸出时间对各元素浸出率的影响
在液固体积质量比10/1、盐酸浓度1 mol/L、浸出温度40 ℃条件下,浸出时间对各元素浸出率的影响试验结果如图4所示。
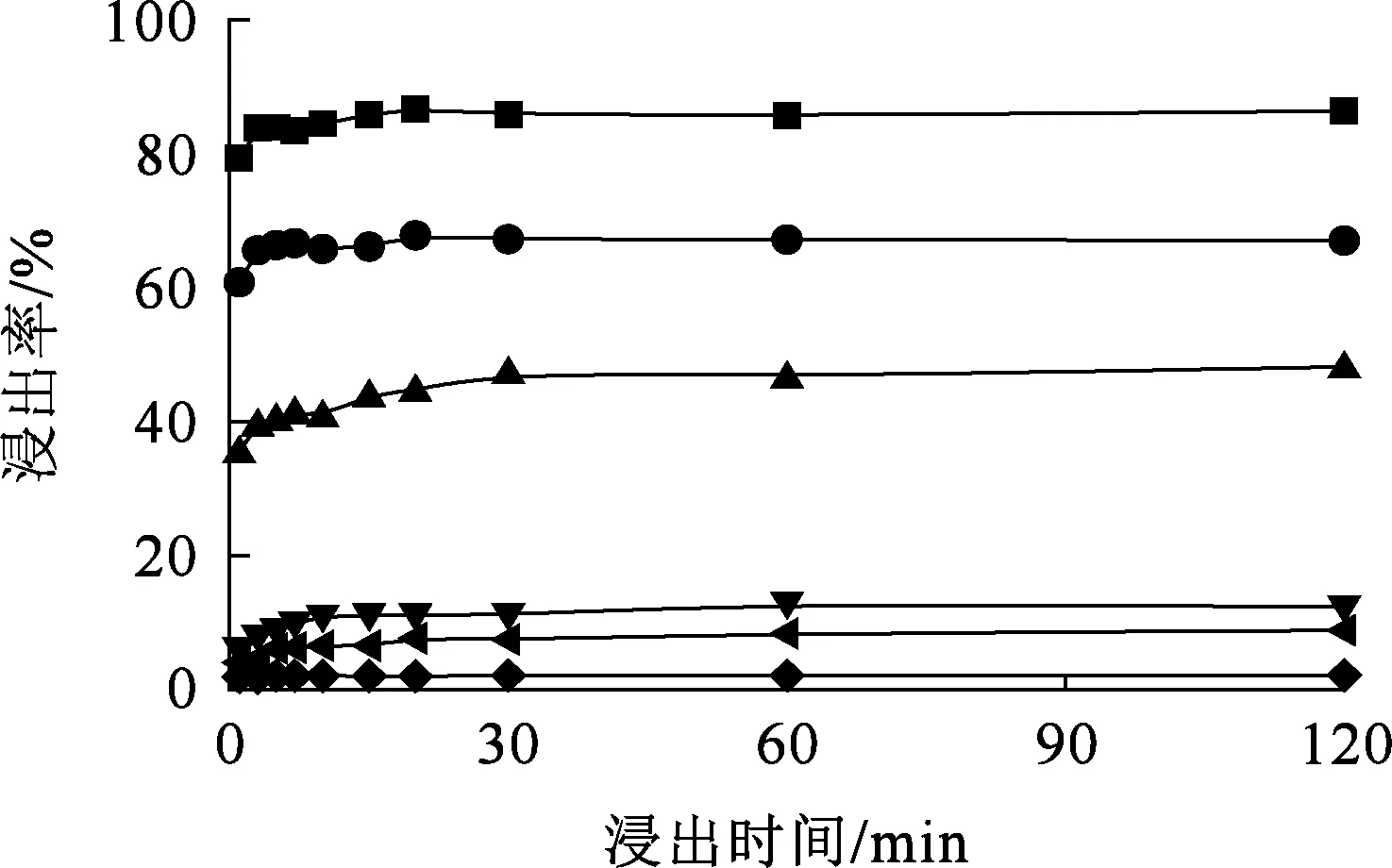
—■—La3+;—●—Y3+;—▲—Al3+;—▼—Fe3+;—◀—Mg2+;—◆—K+。图4 浸出时间对各元素浸出率的影响
由图4看出,各元素浸出率均随浸出时间延长而提高,达最大值后保持平衡。稀土及杂质离子(Fe3+、K+、Mg2+)的浸出速率均很快,10 min都达到平衡;而Al3+浸出相对较慢,30 min时才达到平衡。综合考虑,确定适宜浸出时间为30 min,此条件下,杂质离子浸出率均较低,不超过12%。
2.5 沉淀稀土和铝
从酸浸液中分步沉淀稀土和铝。向酸浸液中添加质量浓度为100 g/L的碳酸氢铵溶液,至溶液pH在5.0~5.5之间,使铝形成氢氧化铝沉淀;固液分离后,滤渣经洗涤、高温煅烧得氧化铝产品,铝回收率为46%;而含稀土滤液继续向其中加入碳酸氢铵溶液,使溶液pH提高至6.5~8.0之间,稀土形成碳酸稀土沉淀[16],过滤洗涤煅烧后得氧化稀土产品,稀土回收率为75%。
3 结论
用盐酸从含稀土除杂渣中浸出稀土是可行的,其中的铝也同时被浸出,适宜条件下,镧、钇、铝浸出率分别达85%、66%和48%。用100 g/L碳酸氢铵溶液调节溶液pH可沉淀铝及稀土,二者回收率分别为46%和75%,且杂质含量较低。该方法简单易行,稀土和铝均得到回收。
