舒洛地特注射液非临床安全性评价
2021-04-08冷佳蔚李水仙祝清芬
张 娟,冷佳蔚,李水仙,赵 岩,祝清芬
(山东省食品药品检验研究院·仿制药研究与评价重点实验室,山东 济南 250101)
舒洛地特作为治疗糖尿病肾病的新药受到越来越多的关注[1]。舒洛地特是从猪肠黏膜提取精制的高度纯化的天然糖胺聚糖,是由重复的二糖结构单元组成的带有负电荷的长链大分子,二糖单元包含2 个改构糖,即N-乙酰半乳糖胺或 N-乙酰葡糖胺及糖醛酸[2-3],具有抗凝、溶栓、抗炎免疫、调血脂和保护肾脏的作用。本研究中参照原国家食品药品监督管理(总)局《药物刺激性、过敏性和溶血性研究技术指导原则》和《药物非临床研究质量管理规范》,对舒洛地特注射液进行了非临床安全性试验。现报道如下。
1 材料与方法
1.1 仪器
BSA4000S 型电子天平(精度为 ±0.01 g)、BP211D 型电子天平(精度为 ± 0.01 mg),均购自德国 Sartorius 公司;TC10KA 型电子天平(常熟市双杰测试仪器厂,分辨率为 2 g);3-18K 型台式冷冻离心机(美国 Sigma 公司);PURA22 型水浴锅(优莱博技术<北京>有限公司);ASP200s 型全自动全封闭脱水机、EG1150 H &C 型包埋机、RM2245 型半自动轮转式切片机、HI1210 型摊片机、HI1220 型烘片机、XL 型全自动染色机、CV5030 型全自动封片机,均购自德国Leica 公司;BX51 型生物显微镜(日本Olympus 公司)。
1.2 试药
舒洛地特注射液1(供试品,国内某公司,批号为1704290,规格为每支 2 mL ∶600 LSU);舒洛地特注射液 2(上市药物对照,意大利Alfa Wassermann 公司,批号为14606,规格为每支 2 mL ∶600 LSU);戊巴比妥钠(西亚试剂,批号为05636);氯化钠注射液(山东齐都药业有限公司,批号为1E17081803);卵清蛋白(美国Sigma-Aldrich 公司,批号为SLBB5992V);伊文思蓝(上海化学试剂采购供应站分装厂,Fluka 公司进口分装,批号为82-11-02);其余试剂均为分析纯,水为纯化水。
1.3 动物
普通级新西兰家兔 31 只,体质量 2.0 ~ 3.0 kg,雌性15 只,雄性16 只,购自济南西岭角养殖繁育中心[动物生产许可证号为SCXK(鲁)2015 0001];普通级Hartley豚鼠60 只,体质量300 ~400 g,雌雄各半,购自济南金丰实验动物有限公司[动物生产许可证号为SCXK(鲁)2014 0006];均饲养于山东省食品药品检验研究院普通环境动物实验室[动物使用许可证号为SYXK(鲁)20130012]。试验方案实施前获动物伦理委员会批准。标准条件饲养,温度 20 ~ 26.0 ℃ ,相对湿度 40% ~70% ,日温差≤3 ℃,照明12 h(明暗交替),每小时换气次数不少于10 次。兔维持饲料、豚鼠生长繁殖饲料均购自北京科澳协力饲料有限公司[饲料生产许可证号为京饲证(2014)06054,实验动物(饲料)生产许可证号为 SCXK(京)2014-0010]。
1.4 方法[4-7]
1.4.1 剂量设计及依据
剂量及使用方法:按制剂说明书执行,每日1 支,肌肉注射或静脉滴注,连用15 ~20 d。
血管刺激性试验和肌肉刺激性试验:采用与临床制剂相同的浓度给药,即每日最大给药量以60 kg成人体质量计算为10 LSU/kg,临床使用最大浓度为300 LSU /mL,人用最大剂量为 0.03 mL /kg;人与家兔标准体质量等效剂量系数为3.08,家兔给药剂量设定为 0.2 mL /kg。
溶血性试验、主动全身过敏试验和被动皮肤过敏试验:选用临床使用最高浓度原液,作为供试品溶液。
1.4.2 试验方法
血管刺激性试验:取家兔15 只,雌性7 只、雄性8 只,按体质量随机分为供试品组、上市药物对照组和阴性对照组,各5 只。供试品组和上市药物对照组家兔左侧耳缘静脉注射舒洛地特注射液0.2 mL/kg(原液浓度为300 LSU/mL),阴性对照组家兔相同部位注射等体积0.9%氯化钠注射液;每日1 次,连续给药7 d,给药前称定体质量。末次给药72 h 时各组分别处死3 只家兔,14 d恢复期结束后各组分别处死2 只家兔。分别于注射部位近心端距离给药部位约1 cm 处剪取耳缘静脉组织1.0 ~4.0 cm,分 1.0 ~2.5 cm 和 2.5 ~4.0 cm 二段取材,观察有无红肿、淤血等肉眼可见的明显刺激性表现;10%甲醛溶液固定,常规组织切片,并进行显微镜检查。
肌肉刺激性试验:取家兔15 只,雌性7 只、雄性8 只,按1.4.2 项下血管刺激性试验中分组方法分为3 组。供试品组和上市药物对照组家兔右侧股四头肌分别注射舒洛地特注射液0.2 mL/kg,阴性对照组家兔相同部位注射等体积0.9%氯化钠注射液;每日1 次,连续给药7 d,给药前称定体质量。末次给药后48h 各组分别处死3 只家兔,14d 恢复期结束后各组分别处死2 只家兔。解剖取出股四头肌,纵向切开,观察注射部位有无充血、红肿等刺激性症状。10%甲醛溶液固定,常规组织切片,并进行显微镜检查。
溶血性试验:于家兔心脏采血约10.0 mL,置装有玻璃珠的三角瓶中,不停沿同一方向振摇10 min,去除纤维蛋白原后将其移入离心管中。加入0.9%氯化钠注射液混匀,1 500 r/min 离心 15 min,取下层红细胞,用0.9%氯化钠注射液按上述方法洗涤3 次,至上清液无色透明为止。最后将所得红细胞按体积用0.9%氯化钠注射液制备成2%红细胞悬液。取12 支试管并进行编号,其中 1 ~ 5 号管为供试品管,6 号管为阴性对照管,7 号管为阳性对照管,8 ~12 号管为上市药物对照管。分别加入2 %红细胞悬液、0.9%氯化钠注射液、纯化水、供试品和上市药物对照(见表 1),混匀,于(37 ±0.5)℃水浴锅中温育,1 h 内每隔 15 min 观察 1 次,1 h 后每隔 1 h观察1 次,连续观察3 h。肉眼观察各管溶血与红细胞凝聚情况,必要时进行显微镜检查。
主动全身过敏试验:取健康豚鼠24 只,按体质量随机分为阴性对照组、阳性对照组、供试品组和上市药物对照组,各6 只,雌雄各半。各组豚鼠分别腹腔注射0.5 mL 0.9% 氯化钠注射液、0.4%卵清蛋白溶液、舒洛地特注射液原液、上市药物对照原液进行致敏,隔日1 次,共致敏3 次。末次致敏后第14 天和第21 天,以2 倍致敏量于豚鼠后肢小隐静脉注射相应药液(1.0 mL)进行激发。激发即刻至激发后30 min,连续观察3 h。观察豚鼠反应及其反应出现、消失时间,并按全身致敏性评价标准[8](见表 1)评判过敏反应。

表1 全身致敏性评价标准Tab.1 Evaluation criteria of systemic sensitization
被动皮肤过敏试验[9-10]:取豚鼠 12 只,按体质量随机分为阴性对照组、阳性对照组、供试品组和上市药物对照组,各3 只。各组豚鼠分别腹腔注射相应溶液(同1.4.2 项下主动全身过敏试验)0.5 mL,隔日1 次,共致敏3 次。末次致敏后第10 天腹主动脉取血,2 000 r/min离心10 min,分离血清,组内豚鼠血清合并备用;-20 ℃保存,2 周内使用。取豚鼠24 只,同法分组。各组豚鼠背部脱毛(3 cm×4 cm)。制备的抗血清用氯化钠注射液按1∶2 稀释,在脱毛区皮内注射相应的抗血清0.1mL,进行被动致敏;24 h 后,各组豚鼠后肢小隐静脉注射与致敏剂量相同的激发抗原加等量1%伊文思蓝共1.0 mL。激发30 min 后颈椎脱臼处死各组豚鼠,剪取背部皮肤,测量皮肤内层的斑点大小,直径大于5 mm 者判定为阳性。不规则斑点的直径计为长径与短径的均值。
2 结果
2.1 血管刺激性试验
舒洛地特注射液耳缘静脉注射第2 天后,供试品组001,004 号和上市药物对照组007,009 号家兔注射部位出现少量瘀血,停药48 h 后恢复正常。其他家兔试验各阶段一般临床症状观察未见异常。给药前及恢复期给药局部血管均清晰,未见血管扩张、收缩及淤血等症状,血管周围组织亦无水肿等。末次给药结束约72 h 和14 d恢复期结束后,肉眼观察未见异常,显微镜下检查显示,供试品组和上市药物对照组家兔的血管组织均未见明显刺激性症状,与阴性对照组比较无明显差异。详见图1。
2.2 肌肉刺激性试验
供试品组001,003,005 号和上市药物对照组006,008,010 号家兔给药第2 天后注射部位出现充血和红肿,停药48 h 后恢复正常。其他家兔试验各阶段一般临床症状观察未见异常。大体病理学检查显示,末次给药48 h 后及14 d 恢复期结束后,分别解剖取出给药侧股四头肌,纵向切开。末次给药结束48 h 后,肉眼可见供试品组 001,003,005 号和上市药物对照 006,008,010 号家兔注射部位出现充血,供试品组和上市药物对照组等级均为轻微刺激,阴性对照组等级为无刺激;恢复期观察结束后肉眼观察未见充血、红肿等刺激性症状。组织病理学检查显示,末次给药48 h 后,供试品组001,003,005 号和上市药物对照组006,008,010 号家兔给药侧股四头肌见出血,肌纤维变性、坏死,炎性细胞浸润,间质巨噬细胞数目增多;阴性对照组011 号家兔给药侧股四头肌见出血,肌纤维变性、坏死,伴炎性细胞浸润,间质巨噬细胞数目增多,其他家兔给药侧股四头肌未见明显组织病理学改变。恢复期观察结束,供试品组、上市药物对照组及阴性对照组家兔给药侧股四头肌均未见明显组织病理学改变。详见图2。
2.3 溶血性试验
7 号管加入纯化水后于15 min 出现澄明红色,表明已经溶血;前几个观察时点,1 ~ 6 号管和 8 ~ 12 号管溶液呈混浊状态,未见澄明红色或棕红色现象;后几个观察时点,1 ~6 号管和 8 ~12 号管红细胞开始下沉,3 h后全部下沉,轻摇各管红细胞散开。与6 号管比较,1 ~5 号管和 8 ~ 12 号管未见明显异常,1 ~ 6 号管和 8 ~ 12号管均未见红细胞凝聚现象。与7 号管比较,1 ~6 号管和8 ~12 号管有明显差异。本品和上市药物对照均无溶血和致红细胞凝聚现象发生。加样情况见表2。
2.4 主动全身过敏试验
阳性对照组豚鼠激发后即刻出现不安宁(6/6)、挠鼻(6 /6)、排尿(4 /6)、步态不稳(5 /6)、喘息(2 /6)、死亡(6/6)等明显过敏反应,6 只豚鼠均在激发后5 min内死亡。按全身致敏性评价标准评判为极强阳性。豚鼠激发后一般状况良好,未见明显过敏反应症状。阴性对照组豚鼠激发后一般状态良好,未见明显过敏反应症状。与阴性对照组比较,供试品组和上市药物对照组豚鼠均未见明显差异,按全身致敏性评价标准评判为阴性。试验期间各组豚鼠未见明显异常,体质量增长良好,供试品组和上市药物对照组与阴性对照组比较无明显差异。
2.5 被动皮肤过敏试验
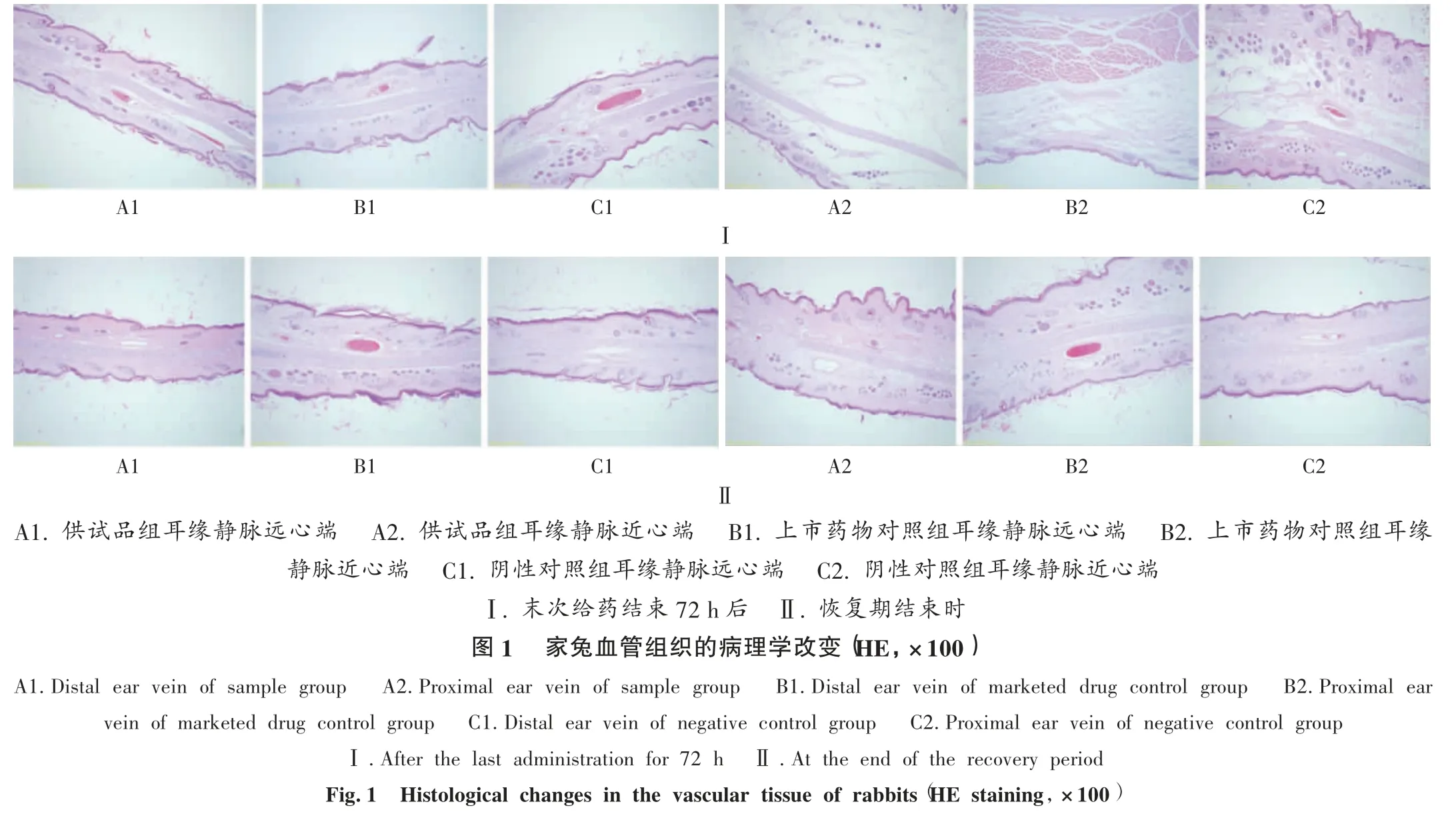
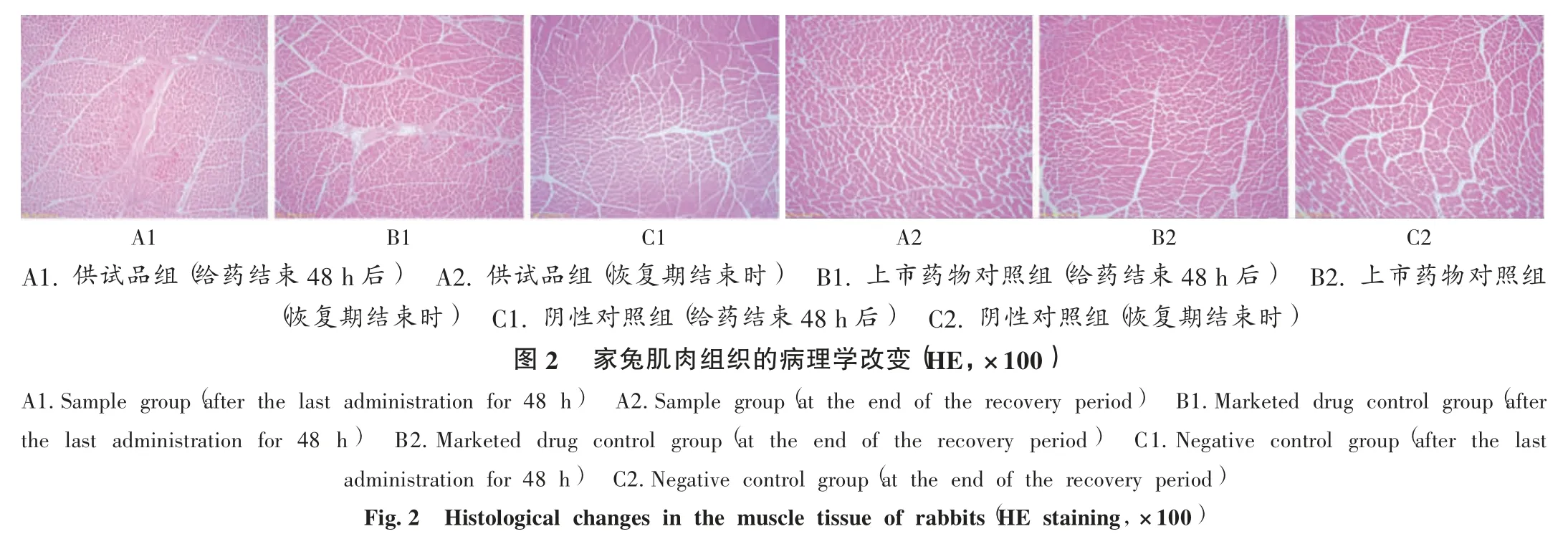
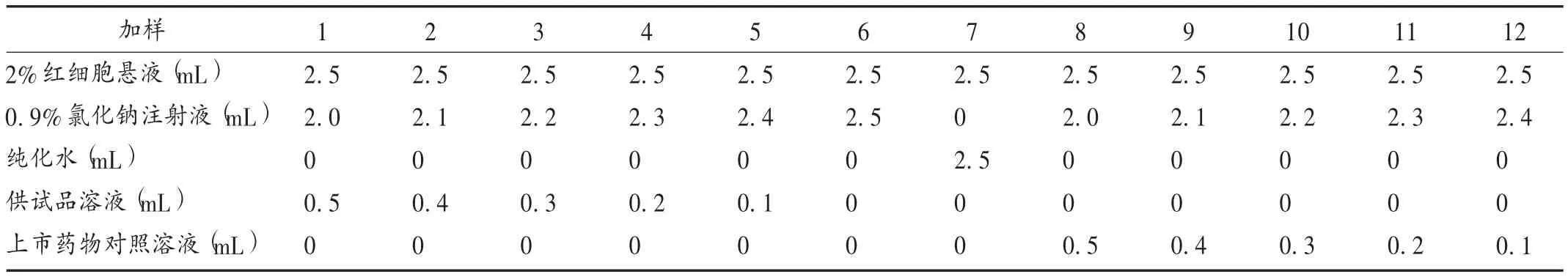
表2 舒洛地特注射液溶血性试验加样表Tab.2 Hemolytic test of Sulodexide Injection
试验期间,各组豚鼠一般状态良好,未发现明显异常。激发后30 min 处死豚鼠,剪取背部皮肤:阳性对照组豚鼠皮内注射抗血清处可见明显蓝斑,蓝斑直径分别为18,15,26,21,35 mm,均大于 5 mm,被动皮肤过敏反应发生率为100.00%。阴性对照组、供试品组、上市药物对照组豚鼠激发后均未见明显蓝斑,过敏反应呈阴性。
3 讨论
注射药物的安全性评价是药物临床试验的重要研究内容[11]。药物的活性成分及其代谢物、辅料、有关物质及理化性质(如pH、渗透压等)均有可能引起刺激性和/或过敏性和/或溶血性反应的发生[12]。本研究中对舒洛地特注射液进行了血管刺激性、肌肉刺激性、溶血性及过敏性观察。舒洛地特注射液未见明显的血管刺激性作用,也未见溶血和红细胞凝集现象,对豚鼠的主动全身过敏反应和被动全身过敏反应均呈阴性。虽然舒洛地特注射液对家兔的股四头肌在末次给药48 h 后产生一定的肌肉刺激反应,但同其上市药物对照的肌肉刺激性程度基本一致,均为轻度刺激,且均在停药后逐渐恢复,恢复期结束后肌肉刺激性均已恢复。
综上所述,舒洛地特注射液临床前相关安全性评价试验结果符合新药申报要求,可供静脉注射或肌肉注射,结合临床使用,应注意监测凝血酶原时间、凝血酶时间、活化部分凝血活酶时间、血浆纤维蛋白原、血浆抗凝血酶Ⅲ、D-二聚体等 6 项凝血指标[13]。
