人PBMC 中免疫蛋白酶体亚基LMP7 酶活力的检测
2021-04-08成彦凌春莹罗亚鸽陈宝龙孙瑞
成彦,凌春莹,罗亚鸽,陈宝龙,孙瑞
河南省洛阳正骨医院(河南省骨科医院)生化研究室,河南洛阳 471000
免疫蛋白酶体是一种具有多相催化活性的蛋白酶复合体,它广泛存在于血源性细胞,尤其是淋巴细胞和单核细胞中, 并直接参与了免疫系统的运作,在抗原呈递、免疫应答等过程中扮演关键角色[1-4]。 免疫蛋白酶体亚基LMP7 在多种自身免疫性疾病中被认定为重要的自身抗原,针对它们的自身免疫反应可能与炎症反应相关[5]。 免疫蛋白酶体促进Th 细胞分化,RA 细胞模型中,LMP7 受抑制可导致90% IL-23 的产生受抑制, 及 50% TNF-α 和 IL-6 受抑制; 抑制LMP7 活性,可缓解类风湿性关节炎小鼠模型病情[6],提示LMP7 与RA 存在一定联系,其表达、活性极有可能参与了RA 的发生、发展,但目前此方面研究较少。
迄今,有关人PBMC 中LMP7 酶活力的测定方法尚未见报道。 该研究拟在荧光法的基础上,采用单因素实验法对LMP7 活性测定条件进行优化, 确定人PBMC 中LMP7 酶活力测定的最优化条件, 以LMP7酶活力为依据,为进一步探究其在RA 发生、发展中的作用奠定基础。
1 材料与方法
1.1 试剂
荧 光 多 肽 底 物 Ac-ANW-AMC、DMSO、Ficoll-Paque、无菌 PBS pH 7.2~7.4,其它试剂为分析纯。
底物溶液配制: 荧光多肽底物Ac-ANW-AMC,底物原包装2 mg,轻微离心,加入169.8 μL DMSO 制成20 mM 底物母液,分装并储存于-20℃。 使用时,用DMSO 稀释为2 mM 工作液。
反应缓冲液:pH 8.0 Tris-HCl 50 mM,NaCl 150 mM,Glycerol 10%,SDS 0.01% (w/v)[11]。
1.2 仪器
多功能酶标仪(Spectramax i3x MD);高速冷冻离心机 (5804R Eppendorf); 分析天平 (XS205 METTLER-TOLEDO);pH 仪(S220 METTLER-TOLEDO);超纯水仪(EASYPure II Barnstead);超净工作台(SWCJ-1FD 苏州安泰)。
1.3 实验方法
1.3.1 PBMC 分离 依照单位伦理委员会批准的实验方案。取健康受试者或RA 患者空腹外周静脉血3 mL,肝素抗凝。超净台中进行细胞分离。3 mL 外周血加入等体积常温 PBS(pH 7.2~7.4)缓冲液稀释,15 mL 离心管事先加入3 mL Ficoll 淋巴细胞分离液, 倾斜离心管,缓慢小心地将混合均匀的PBS 和全血混合液加入分离液上层,20℃,400 g,快加速慢减速,离心 20 min;小心移出离心管,应可见4 层分离。上层血清,云雾层PBMC,中层 Ficoll, 下层为血浆。 使用 1 000 μL 移液枪,尽可能吸取云雾层,移入另一支15 mL 离心管,加入 10 mL 冷 PBS 充分洗涤,20℃,100 g,离心 10 min;弃上清, 轻弹试管, 加入10 mL 冷PBS 重悬细胞,20℃,100 g,离心 10 min,弃上清,加入 500 μl 反应缓冲液,重悬细胞,台盼蓝染色进行细胞计数。
1.3.2 细胞冻存及裂解 用反应缓冲液调整PBMC 细胞悬液浓度至 5×106个/mL,按每管 100 μl 细胞悬液进行分装,置于液氮中冷冻。
1.3.3 LMP7 酶活力检测 利用多肽荧光底物Ac-ANW-AMC, 通过检测 37℃下,30 min 内多肽底物的水解速度,即荧光产物AMC 的产生速度Vmax,检测免疫蛋白酶体亚基LMP7 的活性。
冷水浴解冻细胞悬液, 用冰反应缓冲液稀释PBMC 细胞悬液至一定浓度,置于冰上待测。 在96 孔板的一个孔内加入99 μl 稀释的PBMC 细胞悬液,加入 1 μl 稀释的 Ac-ANW-AMC 底物液,37℃避光孵育10 min, 启动反应。 Spectramax i3x 酶标仪设定为37℃,发射波长λex=360 nm,激发波长λem=460 nm,动力学方法检测30 min,使用一级动力学方程描述荧光强度的变化值与时间之间的关系曲线[7],记录最大反应速度Vmax(单位U)及线性判定系数R2。
1.3..4 PBMC 细胞浓度(LMP7 酶浓度)优化
参照前期RA 患者PBMC 中LMP7 蛋白表达检测结果,及已有LMP7 in vitro 活力检测的相关报道[7],选择设定 PBMC 细胞浓度为 1 000 个/μl,500 个/μl,250 个/μl 以及 125 个/μL。 每个处理设置平行实验 3次,包含健康受试者1 例,RA 患者2 例,每个实验设3 次重复。
1.3.5 细胞冻融循环次数优化 免疫蛋白酶体极不稳定,其活性对机械方法及Triton 等化学试剂特别敏感[8],冻融裂解可能是裂解的首选方法。将PBMC 细胞悬液在液氮中冷冻10 min 后,冷水浴中解冻细胞悬液,设为一个冻融循环。 为进一步优化裂解效果,将同一样品分别进行1~5 次冻融后,检测LMP7 酶活力。
1.3.6 细胞冻存时间对酶活力的影响 PBMC 在液氮中冷冻 10 min,3 h,1 d,3 d,7 d,14 d,21 d 及 28 d后,冷水浴解冻,检测LMP7 活力。
1.4 统计方法
该次研究采用SPSS 23.0 统计学软件进行数据分析,R2为红性相关的判定系数。
2 结果
2.1 LMP7 酶浓度的优化
分别考察不同细胞浓度(酶浓度)下,Vmax 以及R2的变化, 检测结果见表 1。 在 3 个样本中, 不同PMBC 细胞浓度(酶浓度)组均表现出一定LMP7 酶活力,但不同样本、不同PBMC 细胞浓度下,LMP7 酶活力差异较大。
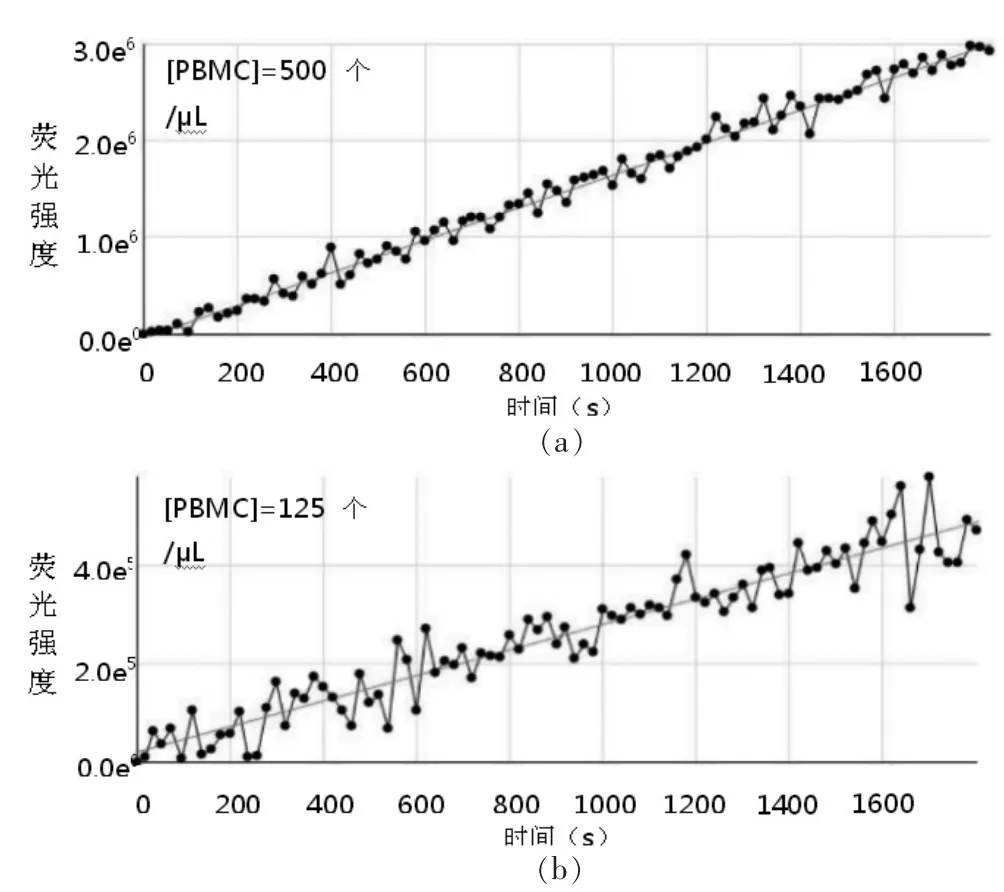
图1 PBMC 细胞浓度对LMP7 酶活力检测的影响
3 个样品中,酶活力与酶浓度(细胞浓度)均呈正相关。 其中健康受试者PBMC(样品3)中LMP7 酶活力低于 RA 患者(样品 1,样品 2)。 样品 1,样品 2 中,当 PBMC 细胞浓度>250 个/μl 时, 线性相关系数 R2>0.95,见图1(a),显示该体系较好地符合一级反应动力学方程 Vmax=K3[E],当 PBMC 细胞浓度为 125 个/μL时,R2<0.95,与一级反应相关性较差,见图 1(b)。健康受试者即样品 3 中, 当 PBMC 细胞浓度≥500 个/μL时,线性相关系数R2>0.95,显示该体系较好地符合一级反应, 当 PBMC 细胞浓度为≤250 个/μL 时,R2<0.95,与一级反应相关性较差。 为同时满足对健康受试者及 RA 患者 PBMC 中 LMP7 酶活力的检测,PBMC 细胞浓度应≥500 个/μL。

表1 PBMC 细胞浓度对LMP7 酶活力的影响
2.2 细胞冻融循环次数的优化
考察PBMC 细胞裂解时冻融循环次数对LMP7酶活力检测结果的影响,见图2。
结果表明,细胞冷冻循环次数对LMP7 酶活力检测有较大影响。 一次冻融即可充分裂解细胞,满足对PBMC 中 LMP7 酶活力的检测。 当 PBMC 细胞裂解冻融循环为1~2 次时,LMP7 酶活力不受冻融循环次数影响,差异无统计学意义(P>0.05)。随着冻融循环次数的增加,LMP7 酶活力逐渐降低, 差异有统计学意义(P<0.05),冻融循环对LMP7 酶活力具有破坏作用,应尽量避免反复冻融。因此,在满足实验要求的前提下,为了进一步保护LMP7 酶活力及简化实验流程,选择对PBMC 细胞进行一次冻融以达到裂解细胞的目的。
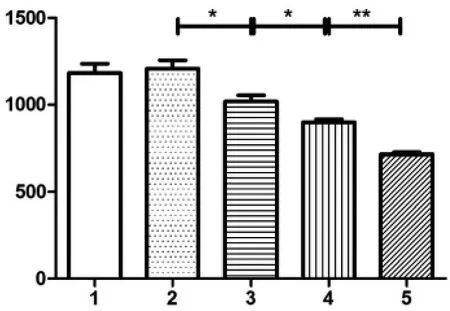
图2 不同冻融循环次数下LMP7 的酶活力
2.3 PBMC 细胞冻存时间对LMP7 酶活力的影响
PBMC 细胞在液氮冻存不同时间之后的LMP7 酶活力,见图3。 结果表明,在使用液氮冻存细胞10 min到21 d 内,LMP7 酶活力无显著改变, 差异无统计学意义(P>0.05)。 PBMC 细胞冻存 14 d 时,LMP7 酶活力较7 d 时略有下降,但差异无统计学意义(P=0.060)。 28 d时,LMP7 酶活力进一步减弱,较 1 d,3 d,7 d,14 d,21 d 均有差异有统计学意义(P<0.05)。由此可见,使用液氮冻存PBMC 细胞, 可较好的保护LMP7 的酶活力,短时间冻存(<21 d)对 LMP7 酶活力影响较小。 为确保实验结果,应尽量缩短冻存时间(不超过21 d,7 d 内最佳), 在PBMC 细胞提取、 冷冻后及时进行检测。
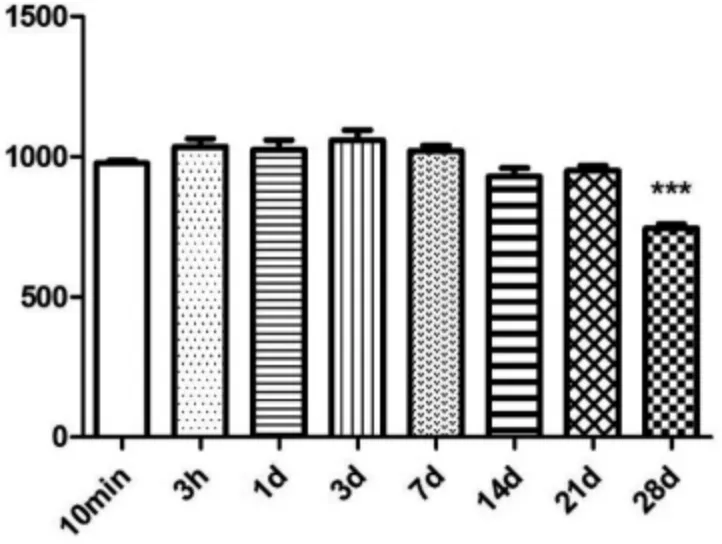
图3 PBMC 细胞冻存时间对LMP7 酶活力的影响
3 讨论
酶活力指酶的催化活性,用规定反应条件下单位时间内底物的消耗量或产物的生成量来表示。当底物浓度远远大于酶浓度时,Vmax 与酶的浓度成正比。该研究利用多肽荧光底物Ac-ANW-AMC,采用动态法,连续检测并计算单位时间内荧光产物AMC 的产生速度Vmax 来考察LMP7 酶活力。
饶文兵等通过极差分析得出酶浓度对酶活力测定的影响最显著[9-10]。 Koroleva ON 等[7]得出 LMP7 酶活性 in vitro 测定的最优化条件为:37℃,pH 8.0 的Tris-HCl 50 mM,NaCl 150 mM,Glycerol 10% ,SDS 0.01% (w/v)缓冲液,酶浓度0.2 nM,底物浓度20 μM。根据前期 Western blotting 实验, 每 106 个 PBMC 中LMP7(MW=27 kDa)含量约为 23~75 ng,该研究使用100 μlPBMC 细胞, 实验浓度区间为 125~1 000 个/μl。研究结果显示不同PBMC 细胞浓度即酶浓度下,LMP7 酶活力差异显著, 无论是健康受试者还是RA患者,当 PBMC 细胞浓度达到 500 个/μl 以上时,线性判定系数R2均>0.95,符合一级动力学方程Vmax=k3[E],能够更准确地反应酶活力。
Villoutreix BO 等[8]指出免疫蛋白酶体活性部位较不稳定,其活性受温度、pH 及例如Triton-100 等化学物质影响, 即使-80℃低温冻存其活性依然会随时间降低。 根据分子克隆实验指南[11],该研究采用相对温和的反复冻融法以释放细胞中的蛋白质。使用液氮提高冻融速率,并在冻存时将PBMC 细胞悬液浓度提高为 5×106个/mL, 以尽可能地保护细胞及 LMP7 的酶活力。 为进一步优化裂解效果,对细胞冷冻保存时间和反复冻融法裂解对LMP7 酶活力的影响进行考察。研究结果表明经过3 次以上的冻融和21 d 以上的冻存对LMP7 酶活力的影响大,应在细胞提取后使用液氮冻融1 次后及时进行检测。
泛素-蛋白酶体系统是一种高效、 特异的蛋白质降解系统,是真核细胞中非溶酶体通路蛋白质降解的主要途径。 通过降解细胞内无用的、合成错误或受损的蛋白质来维持细胞内蛋白质的动态平衡,也因此参与调控生物体内几乎所有生命活动:调节转录、细胞生长周期、细胞分化和凋亡、细胞应激反应等[3]。
蛋白酶体26S 中的3 种β 亚基具有蛋白水解活性:β1(酸后水解活性)、β2(类胰蛋白酶活性)和 β5(类糜蛋白酶活性)在血源性细胞,尤其是淋巴细胞和单核细胞中,蛋白酶体包含活性部位的3 个亚基分别被LMP2(β1i)、MECL1(β2i)和 LMP7(β5i)替代,组成免疫蛋白酶体,其底物特异性发生了变化。 免疫蛋白酶体亚基直接参与了抗体呈递等免疫系统的运作,并在其中扮演关键角色[2-4]。
LMP7 在类风湿性关节炎等自身免疫性疾病的发生发展中发挥着重要作用[12]。 PR-957 是免疫蛋白酶体的共价性抑制剂,它选择性地抑制免疫蛋白酶体亚基LMP7。 使用PR-957 处理RA 细胞模型可抑制IL-23、TNF-α 和 IL-6 等细胞因子的表达。 使用 PR-957 处理CAIA 类风湿性关节炎小鼠模型, 首次用药24 h 后即可观察到病情缓解,用药7 d 后IL-1β、IL-6等炎性因子显著降低,小鼠跗骨关节炎症侵蚀和持续性的骨质溶解显著降低[6]。揭示免疫蛋白酶体与RA 存在一定联系,其表达、活性极有可能参与了RA 的发生、发展。该研究也证实,免疫蛋白酶体亚基LMP7 无论在健康人还是类风湿性关节炎患者的PBMC 中均有分布,且具有一定活性。RA 患者PBMC 中LMP7 活性高于健康受试者。通过大样本量研究对比健康人与RA 患者PBMC 中LMP7 的表达及活性, 有助于进一步研究LMP7 在RA 发生发展中的作用及机制,为抑制免疫蛋白酶体治疗自身免疫性疾病提供科学依据。
该研究发现样本中健康受试者LMP7 活性远远低于RA 患者,提示LMP7 与RA 存在明显相关性。但由于样本量小, 不同个体样本中LMP7 活性差异较大,为了得到准确的结论,仍需继续进行大样本采集检测分析。
该研究确定了LMP7 酶活力检测的最优条件,提供了一套简便、实用、可靠的LMP7 酶活力检测方法,对RA 等免疫性疾病中LMP7 酶的后续研究有重要意义。
