亚临床甲状腺功能减退症对非ST段抬高型心肌梗死患者心律失常事件的影响
2021-04-07申泽雪李树仁郝潇张一峰吕晓
申泽雪,李树仁,郝潇,张一峰,吕晓
目前随着人们生活方式改变和老龄化的进展,导致心血管疾病发病率和患病率急剧上升[1],已成为威胁人类健康的首要疾病[2,3]。心血管病死亡率在我国及欧洲等地仍居首位,高于肿瘤及其他疾病[2,3]。虽然心血管病防治工作取得初步成效[4],非ST段抬高急性冠状动脉综合征(NSTE-ACS)患者的临床治疗效果和生活质量得以改善[5]。但作为ACS常见的疾病表现形式,非ST段抬高型心肌梗死(NSTEMI)目前仍有较高的发病率[5]。因此,探索新的危险因素来优化NSTEMI管理尤为重要。其中甲状腺功能状态作为新的危险因素引起越来越多的关注,甲状腺激素(TH)的过量和缺乏均可诱发或加重心血管疾病,包括房性和室性心律失常、动脉粥样硬化性血管疾病、血脂异常和心力衰竭(HF),从而增加未来发病和死亡的风险[6]。本研究旨在探究亚临床甲状腺功能减退症对NSTEMI患者发生心律失常事件的影响,为优化风险分层及临床治疗提供依据。
1 资料与方法
1.1 研究对象与分组收集2016年1月至2018年8月就诊于河北省人民医院的NSTEMI患者265例,其中男性188例,女性77例,年龄23~93(66.74±12.72)岁。纳入标准:符合NSTEMI诊断标准:心脏生物标志物值[肌钙蛋白I/T或肌酸激酶同工酶(CK-MB)]升高和/或升高后降低,其中至少一个值高于第99百分位上限参考限值,伴有胸痛等心肌缺血症状,心电图包括2个连续导联的新发水平或向下倾斜的ST段压低≥0.05 mV和/或2个连续导联的T波倒置≥0.1 mV[7];年龄≥18周岁;入院24 h内测定TH水平。排除标准:由冠状动脉(冠脉)血运重建术导致的NSTEMI;TSH、总三碘甲腺原氨酸(TT3)、TT4等基线资料缺失;存在可引起甲状腺代谢异常疾病:垂体瘤、垂体功能减退症等;近期1个月内或正在服用影响甲状腺功能的药物(胺碘酮、甲状腺激素、糖皮质激素等);住院3个月内曾接受过外科手术;合并有严重的心脏瓣膜病、先天性心脏病、心肌病、结缔组织病、重症感染、严重凝血功能障碍或出血性疾病、严重肝功能不全者。本研究中TH的参考范围定义为:TT3为1.30~3.10 ng/ml,TT4为66~181 μg/ml,TSH为0.27~4.2 mIU/L。将受试者分为两组:甲状腺功能正常组(EU):TSH、TT4水平在参考范围内,n=237;亚临床甲状腺功能减退组(SH):TSH>4.2 mIU/L,TT4在正常范围内[8],n=28。所有患者对本研究均知情同意。
1.2 方法
1.2.1 资料收集通过河北省人民医院数字化管理系统及胸痛中心数据收集平台收集入选患者住院期间的详细资料,包括:性别、年龄、体质指数、既往史、个人史、入院时体征、心肌梗死(心梗)部位、住院期间用药情况、实验室检查数据、GRACE评分、本次住院是否行经皮冠状动脉介入治疗(PCI)等。
1.2.2 TH测定患者入院24 h内用肝素锂管抽取肘静脉血5 ml,摇匀,放入离心机中以3500转/min的转速离心10 min,取上清液置于罗氏Cobas E602全自动电化学发光免疫分析仪中测定血清TT3、TT4、TSH浓度。TH的参考范围为:TT3为1.30~3.10 ng/ml,TT4为66~181 μg/ml,TSH为0.27~4.2 mIU/L。
1.2.3 研究终点住院期间出现心律失常事件:窦性心动过缓;房性心律失常复合事件:房性期前收缩、心房扑动、心房颤动(AF);房室交界区心律失常复合事件:房室交界区期前收缩、非阵发性房室交界区心动过速;室性心律失常复合事件:室性期前收缩情况、室性心动过速、心室扑动、心室颤动等心律失常情况。院内终点事件:住院期间出现死亡或HF。
1.3 统计方法所有数据均采用SPSS 21.0统计学软件分析。正态分布的计量资料采用均数±标准差(±s)表示,两组间比较采用t检验;非正态分布的计量资料采用中位数(四分位数间距)[M(Q1,Q3)]表示,两组间比较采用非参数检验Mann-Whitney U检验;计数资料采用例数(构成比)表示,组间比较采用χ2检验或Fisher精确检验。进行多因素logistic回归,分析不同TH水平对住院期间发生心律失常事件的影响。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较E U、S H 两组患者年龄(P=0.038)、BMI(P=0.034)及腺苷脱氨酶水平(P=0.022)差异具有统计学意义。与EU组相比,SH组住院期间使用硝酸酯类药物比例偏低(P=0.012),天冬氨酸转移酶(P=0.022)、肌酸激酶(P=0.004)、红细胞计数(P=0.030)均较低。且与EU组相比,SH组左室收缩末期内径缩小(P=0.020)。其余基线资料差异无明显统计学意义(P均>0.05)(表1)。
2.2 院内终点事件和心律失常事件比较纳入研究的NSTEMI患者住院期间总的死亡率为4.5%,发生HF的有18.8%。EU与SH组相比,院内终点事件发生率无明显差异(P均>0.5)(表2)。与EU组相比,SH组出现窦性心动过缓的比例增高(2.5% vs.21.4%,P<0.001)。此外,与EU组相比,心房扑动(2.1% vs.17.9%,P<0.001)、房室交界区期前收缩(6.3% vs.25%,P=0.002)、非阵发性房室交界区心动过速(0.4% vs.7.1%,P=0.030)以及心室扑动(0% vs.10.7%,P=0.001)等心律失常在SH组发生频率更高,差异有统计学意义(表2)。
2.3 心律失常事件多因素Logistic回归分析
2.3.1 窦性心动过缓事件多因素Logistic回归分析进一步行多因素Logistic回归分析,调整性别、年龄、既往心梗史、心肌梗死部位、左室射血分数(LVEF)、TT3、TT4、TSH、肾小球滤过率(GFR),本次住院行PCI等因素后,SH组发生窦性心动过缓(OR=7.932,95%CI:1.542~40.804,P=0.013)事件风险仍较高(表3)。进一步调整住院期间使用β受体阻滞剂后,SH对窦性心动过缓事件的发生仍存在统计学意义(OR=9.564,95%CI:1.634~55.989,P=0.012)。此外,影响窦性心动过缓发生的因素还有LVEF(OR=1.211,95%CI:1.018~1.441,P=0.030)(表3)。

表1 两组患者一般临床资料比较
2.3.2 心房扑动等心律失常事件的多因素Logistic回归分析调整性别、年龄、既往心梗史、梗死部位、LVEF、TT3、TT4、TSH、GFR,本次住院行PCI等因素后,SH组发生心房扑动(OR=7.824,95%CI:1.652~37.055,P=0.010)、房室交界区期前收缩(OR=4.940,95%CI:1.468~16.625,P=0.010)等心律失常事件风险仍较高。未观测到SH与房性及室性心律失常复合事件的关系,但结果显示,TT4是房性心律失常复合事件的危险因素(OR=1.024,95%CI:1.002~1.047,P=0.033),且随着TT3的升高,房性心律失常复合事件发生风险降低(OR=0.187,95%CI:0.054~0.645,P=0.008)。此外,随着患者年龄增长,发生房性心律失常复合事件风险增加(OR=1.058,95%CI:1.018~1.100,P=0.005)。既往心肌梗死病史则是发生室性心律失常复合事件的危险因素(OR=3.140,95%CI:1.388~7.101,P=0.006)(表4)。
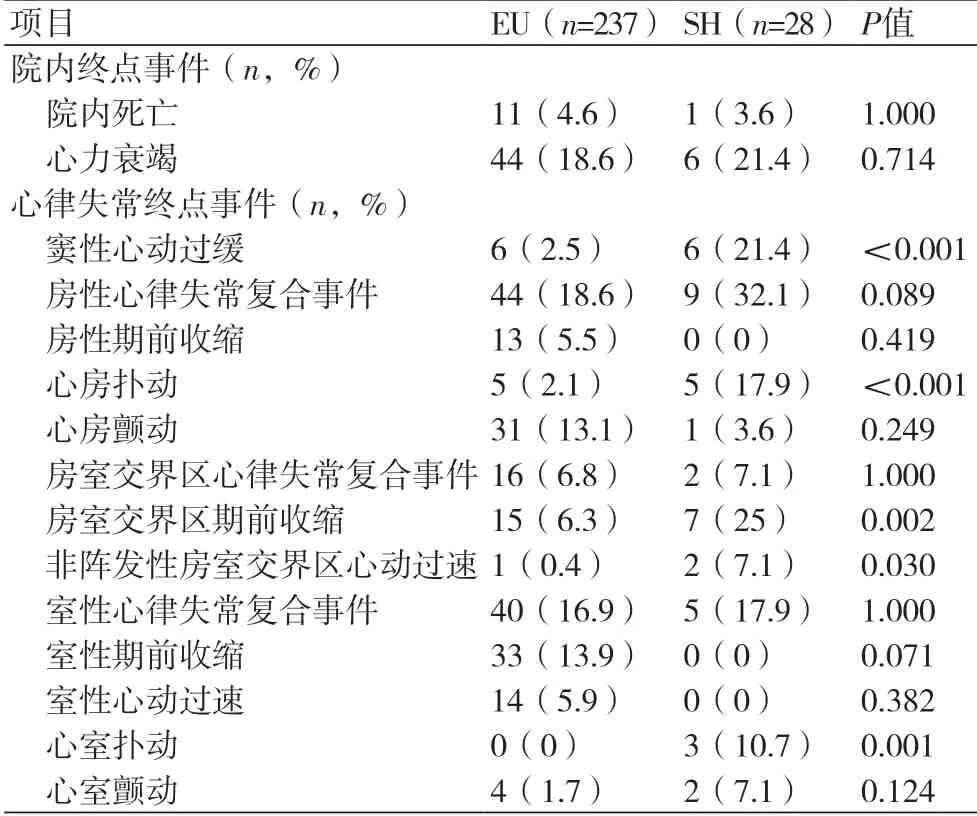
表2 EU与SH两组患者院内终点事件及院内心律失常事件比较

表3 发生窦性心动过缓事件的多因素Logistic回归分析
3 讨论
目前正确识别高风险NSTE-ACS患者在目前仍然是一项日常挑战[9]。且有数据表示与STEMI相比,NSTEMI临床症状和结局更加多样化,远期预后较差[10]。作为影响因素之一,甲状腺功能障碍对心血管系统的影响已有超过两个世纪的记载[11]。但甲状腺功能障碍与心血管疾病进展之间仍存在较大的知识空白[6],且亚临床甲状腺功能异常无明显临床症状,因此与其他甲状腺疾病相比,受到的关注较少[12]。SH是一种常见的情况,发生在4%~20%的人口中[13];Ertugrul等对急性心肌梗死(AMI)(包括STEMI和NSTEMI)的甲状腺功能异常情况进行了统计[14],结果发现10.76%的AMI患者存在SH,因此进行大规模的研究以阐明SH对病因和预后的影响是十分必要的。
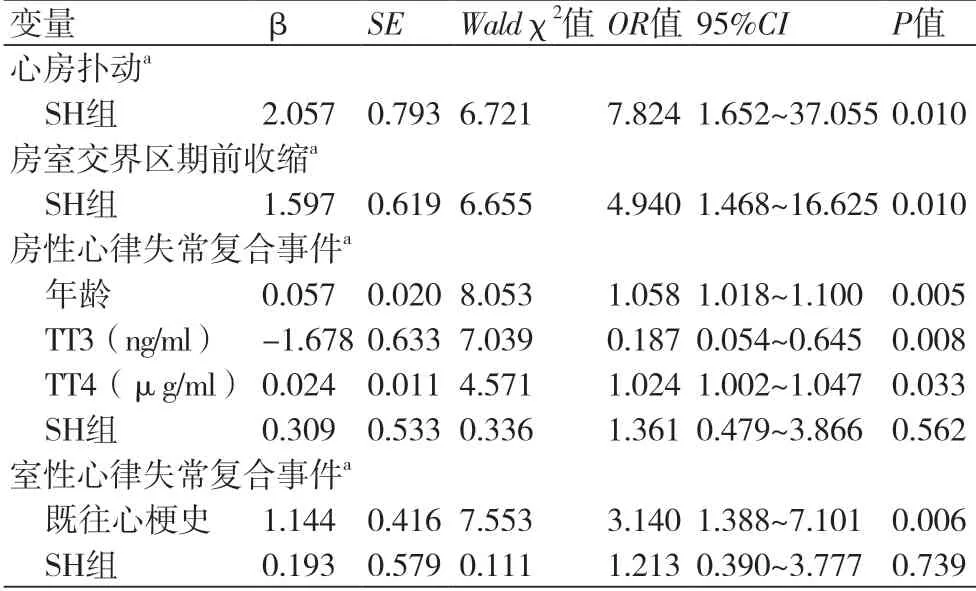
表4 发生心房扑动等心律失常事件的多因素Logistic回归分析
本研究发现,与EU组相比,SH组患者出现窦性心动过缓、心房扑动、房室交界区期前收缩等心律失常风险增高。但目前关于SH对心律失常结局的研究较少,大部分集中在亚临床甲状腺功能亢进及甲状腺功能亢进领域。因此,本研究结果对临床工作有一定指导意义,提前识别患有SH的NSTEMI患者并加强管理,可能会使更多的患者获益。此外,研究未观察到SH与房颤(AF)及室性心律失常发生有关,同样的结果可见于Cappola AR关于心血管健康的研究中[13]。此前有报道表明,甲状腺功能减退症也与窦性心律失常和各种心电图异常相关[15]。TH的心律失常作用包括改变心房肌细胞的电生理特性,增强自律性,触发肺静脉心肌细胞的活性以及缩短动作电位的持续时间[15]。循环TH水平的变化可能改变心脏的兴奋性和传导,导致心传导阻滞和心动过缓,以及自动、触发和再发室上性和室性心动过速[6]。这些机制可能部分解释了SH出现心房扑动等心律失常事件风险增加的原因。
同时,本研究可见,参考范围内,随着TT4的增高,发生房性心律失常复合事件危险增加,而随着TT3的升高,房性心律失常复合事件发生风险降低。与本文不同的是,一项心血管健康研究表明[16],参考范围内的TT3与AF风险无关。同时,该研究也显示在正常范围内,FT4水平越高则AF风险越高,尤其是较为年轻的受试者中。包含11个队列30 085名参与者的荟萃分析显示[17],在甲状腺功能正常的个体中,较高的循环FT4水平,与AF的风险增加有关,该研究同时表明TSH水平与AF发生风险无明显相关。目前大部分研究已经表明游离T4(FT4)与AF风险增加相关,但目前研究主要观察集中于FT4及和游离T3(FT3),本研究的多因素回归分析则提示TT4水平升高患者也需警惕房性心律失常发生的风险,进一步强调了监测NSTEMI患者TH水平的重要性。同时Roberts等人研究表明[18],TSH和FT4随时间推移显示出显著的稳定性,在5年的时间间隔内61%的参与者复测TSH浓度在原始结果的0.5 mIU/L之内。在不增加风险的情况下,减少老年人的重复测量的可能性是可行的。因此,无论是SH对NSTEMI患者心律失常事件发生的危险性以及TH的可监控性均提示可以通过监测TH水平来优化NSTEMI患者的管理。
本文研究也存在着以下不足:首先,本临床研究样本量相对较小,单中心,可能对结果造成一定的影响。同时,遗憾的是,本次研究未能收集到FT3、FT4等激素信息,未能进行进一步比较相关激素与NSTEMI患者预后的关系。此外,本次实验仅收集了入院24 h内的TH数据,没有对随访期间TH水平进行检测。仍需进行多中心、设计严谨的大型临床实验进一步证实研究结果,以便更好的识别高危NSTEMI患者,并对临床治疗做出指导,从而使更过的患者获益。
与EU组相比,SH组患者出现窦性心动过缓、心房扑动等心律失常风险增高。此外,TT4是房性心律失常复合事件的危险因素。提前识别SH,并监测NSTEMI患者的甲状腺功能是十分必要的,有助于提前识别高危患者。必要时予对症治疗,调节TH水平,可能会使更多的患者获益。
