miR-127-3p在动脉粥硬化中的表达及干扰miR-127-3p对PDGF-BB处理的HAoSMC增殖迁移的影响
2021-04-07缪丹丹张宁宋欢欢赵少华金玉柴建文
缪丹丹,张宁,宋欢欢,赵少华,金玉,柴建文
动脉粥样硬化(AS)是一种病因复杂的血管壁慢性疾病,平滑肌细胞作为血管壁的重要成分,可调节血管的收缩舒张功能,同时也分泌多种细胞因子,血管平滑肌细胞(VSMC)的异常增殖和迁移是AS发病的重要因素[1,2]。研究报道miRNAs可通过调控血脂代谢,内皮细胞的功能,血管平滑肌细胞的增殖和迁移,血管的炎症等参与调控AS[3,4]。研究报道miRNA-127-3p在AS患者及AS合并阻塞性睡眠呼吸暂停(OSA)患者血清中高表达,miR-127-3p可能是OSA患者发生AS的早期预警标志[5]。然而miR-127-3p对AS进展及血管平滑肌细胞增殖、迁移的影响及其机制尚不清楚。研究报道血小板衍生生长因子-BB(PDGFBB)可促进平滑肌细胞的增殖与迁移[6]。因此本实验用PDGF-BB处理人主动脉平滑肌细胞(HAoSMC),研究miR-127-3p对HAoSMC增殖、迁移的影响及其机制。
1 材料与方法
1.1 材料收集2017年1月至2019年12月于郑州人民医院心内科就诊的动脉粥硬化患者38例,所有患者均行冠状动脉(冠脉)造影检查,排除肝肾疾病、各种心肌病、炎性疾病及恶性肿瘤等;从体检中心选择同期健康者22例作为正常对照组,所有研究对象均留取晨起空腹静脉血5 ml,常温下3500 r/min离心10 min分离血浆,血浆样本于-80℃保存备用。本研究经医院伦理委员会批准,所有研究对象均知情同意。
1.2 细胞与主要试剂人主动脉平滑肌细胞(HAoSMC)购自德国PromoCell公司;DMEM培养基、胎牛血清、胰蛋白酶购自美国Gibco公司;血小板源性生长因子-BB(PDGF-BB)购自北京博尔西科技有限公司;Trizol试剂、反转录试剂盒、实时荧光定量试剂盒购自日本TaKaRa公司;miRNseasy Mini Kit试剂盒购自德国Qingen公司;四甲基偶氮唑盐比色法(MTT)试剂盒购自上海拜力生物科技有限公司;Transwell小室购自美国Bio-Rad公司;4%多聚甲醛、1%结晶紫购自北京索莱宝科技有限公司;RIPA蛋白裂解液、二辛可宁酸(bicinchoninic acid,BCA)试剂盒、ECL发光液购自北京百奥莱博科技有限公司;抗体购自上海信裕生物科技有限公司。
1.3 细胞培养与分组将HAoSMC接种在含10%胎牛血清的DMEM培养基上,在37℃、5%CO2条件下培养,2 d换液一次,待细胞融合至90%左右时,用胰蛋白酶消化传代,取对数生长期细胞进行实验。将HAoSMC随机分为对照组、模型组、antimiR-NC组、anti-miR-127-3p组;对照组不作任何处理,模型组用25 μg/L PDGF-BB处理24 h;antimiR-NC组和anti-miR-127-3p组中分别转染miR-127-3p抑制剂对照(anti-miR-NC)和miR-127-3p抑制剂(anti-miR-127-3p)后再用25 μg/L PDGFBB处理24 h。
1.4 实时荧光定量PCR(RT-qPCR)检测miR-127-3p和NF-κB mRNA表达水平取冻存血浆,利用miRNseasy Mini Kit试剂盒提取血浆中总RNA,Trizol试剂提取细胞总RNA,反转录成cDNA,进行PCR,反应条件为95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环;60 ℃延长5 min。相对表达量用2-△△Ct法计算。miR-127-3p和NF-κB分别以U6和GAPDH为内参,miR-127-3p上游引物序列:5'-ACACTCCAGCTG GGTCGGATCCGTCTGAGC-3',下游引物序列:5'-TGGTGTCGTGGAGTCG-3';U6上游引物序列:5'-CTCGCTTCGGCAGCACA-3',下游引物序列:5'-AACGCTTCACGAATTTGCGT-3';NF-κB上游引物序列:5'-CTGAACCAGGGCATACCTG T-3',下游引物序列:5'-GAGAAGTCCATGTCC GCAAT-3';GAPDH上游引物序列:5'-TCCTCT GACTTCAACAGCGACACC-3',下游引物序列:5'-TCTCTCTTCCTCTTGTGCTCTTGG-3'。
1.5 流式细胞仪检测细胞周期各组细胞培养48 h后收集细胞,并制备单细胞悬液,加入3 ml预冷的70%乙醇固定,用缓冲液洗涤后加入核糖核酸酶A(RNase A)于37℃水浴30 min,加入400 μl碘化啶(PI),4℃避光30 min,上机检测激发波长488 nm处红色荧光,重复3次。用流式细胞仪和DNA细胞周期分析软件对细胞周期进行检测分析。
1.6 MTT检测细胞增殖在各组细胞培养至48 h时,每孔分别加入5 mg/ml的MTT溶液20 μl,于培养箱中继续孵育4 h后弃去上清液,每孔加入DMSO150 μl,振荡反应10 min使沉淀溶解,用酶标仪于波长490 nm处检测吸光度(OD)值。
1.7 Transwell检测细胞迁移收集各组细胞,无血清培养后,取200 μl接种于Transwell小室上层,培养24 h后,吸去培养液后用棉签擦去上层细胞,PBS洗涤,4%多聚甲醛固定30 min,0.1%结晶紫染色10 min,显镜下拍照并计数发生迁移的细胞数量
1.8 蛋白质印迹(Western blot)法检测Ki67、N-cadherin、E-cadherin蛋白表达提取各组细胞总蛋白,用BCA试剂盒进行蛋白定量。各组蛋白上样量50 μg,SDS-PAGE后,经电转将蛋白转移至PVDF上。用5%脱脂牛奶室温封闭90 min,分别加入相应的一抗(1:800),4℃孵育过夜,PBS洗涤3次,每次5 min;再加入二抗(1;1200)室温孵育2 h,PBS洗涤3次,每次10 min,后在暗室中显影、定影,成像后用Quantity One软件处理,测定各组蛋白条带的灰度值,以目的条带和GAPDH条带的比值作为蛋白表达水平。
1.9 统计学分析采用SPSS 20.0软件进行统计学分析,计量资料用均数±标准差(±s)表示,两组比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-127-3p在AS患者中的表达与正常对照组相比,AS患者中miR-127-3p表达水平显著升高(P<0.05,表1)。
2.2 PDGF-BB处理对HAoSMC增殖迁移及miR-127-3p表达的影响与对照组相比,模型组miR-127-3p表达水平升高,G0-G1期细胞所占比例降低,S期细胞所占比例升高,细胞OD值升高,迁移细胞数增加,Ki67、N-cadherin表达水平升高,E-cadherin表达水平降低(P<0.05,图1,表2)。
2.3 抑制miR-127-3p对PDGF-BB处理对HAoSMC增殖的影响与anti-miR-NC组相比,anti-miR-127-3p组G0-G1期细胞所占比例升高,S期细胞所占比例降低,细胞OD值降低,Ki67表达水平降低(P<0.05,图2,表3)。
表1 miR-127-3p在动脉粥硬化患者中的表达(±s)

表1 miR-127-3p在动脉粥硬化患者中的表达(±s)
注: AS:动脉粥样硬化;与正常对照组相比,aP<0.05
组别 n miR-127-3p正常对照组 22 1.03±0.37 AS患者 38 2.83±0.86a t值 - 9.305 P值 - 0.000
2.4 抑制miR-127-3p对PDGF-BB处理迁移的影响与anti-miR-NC组相比,anti-miR-127-3p组miR-127-3p表达水平降低,迁移细胞数减少,N-cadherin表达水平降低,E-cadherin表达水平升高(P<0.05,图3,表4)。
2.5 抑制miR-127-3p对PDGF-BB处理对HAoSMC中NF-κB的影响与anti-miR-NC组相比,anti-miR-127-3p组NF-κB mRNA表达水平降低(P<0.05,表5)。
3 讨论
AS是心脑血管疾病发生发展的重要原因之一,严重危害人类身体健康,其发病机制复杂,掌握其发生发展机制对治疗相关疾病具有重要意义[7]。VSMC与AS的发病密切相关,平滑肌细胞迁移入内膜并增殖,摄取修饰的脂质转化为巨噬细胞进而形成泡沫细胞是斑块形成的原因之一,因此,可通过抑制平滑肌细胞异常增殖来延缓AS的发生及发展[8]。研究表明PDGF-BB可诱导VSMC增殖、迁移的发生[9]。本实验用PDGFBB处理HAoSMC,结果显示,G0-G1期细胞所占比例降低,S期细胞所占比例升高,细胞OD值升高,迁移细胞数增加,Ki67、N-cadherin表达水平升高,E-cadherin表达水平降低。说明PDGFBB可诱导HAoSMC细胞周期阻滞,抑制细胞增殖、迁移。
表2 PDGF-BB处理对HAoSMC增殖迁移及miR-127-3p表达的影响(±s,n=9)

表2 PDGF-BB处理对HAoSMC增殖迁移及miR-127-3p表达的影响(±s,n=9)
注:G1:DNA合成前期;S:DNA合成期;G2:DNA合成后期;Ki67:核增殖抗原;N-cadherin:N-钙粘蛋白;E-cadherin:E-钙粘蛋白;与对照组相比,aP<0.05
组别 miR-127-3p G0-G1 S G2-M OD值 迁移细胞数 Ki67 N-cadherin E-cadherin对照组 1.01±0.06 34.25±3.27 33.27±3.19 32.48±3.01 0.53±0.04 78.61±6.77 0.38±0.02 0.19±0.01 0.62±0.03模型组 2.76±0.12a 25.51±2.57a 41.88±3.87a 32.61±3.89 1.22±0.10a 155.74±9.37a 0.79±0.04a 0.75±0.03a 0.16±0.02a t值 39.131 6.304 5.150 0.079 19.219 20.017 27.504 53.126 38.274 P值 0.000 0.000 0.000 0.938 0.000 0.000 0.000 0.000 0.000

图1 PDGF-BB处理对HAoSMC中Ki67、N-cadherin、E-cadherin蛋白表达的影响
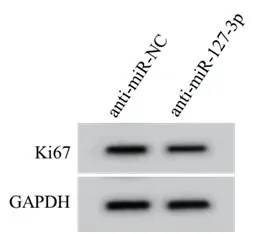
图2 抑制miR-127-3p对PDGF-BB处理对HAoSMC中Ki67蛋白表达的影响
表3 抑制miR-127-3p对PDGF-BB处理对HAoSMC增殖的影响(±s,n=9)
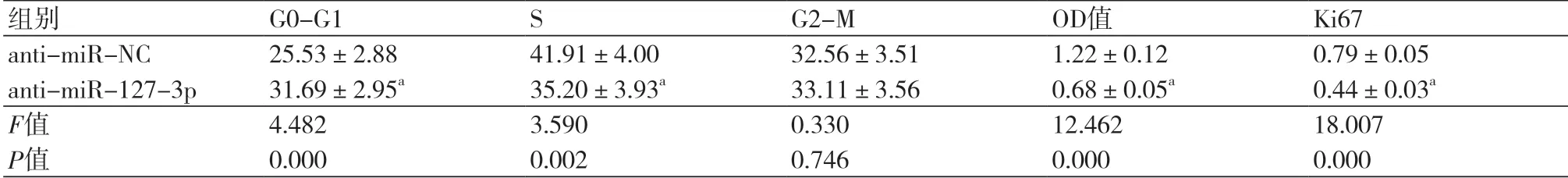
表3 抑制miR-127-3p对PDGF-BB处理对HAoSMC增殖的影响(±s,n=9)
注:Ki67:核增殖抗原;与anti-miR-NC组相比,aP<0.05
组别 G0-G1 S G2-M OD值 Ki67 anti-miR-NC 25.53±2.88 41.91±4.00 32.56±3.51 1.22±0.12 0.79±0.05 anti-miR-127-3p 31.69±2.95a 35.20±3.93a 33.11±3.56 0.68±0.05a 0.44±0.03a F值 4.482 3.590 0.330 12.462 18.007 P值 0.000 0.002 0.746 0.000 0.000

图3 抑制miR-127-3p对PDGF-BB处理对HAoSMC中N-cadherin、E-cadherin蛋白表达的影响
表4 抑制miR-127-3p对PDGF-BB处理对HAoSMC迁移的影响(±s,n=9)

表4 抑制miR-127-3p对PDGF-BB处理对HAoSMC迁移的影响(±s,n=9)
注:N-cadherin:N-钙粘蛋白;E-cadherin:E-钙粘蛋白;与anti-miR-NC组相比,aP<0.05
组别 miR-127-3p 迁移细胞数 N-cadherin E-cadherin anti-miR-NC 0.96±0.05 155.74±9.74 0.75±0.04 0.15±0.02 anti-miR-127-3p 0.33±0.04a 92.25±6.31a 0.28±0.02a 0.41±0.03a t值 29.517 1.222 31.529 21.633 P值 0.000 0.239 0.000 0.000
表5 抑制miR-127-3p对PDGF-BB处理对HAoSMC中NF-κB的影响(±s,n=9)
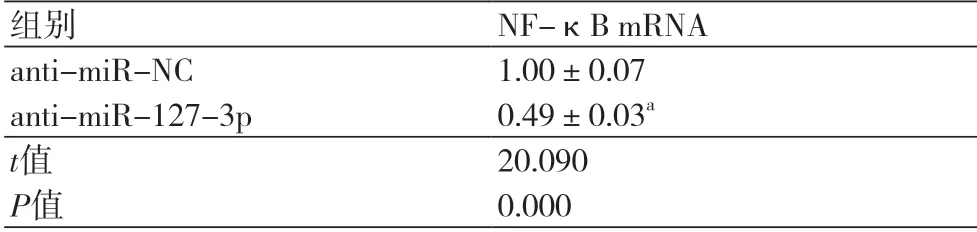
表5 抑制miR-127-3p对PDGF-BB处理对HAoSMC中NF-κB的影响(±s,n=9)
注:NF-κB:核转录因子;与anti-miR-NC组相比,aP<0.05
组别 NF-κB mRNA anti-miR-NC 1.00±0.07 anti-miR-127-3p 0.49±0.03a t值 20.090 P值 0.000
研究表明miRNA参与AS的发生发展过程,可作为AS的诊断生物标志物[10]。miRNAs对心血管平滑肌细胞功能起重要的调节作用,如miR-145能够抑制大鼠脑动脉VSMC增殖和迁移[11]。miR-181a-5p可抑制PDGF-BB诱导VSMC的增殖、迁移和颈动脉损伤新生内膜的形成[12]。以上研究表明miRNA可调控VSMC的增殖、迁移。然而miR-127-3p对VSMC的增殖、迁移的影响还尚未可知。本实验结果显示,AS患者血清中及PDGFBB处理HAoSMC中miR-127-3p表达水平升高,说明miR-127-3p可能与AS相关。为进一步研究miR-127-3p对PDGF-BB处理HAoSMC的影响,本实验干扰miR-127-3p的表达,结果显示,G0-G1期细胞所占比例升高,S期细胞所占比例降低,细胞OD值降低,迁移细胞数减少,Ki67、N-cadherin表达水平降低,E-cadherin表达水平升高、说明干扰miR-127-3p表达可抑制PDGF-BB诱导的HAoSMC增殖和迁移。miR-127-3p可能通过调控HAoSMC增殖和迁移影响AS进展。
研究表明核因子-κB(NF-κB)信号通路与VSMC的增殖、迁移相关,阻断NF-κB信号通路可抑制VSMCs的增殖和迁移[13]。Klotho通过NF-κB信号通路调节Bcl-2相关的致癌基因3(BAG3)表达抑制大鼠平滑肌细胞的增殖、迁移[14]。SIRT1可通过抑制NF-κB信号通路抑制VSMC源性泡沫细胞形成[15]。以上研究表明NFκB信号通路与VSMC的增殖、迁移及泡沫细胞的形成有关。本实验结果显示,干扰miR-127-3p表达,NF-κB mRNA表达水平降低,说明干扰miR-127-3p表达可能抑制NF-κB信号通路。
综上所述,干扰miR-127-3p表达可抑制PDGF-BB诱导的HAoSMC增殖、迁移,其机制可能与抑制NF-κB信号通路有关。
