胃癌预后预测生物标志物和治疗靶点的筛选与研究
2021-04-07陈焕庭贺德
陈焕庭 贺德
尽管越来越多的研究关注胃癌治疗的新策略,近年来胃癌发病率也逐步下降,但由于缺乏有效的治疗策略和预后标志物,胃癌患者的治疗和预后仍不乐观。通过检测生物标志物表达高低预测患者预后,对预后不良的患者进行更频繁的复查随访,及时发现不良征兆并进行干预,以提高患者的存活率。过去几十年里,新型治疗靶点的发现和新型靶向药物的开发已大大改变了抗肿瘤战场的局面。因此,探索新的有效的生物标志物预测胃癌预后,寻找新的治疗靶点对改善胃癌患者的预后极为重要。
1 临床资料
1.1 基因芯片与差异基因筛选 在NCBI-GEO 数据库中筛选出包含胃癌组织和正常组织基因表达谱的芯片GSE19826、GSE54129、GSE79973,所筛选的芯片均来自GPL570 检测平台,用GEO2R 工具检测胃癌和正常对照中的差异表达基因(DEGs),筛选标准为:|logFC|>2 和调整P 值<0.05,再绘制韦恩图选出3 个芯片中共同在胃癌组织中高表达的基因。
1.2 基因表达分析及生存分析 通过GEPIA 数据库(http://gepia.cancer-pku.cn/)筛选胃癌高表达基因进行表达谱数据动态分析。借助Kaplan-Mei⁃er Plotter(www.kmplot.com)数据库中胃癌临床资料分析基因表达与胃癌患者总生存期的相关性。
1.3 功能及富集分析 通过HCMBD(Human Cancer Metastasis Database)数据库对胃癌中每个上调的基因进行功能分析。通过Metascape(http://metascape.org)数据库对各个上调的基因进行基因本体(细胞组分、分子功能、生物过程)和通路富集的分析。
1.4 统计学分析 采用Graphpad Prism 统计学软件进行数据处理、图像绘制及统计学分析,计量资料两组间比较采用t 检验;基因表达与胃癌临床病理指标的相关性分析采用χ2检验。采用Ka⁃plan-Meier 法绘制生存曲线,并进行Log-rank 检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 胃癌中高表达基因筛选 筛选出基因芯片中胃癌组织相对正常胃组织上调和下调的基因,再通过绘制韦恩图筛选出在这三张芯片中均上调(图1A)和下调的(图1B)基因的。其中,26 个高表达 的 基 因 是ADAMTS2、ASPN、BGN、CEMIP、COL1A1、COL1A2、COL6A3、COL8A1、COL10A1、COL11A1、CST1、CTHRC1、FAP、FNDC1、IGF2BP3、INHBA、MFAP2、PDLIM7、RARRES1、SFRP4、SPP1、SULF1、THBS2、THY1、TIMP1、WISP1。
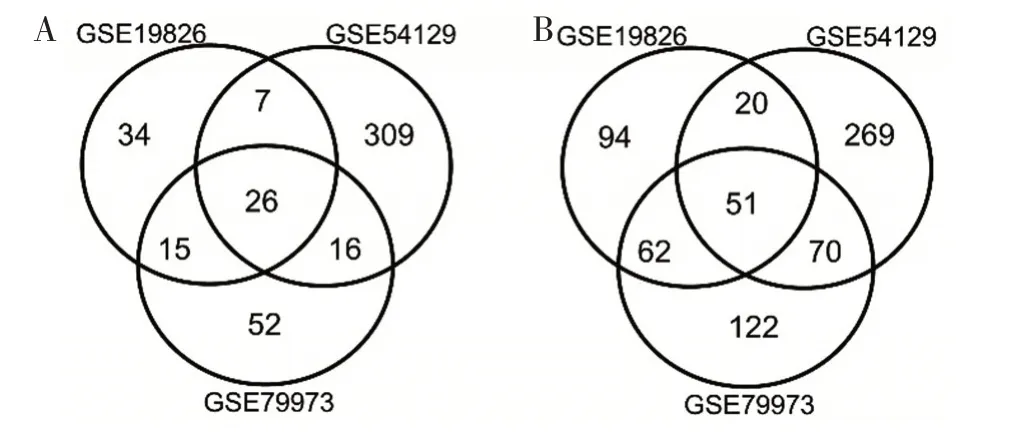
图1 通过韦恩图筛选出三张基因芯片胃癌中均高表达的基因(图A)和低表达的基因(图B)
2.2 高表达基因在胃癌中再分析 通过GEPIA数据库进一步验证这26 个上调的基因在胃癌组织和正常胃组织中的mRNA 水平表达。考虑胃腺癌是胃癌中最常见的病理类型,我们选择胃腺癌数据进行分析。如图2 所示,这26 个基因除FDLIM7 外,其余25 个基因在胃癌中高表达。进一步我们分析了基因随着胃癌疾病进展的表达变化。其中有22 个随着胃癌疾病进展表达逐渐升高的基因(ASPN、BGN、CEMIP、COL1A1、COL1A2、COL6A3、COL8A1、COL10A1、COL11A1、CTHRC1、FAP、FNDC1、INHBA、MFAP2、RARRES1、SFRP4、SPP1、SULF1、THBS2、THY1、TIMP1、WISP1)。
2.3 胃癌中高表达基因的预后价值 在Kaplan-Meier Plotter 数据库中绘制生存曲线评估这26 个基因的mRNA 表达高低与胃癌患者总生存的相关性。如图4 所示,23 个基因的表达与OS 呈显著负相关,这23 个基因为ADAMTS2、ASPN、BGN、CE⁃MIP、 COL1A1、 COL1A2、 COL6A3、 COL8A1、COL10A1、COL11A1、CST1、CTHRC1、FNDC1、IGF2BP3、INHBA、MFAP2、RARRES1、SFRP4、SULF1、THBS2、THY1、TIMP1、WISP1。 FAP 和SPP1 的表达与胃癌总生存无相关性。
2.4 胃癌中高表达基因的功能分析 接着,我们通过HCMBD(Human Cancer Metastasis Database)数据库检索了26 个胃癌中上调基因的功能。其中与肿瘤相关基因有BGN、CTHRC1、INHBA、TH⁃BS2、THY1、TIMP1、WISP1。BGN 编码的蛋白可调节炎症和先天免疫功能。CTHRC1 编码的蛋白参与血管重塑,该基因位点突变与Barrett 食管和食管腺癌相关。INHBA 表达升高可能与人类患者的癌症恶病质有关。THBS2 编码的蛋白介导细胞与细胞和细胞与基质的相互作用,并参与细胞粘附和迁移。THY1 编码的蛋白参与许多细胞黏附和通讯的生理活动,该基因可能在鼻咽癌中起抑癌作用。TIMP1 编码的蛋白是降解细胞外基质的肽酶-基质金属蛋白酶(MMPs)抑制剂。WISP1 可能位于WNT1 信号通路的下游。
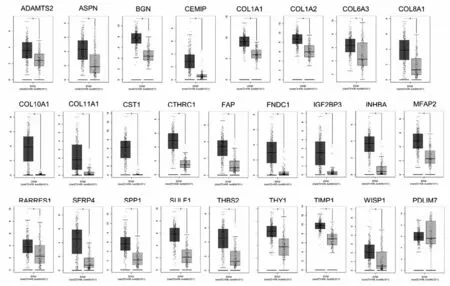
图2 26 个基因在胃癌组织和正常胃组织中的mRNA 水平表达

图3 基因表达与胃癌患者的生存分析
此外,我们还借助Metascape 工具对这26 个基因进行了功能富集分析。图4 显示了这26 个基因参与的生理过程,这些生理过程都与肿瘤的发生发展密切相关。
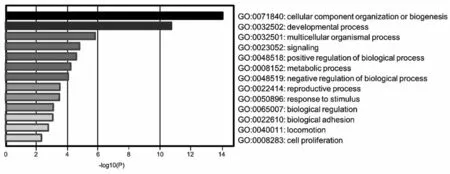
图4 胃癌中上调基因的功能富集分析
3 讨 论
借助基因芯片挖掘有价值的基因表达信息,能够在大量基因中快速识别不同组别之间差异表达基因,联合生物信息学方法可以进一步研究和深入挖掘。在本研究中,我们通过基因芯片和公共数据库的临床资料筛选出23 个基因可作为胃癌预后预测生物标志物。临床上,如果胃癌患者具有高表达的这23 个基因,那么这部分患者可能预后较差。结合这23 个基因的功能,我们初步推测BGN、CTHRC1、INHBA、THBS2、THY1、TIMP1、WISP1 可以作为潜在的胃癌治疗靶点。然而,这些结论还需要进一步的实验验证。此外,我们只关注这些基因的mRNA 水平而非蛋白水平的表达,也需要进一步研究这些基因的蛋白表达水平和相应的功能。我们目前的结果为后续更深入的基础研究提供重要方向和信息。
既往研究显示这7 个基因与胃癌发生发展有着密切联系。例如,BGN 是细胞外基质的重要组成部分,在多种肿瘤中发挥作用,在胃癌中过表达可促进肿瘤的转移[1]。CTHRC1 在多种恶性细胞中表达,胃癌中过表达通过激活HIF1α/CXCR4 信号通路显著提高细胞迁移和侵袭能力[2]。INHBA基因沉默会抑制TGF-β 信号通路的激活,从而抑制胃癌细胞的迁移和侵袭,并通过小鼠动物实验证实,该研究作者认为INHBA 是胃癌潜在的治疗靶点[3]。沉默THBS2 基因可以通过PI3K-Akt 信号通路抑制胃癌细胞的增殖、迁移和侵袭,促进胃癌细胞凋亡[4]。THY1 介导Notch 信号通路可促进胃癌细胞的生长和迁移[5]。TIMP1 在小鼠和人胃癌细胞中通过NF-κB 依赖机制过表达并促进胃癌的生长[6]。WISP1 在多种人类恶性肿瘤中上调,并与疾病进展相关。在胃癌中,WISP1 表达显著上调与肿瘤进展、化疗结果和预后相关[7]。因此,我们认为这几个基因有潜力成为预测胃癌总生存的生物标志物。
综上所述,我们发现7 个基因有希望成为胃癌预后预测生物标志物和治疗靶点。本研究结论可为胃癌患者的预后提供参考意见,以此开发新的胃癌靶向治疗药物,提高胃癌患者整体生存率和改善患者预后,具有一定的临床意义和应用价值。也为探讨胃癌的分子调控机制也提供了一定的实验方向。
