血清IL-4、VEGF水平与子宫内膜息肉患者宫腔镜术后复发的关系
2021-04-06宿彩密
宿彩密
(河南省职工医院妇产科,河南 郑州 450000)
子宫内膜息肉(Endometrial Polyps,EP)患者中无症状且息肉较小的患者可经保守治疗,但多数患者需进行手术治疗,宫腔镜手术切除是其中常见的手术方式,具有一定的治疗效果。但是,EP患者宫腔镜手术后复发风险较高,部分患者可能出现多次复发,无法根治,需要进行全子宫切除术,影响患者的生育[1]。因此,寻找与EP患者宫腔镜术后复发相关的因素较为重要,对预测复发风险,指导术后管理。在EP的发生发展中,子宫内膜血管异常增殖具有重要的作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)促进血管生长,增加子宫内膜新生血管,利于子宫内膜基质细胞的生长,促进EP的发生发展,可能与EP患者宫腔镜术后复发有关[2]。研究表明,免疫失衡及炎症反应也会刺激子宫内膜,促进子宫内膜增生物的生长[3]。白细胞介素4(Interleukin-4,IL-4)是常见的炎性因子,可能也与EP患者宫腔镜术后复发有关。目前分析两者与EP患者宫腔镜术后复发关系的相关研究较少。基于此,本研究对此进行分析,为后续预防EP患者宫腔镜术后复发提供参考。
1 资料与方法
1.1 一般资料 本研究经医院医学伦理委员会审核通过,前瞻选择2019年5月至2020年5月121例宫腔镜手术治疗的EP患者作为研究对象。研究对象均为女性,年龄22~45岁,平均年龄(31.19±4.55)岁;息肉最大直径0.98~7.68 cm,平均息肉最大直径(2.17±0.38)cm,;患者与家属均知情且自愿签署同意书。
1.2 入选标准
1.2.1 纳入标准 ⑴符合《妇科内镜学》[4]中EP诊断标准;⑵术前宫腔镜检查、术后病理确诊为EP;⑶单发;⑷完成宫腔镜术治疗。
1.2.2 排除标准 ⑴合并子宫腺肌症、子宫内膜异位症等;⑵合并妇科肿瘤疾病;⑶合并生殖系统器质性病变或炎症;⑷参加过其他药物试验;⑸近期(3个月内)服用激素药物;⑹失访。
1.3 方法
1.3.1 血清IL-4、VEGF水平检测方法 入院时,采集2 ml空腹静脉血,以3000 r/min离心20 min,分装试管,置于-80℃待检,用上海酶联生物提供的试剂盒,以酶联免疫吸附实验法检测血清IL-4、VEGF水平。
1.3.2 治疗方法 参考《妇科内镜学》,对所有EP患者实施宫腔镜手术治疗,宫腔镜检查后行宫腔镜下子宫内膜息肉去除术。
1.3.3 分组方法 宫腔镜手术治疗完成后,随访1年,统计复发情况,将复发的患者纳入复发组,未复发的患者纳入无复发组。
1.4 统计学方法 采用SPSS24.0软件进行数据处理,计数资料用百分比表示,采用χ2检验,检验,若期望值<5,采用连续校正卡方检验;计量资料均经Shapiro-Wilk正态性检验,正态分布计量资料以±s表示,组间用独立样本t检验;采用Logistic回归分析检验血清IL-4、VEGF水平与EP患者宫腔镜术后复发的关系,绘制受试者工作曲线(ROC),并计算曲线下面积(AUC)值,检验血清IL-4、VEGF水平预测EP患者宫腔镜术后复发的价值,AUC值>0.9表示预测性能较高,0.71~0.90表示有一定预测性能,0.5~0.7表示预测性能较低,<0.5表示无预测性能,P<0.05为差异有统计学意义。
2 结果
2.1 术后复发情况与基线资料比较 本研究内121例EP患者中,22例患者在术后1年内复发,复发率为18.18%(22/121)。复发组息肉最大直径大于无复发组,血清IL-4、VEGF水平高于无复发组,差异有统计学意义(P<0.05),其余资料对比,差异无统计学意义(P>0.05)。见表1。
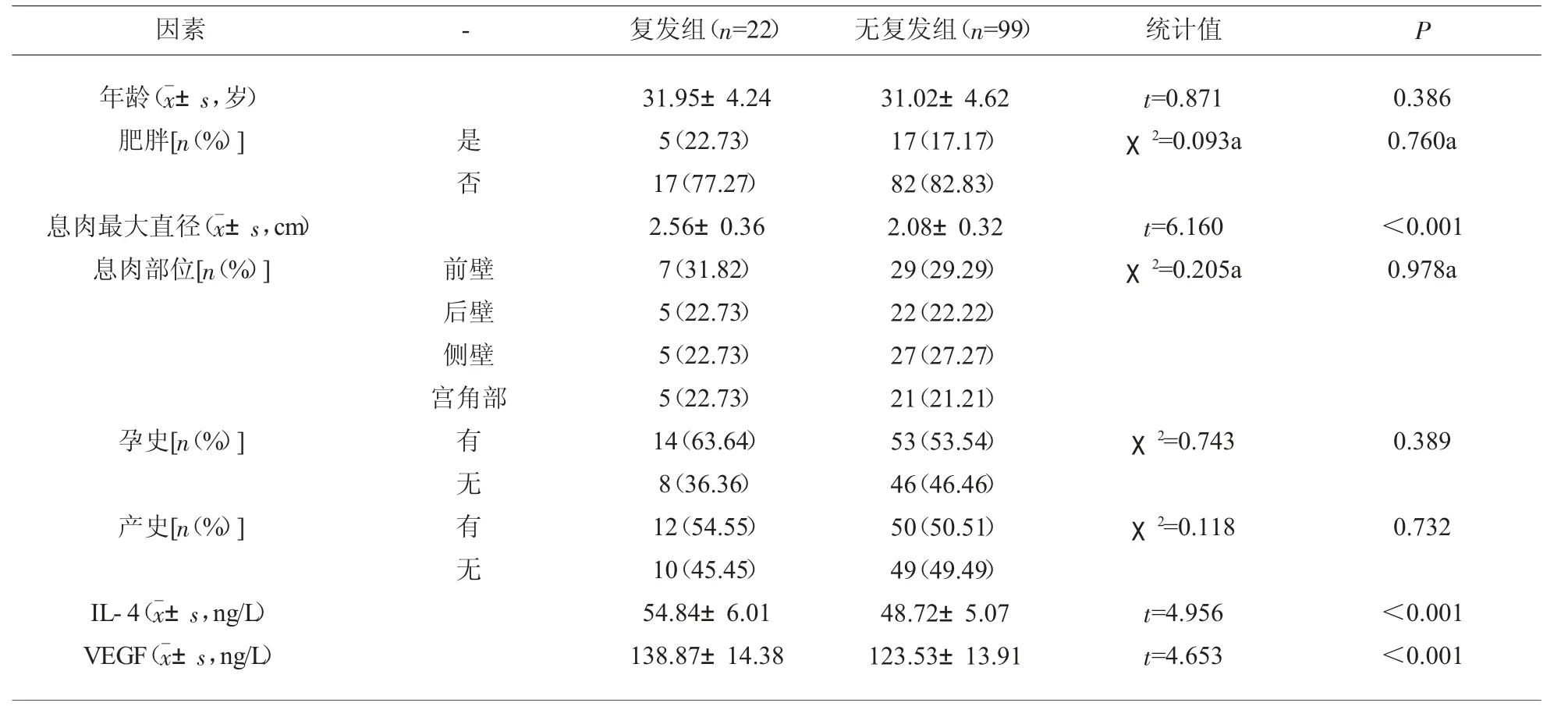
表1 基线资料与血清指标
2.2 血清IL-4、VEGF水平与EP患者宫腔镜术后复发的关系 将2.2中比较结果显示差异有统计学意义的变量纳入作为自变量,将EP患者宫腔镜术后复发作为因变量(1=复发,0=未复发),经Logistic回归分析检验结果显示,息肉最大直径、入院时血清IL-4、VEGF水平与EP患者宫腔镜术后复发有关,息肉最大直径大,血清IL-4、VEGF高可能是EP患者宫腔镜术后复发的风险因子(OR>1,P<0.05)。见表2。

表2 血清IL-4、VEGF水平与EP患者宫腔镜术后复发的关系
2.3 血清IL-4、VEGF水平预测EP患者宫腔镜术后复发的价值 将EP患者宫腔镜术后复发作为状态变量(1=复发,0=未复发),将入院时血清IL-4、VEGF水平作为检验变量,绘制ROC曲线图,见图1,结果显示,入院时血清IL-4、VEGF水平单独及联合预测EP患者宫腔镜术后复发的AUC分别为0.788、0.782、0.837,均有一定预测价值,且当二者的cut-off值分别取51.305 ng/L、132.245 ng/L时,可获得最佳预测价值。见表3。
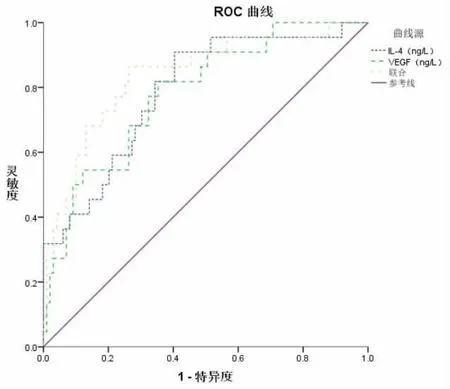
图1 血清IL-4、VEGF水平预测EP患者宫腔镜术后复发的ROC曲线

表3 血清IL-4、VEGF水平预测EP患者宫腔镜术后复发的价值
3 讨论
宫腔镜手术是EP患者的常见治疗方式,具有确切的治疗效果,但是术后可能有部分患者再次复发,影响预后情况[5]。因此,早期预测EP患者宫腔镜手术后复发对患者术后管理较为重要,利于改善患者预后。
本研究结果显示,研究内121例EP患者中,22例患者在术后1年内复发,复发率为18.18%(22/121)。说明EP患者宫腔镜手术后复发风险较高,有必要分析与EP患者宫腔镜手术后复发有关的因素。EP的发生发展与炎症、免疫状态具有紧密的联系,IL是重要的炎症反应因子,影响机体的免疫状态[6]。IL-4是常见的炎性因子,可能与EP患者宫腔镜手术后复发有关。VEGF属于血管内皮的生长因子,在子宫内膜的上皮细胞、间质细胞等均有表达,能结合血管内皮细胞的特异性受体,发挥促进血管内皮细胞分裂的作用,加快毛细血管生长,可能促进EP患者息肉生长,与宫腔镜手术后复发有关[7]。本研究结果显示,复发组血清IL-4、VEGF水平高于无复发组,进一步经Logistic回归分析检验结果显示,血清IL-4、VEGF水平与EP患者宫腔镜术后复发有关,入院时血清IL-4、VEGF高可能是EP患者宫腔镜术后复发的风险因子。说明,血清IL-4、VEGF水平高可能影响EP患者宫腔镜术后复发。分析原因可能为:血清IL-4水平异常与炎症因子水平失衡、宫腔炎症反应具有重要的关系,炎症可能刺激雌孕激素分泌紊乱,增加子宫内膜病变的发生风险,诱导EP复发。而且,炎症因子、免疫失衡会使异常的子宫内膜细胞逃避免疫监视,影响治疗对息肉组织的清除作用,造成残留组织重新生长,导致EP复发[8]。IL-4是辅助型T细胞2(T helper 2 cell,Th2)的特异性细胞因子,分泌生成于嗜酸性细胞、肥大细胞等,具有多种功能,调节多种细胞的生长或功能[9]。IL-4能抑制辅助型T细胞1(T helper 2 cell,Th1)细胞生成,而Th1细胞的特异性细胞因子γ干扰素(interferon-γ,IFNγ)具有抑制血管内皮细胞生长和促进其凋亡的作用,能抑制新生血管,若血清IL-4水平高可能会削弱IFN-γ的功能,增加新生血管,导致EP复发[10]。子宫内膜息肉的生长和血管密不可分,子宫肌层的血管进入息肉组织会促进其生长[11]。而血管的新生与细胞外基质降解和血管内皮细胞的增殖、分化等多个方面有关,受多种生长因子、细胞因子的调控[12]。VEGF是一种生长因子,对血管内皮细胞具有特异性作用,也是刺激血管生成的关键的因子[13]。若血清VEGF水平高,可能会促进残留息肉组织新生血管的生长,而微血管的出现能促进纤维蛋白原的通过,增加血浆外渗,积蓄细胞外基质,造成组织水肿,导致宫腔镜术后EP复发[14]。VEGF的旁分泌、自分泌方式均可刺激内皮细胞分裂,进一步诱导新生血管,增加功能、结构异常的新生血管生成,增加组织水肿,扩大局部张力,挤压宫颈上皮造成破裂,重新诱导息肉的形成,增加宫腔镜术后EP复发的风险[15]。另外,本研究绘制ROC曲线图,结果显示,入院时血清IL-4、VEGF水平单独及联合预测EP患者宫腔镜术后复发的AUC分别为0.788、0.782、0.837,均有一定预测价值。
综上所述,血清IL-4、VEGF高可能是EP患者宫腔镜术后复发的风险因子,可用于预测EP患者宫腔镜术后复发。
