姬松茸多糖提取物对高脂血症大鼠降血脂作用研究
2021-04-02卢学春李雨鑫刘馨竹杜培革安丽萍
李 晓,卢学春,李雨鑫,刘馨竹,杜培革,安丽萍,*
(1.北华大学 药学院,吉林省 吉林市 132013;2.中国人民解放军总医院 血液科,北京 100853)
姬松茸(AgaricusblazeiMurill,ABM),又称巴西蘑菇、小松菇、柏氏蘑菇,是一种食药兼用的名贵真菌[1],姬松茸多糖(Agaricusblazeipolysaccharide,ABP)是其主要活性成分之一。ABP具有抗氧化、降血脂、增强机体免疫力等[2-4]多种作用。
高脂血症是一种常见和多发的脂代谢异常性疾病,可以引发脂肪肝、动脉粥样硬化、冠心病等心脑血管疾病等,严重危害人类身体健康[5]。高脂血症的发生是由于脂肪的代谢或者转运异常,使血清中一种或者多种脂质高于正常范围,主要是以总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)升高,高密度脂蛋白胆固醇(HDL-C)降低为主要特征[6]。调节脂质代谢对预防和治疗高脂血症尤为重要。研究发现,天然产物中含有大量具有降血脂作用的物质,以天然产物中活性成分预防高脂血症及相关疾病已成为现代生物研究领域的热点[7]。大量研究表明,ABP具有降血脂活性,但是真菌多糖结构复杂,化学成分、结构和构象在很大程度上决定其生物活性。本研究团队前期工作证明,ABP在体外具有抗氧化作用,可以减少油酸诱导的HepG2高脂细胞模型内脂滴堆积,降低细胞内TC和TG含量,说明ABP可能具有调节血脂的作用,但其具体降血脂成分和机制尚不明确。
本研究拟提取分离ABP,并对其进行DEAE-纤维素离子交换柱层析分级,得到进一步纯化的姬松茸酸性多糖级分(ABP-A),利用高脂饮食诱导高脂血症大鼠模型,从生化指标、肝脏病理变化及肝脏代谢因子的表达水平,初步探讨ABP-A降血脂的作用及机制。希望为进一步开发姬松茸相关功能食品和药品提供实验基础和理论参考,促进姬松茸的深度开发。
1 材料与方法
1.1 实验材料
1.1.1实验动物和材料
SPF级雄性Wistar大鼠,体重180~200 g,32只,实验动物许可证编号为SCXK(吉)-2016-0003。姬松茸,江苏省苏威微生物研究有限公司,北华大学药学院生药教研室鉴定为姬松茸(AgaricusblazeiMurill,ABM)的干燥子实体;基础饲料,长春亿斯实验动物技术有限责任公司;DEAE-纤维素、琼脂糖凝胶CL-6B,美国Sigma-Aldrich公司;葡萄糖标准品,北京索莱宝科技有限公司;TC、TG、HDL-C、LDL-C ELISA试剂盒,武汉爱博泰克生物科技有限公司;低密度脂蛋白(LDL-R)、固醇调节原件结合蛋白(SREBP-1C)、胆固醇7a-羟化酶(CYP7a-1)、过氧化物酶体增殖物激活受体α(PPAR-α)、B类清道夫F(SCARB-1F)、GAPGH引物,北京鼎盛昌盛生物技术有限公司;RNA提取试剂盒、One Step RT-PCR Kit试剂盒,诺唯赞生物科技有限公司。其他试剂均为分析纯。
1.1.2仪器与设备
BenchTop Pro型台式冷冻干燥机,美国Virtis公司;UV-2550型紫外可见分光光度计、LC-16型高效液相色谱仪,岛津国际贸易有限公司;Infinite M200型酶标仪,瑞士TECAN公司;A200型PCR仪,杭州朗基科学仪器有限公司;Champchemi Basic型全自动荧光及化学发光凝胶成像仪,北京赛智创业科技有限公司。
1.2 实验方法
1.2.1姬松茸多糖的提取及含量测定
将姬松茸子实体常温粉碎,过60目筛,按料液比1∶20(g∶mL)加入蒸馏水浸泡过夜,100 ℃浸提3 h,重复3次,过滤并合并滤液,于 60 ℃真空减压浓缩;加入4倍体积的无水乙醇沉淀过夜,沉淀物用乙醇洗后烘干,得到姬松茸粗多糖;蒸馏水溶解粗多糖后,用截留分子质量为3 500 Da的透析袋,于蒸馏水中透析48 h以除去小分子物质,-80 ℃冷冻干燥,得到精制后的ABP。分别采用苯酚- 硫酸法[8]、间羟基联苯法[9]、考马斯亮蓝法[10]分析ABP中糖、糖醛酸和蛋白质的含量,测定样品中灰分含量[11]。单糖成分分析采用HPLC系统(LC-10ATVP泵和SPD-10AVD紫外光检测器),Inertsil ODS-35色谱柱(4.6 mm×150 mm,5 μm),流动相为磷酸缓冲盐溶液(PBS 0.1 mol/L,pH值7.0)-乙腈(二者体积比为82∶18),流速为1.0 mL/min,进样量为20 μL,检测波长为245 nm[12-13]。
1.2.2姬松茸多糖的分离纯化
称取8 g ABP样品,配制成质量浓度为8 mg/mL的溶液,磁力搅拌过夜,使其充分溶解。将样品溶液以4 000 r/min离心15 min,取上清液,利用平衡好的DEAE-纤维素柱(7.5 cm×30 cm,Cl-型)进行分级,用0.5 mol/L NaCl溶液洗脱。利用截留分子质量为3 000 Da的中空纤维柱除去洗脱液盐离子,于60 ℃真空减压浓缩,-80 ℃冷冻干燥。
1.2.3实验动物模型的建立及给药
雄性Wistar大鼠32只,适应性喂养7 d,温度20.0~22.0 ℃,相对湿度50%~60%。将大鼠随机分成4组,即空白对照组(NG)、模型组(MG)、辛伐他汀阳性对照组(PG)、姬松茸多糖组(ABP-A),每组8只。NG组饲喂基础饲料100(g/kg)·d-1,MG、PG、ABP-A组饲喂高脂饲料100(g/kg)·d-1,自由饮水。建立模型的同时灌胃给药,PG组给予4.8(mg/kg)·d-1辛伐他汀水溶液,ABP-A组给予640(mg/kg)·d-1ABP-A提取物水溶液,NG与MG组给予等体积蒸馏水,连续42 d。
1.2.4大鼠体质量、脏器指数的测定
每周固定时间记录各组大鼠体质量及其变化情况。末次给药后,当晚禁食不禁水,于次日上午,腹腔注射5%水合氯醛(0.75 mL/100 g),待大鼠麻醉后准确称量麻醉完全的大鼠体质量和大鼠肝脏湿质量并详细记录,计算肝脏质量与体质量的比值。见式(1)。
脏器指数=脏器湿质量/体质量×100% 。
(1)
式(1)中,脏器湿质量,mg;体质量,g。
1.2.5血清TC、TG、HDL-C、LDL-C含量的测定
大鼠麻醉后腹主动脉取血,3 000 r/min离心10 min分离血清。参照酶联免疫试剂盒说明书的方法测定大鼠血清TC、TG、HDL-C、LDL-C的含量。
1.2.6肝脏组织HE染色
大鼠肝脏浸于10%福尔马林中固定1周,苏木精- 伊红染色法(hematoxylineosin staining,HE)染色[14]。
1.2.7肝脏组织中LDL-R、SREBP-1C、CYP7a-1、PPAR-α、SCARB-1F的mRNA表达水平检测
取15 mg肝脏提取总RNA并定量,每组各取2 μg逆转录得到cDNA,以cDNA为模板进行PCR扩增。按照试剂盒说明书进行RT-PCR扩增,反应条件为:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环30次后72 ℃延伸5 min。扩增完成后进行琼脂糖凝胶电泳,电压80 V,时间45 min。
电泳完成后利用凝胶成像仪采集图像,Image J计算荧光强度值,以GAPGH为内参进行标准对照。表1为LDL-R、SREBP-1C、CYP7a-1、PPAR-α、SCARB-1F的引物序列。

表1 LDL-R、SREBP-1C、CYP7a-1、PPAR-α、SCARB-1F的引物序列Tab.1 Primer sequence of LDL-R,SREBP-1C,CYP7a-1, PPAR-α,SCARB-1F
1.3数据处理
2 结果与分析
2.1 姬松茸多糖的成分及含量分析
表2为ABP的成分分析结果。由表2可见:ABP中总糖质量分数为751 mg/g,糖醛酸质量分数为19 mg/g,蛋白质质量分数为56 mg/g。图1为ABP的单糖组成的HPLC分析结果,对图1中各峰面积进行计算,得表3(ABP的单糖含量分析结果)。由表3可见:ABP的单糖组成及质量分数分别为葡萄糖(Glc)(600 mg/g)、半乳糖(Gal)(284 mg/g)、甘露糖(Man)(62 mg/g)、鼠李糖(Rha)(4 mg/g)、半乳糖醛酸(GalA)(1 mg/g)、木糖(Xyl)(12 mg/g)、阿拉伯糖(Ara)(1 mg/g)、岩藻糖(Fuc)(36 mg/g)。

图1 ABP的单糖组成HPLC分析结果Fig.1 Results of monosaccharide composition of ABP by HPLC
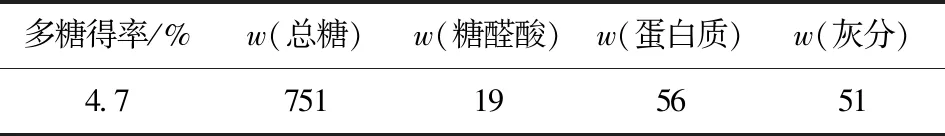
表2 ABP的成分分析结果Tab.2 Results of component analysis of ABP mg/g

表3 ABP的单糖质量分数Tab.3 Monosaccharide content of ABP mg/g
2.2 姬松茸多糖的分离纯化结果分析
利用DEAE-纤维素柱对ABP进行离子交换层析分级。用0.5 mol/L NaCl 溶液洗脱得到酸性糖级分ABP-A,以试管编号为横坐标,以490 nm处吸光度值为纵坐标,得到如图2所示的洗脱曲线。表4为ABP-A的成分分析结果,由表4可见:ABP-A 的得率为47.5%,ABP-A中总糖质量分数为741 mg/g,糖醛酸质量分数为182 mg/g,蛋白质质量分数为48 mg/g。图3为ABP-A的单糖组成HPLC分析结果,对图3中各峰面积进行计算,得表5(ABP-A的单糖含量)。由表5可见:ABP-A的单糖组成及质量分数分别为Glc(886 mg/g)、Gal(24 mg/g)、Man(19 mg/g)、Rha(10 mg/g)、GalA(5 mg/g)、Xyl(19 mg/g)、Ara(21 mg/g)、Fuc(16 mg/g)。

图2 ABP经 DEAE-纤维素柱后的洗脱曲线Fig.2 Elution curve of ABP after DEAE-cellulose column

表4 ABP-A的成分分析结果Tab.4 Results of component analysis of ABP-A mg/g
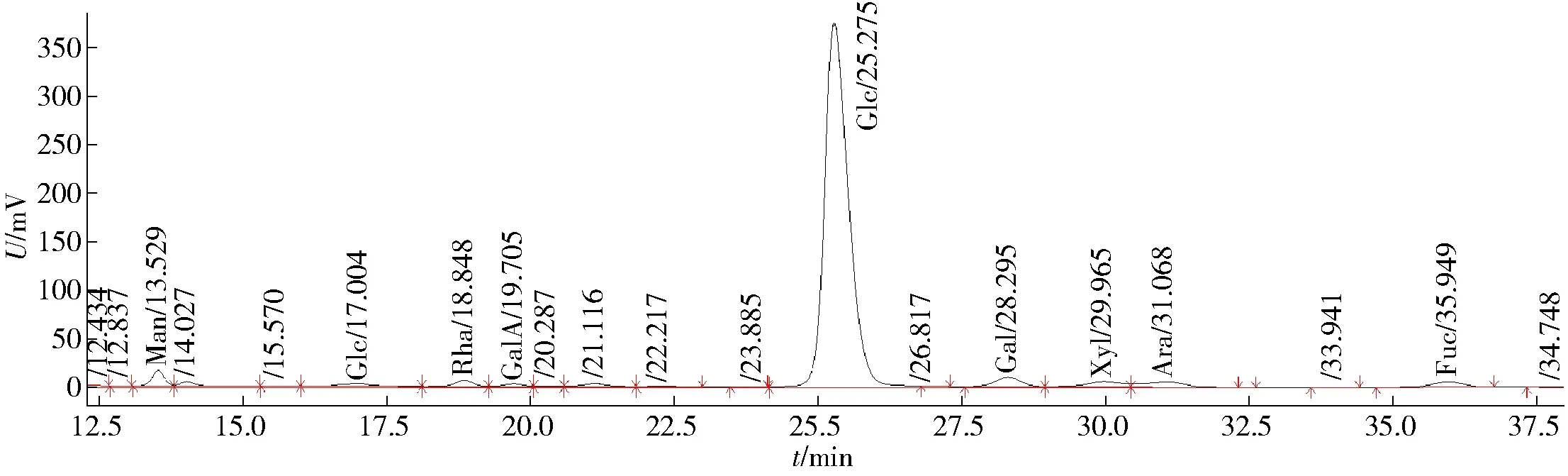
图3 ABP-A的单糖组成HPLC分析结果Fig.3 Results of monosaccharide composition of ABP-A by HPLC

表5 ABP-A的单糖质量分数Tab.5 Monosaccharide content of ABP-A mg/g
2.3 ABP-A对高脂血症大鼠一般状态及体质量的影响
图4为ABP-A与大鼠体质量变化关系的分析结果,由图4可见:NG组大鼠体质量持续增长,与NG组相比,MG组大鼠造模第4周后体质量显著增长(P<0.05);与MG组相比,PG组大鼠和ABP-A组大鼠分别从造模后第4周和第5周后体质量显著降低(P<0.05),增长趋势缓慢。
图5为大鼠相对肝脏指数随ABP-A干预的变化情况,由图5可见:与NG组相比,MG组大鼠的相对肝脏指数极显著升高(P<0.01);与MG相比,ABP-A组相对肝脏指数显著降低(P<0.05)。
2.4 ABP-A对高脂血症大鼠血清TC、TG、LDL-C和HDL-C的影响
图6为大鼠血清生化指标测定结果,由图6可见:与NG组相比,MG组大鼠血清TC、TG、LDL-C含量极显著上升(P<0.01),HDL-C含量极显著下降(P<0.01);与MG组相比,ABP-A组大鼠血清TC、TG、LDL-C含量极显著降低(P<0.01),HDL-C含量极显著升高(P<0.01)。

*表示与NG组相比差异显著 (P<0.05),#表示与MG组相比差异显著(P<0.05),▲表示差异极显著(P<0.01)。图4 ABP-A对大鼠体质量的影响Fig.4 Effect of ABP-A on body weight of rats

*表示与NG组相比差异显著 (P<0.05),** 表示差异极显著 (P<0.01);#表示与MG组相比差异显著(P<0.05),##表示差异极显著(P<0.01)。图5 ABP-A对高脂血症大鼠相对肝脏指数的影响Fig.5 Effect of ABP-A on relative liver index in hyperlipidemia rats

*表示与NG组相比差异显著(P<0.05),** 表示差异极显著(P<0.01);#表示与MG组相比差异显著(P<0.05),##表示差异极显著(P<0.01)。图6 ABP-A对高脂血症大鼠血清生化指标的影响Fig.6 Effect of ABP-A on serum biochemical parameters in hyperlipidemia rats
2.5 ABP-A对高脂血症大鼠肝脏组织的影响
图7为大鼠肝细胞HE染色结果,由图7可见:NG组[图7(a)]肝组织排列整齐,细胞核清晰可见,肝组织结构较完整;MG组[图7(b)]肝细胞体积变大,可见广泛的肝细胞脂肪变性,有大量脂滴沉积;PG组[图7(c)],肝细胞排列紧致,形态恢复正常,细胞内脂滴消失;ABP-A组[图7(d)]肝细胞排列及结构整齐,未见细胞内存在脂滴。
2.6 ABP-A对高脂血症大鼠肝脏中mRNA表达量的影响
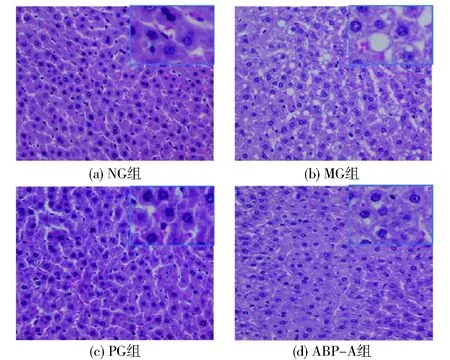
放大倍数:40倍。图7 大鼠肝脏组织病理学变化Fig.7 Histopathological changes in rat liver
图8为大鼠肝脏组织中mRNA表达量分析结果。图8(a)为RT-PCR法检测大鼠肝脏中mRNA表达结果,使用Image J对图8(a)进行灰度分析,得出图8(b)至图8(f)。由图8可见:与NG组相比,MG组的SCARB-1F mRNA 的相对表达量显著降低(P<0.05),LDL-R、CYP7a-1、PPAR-α mRNA的相对表达量极显著降低(P<0.01),SREBP-1C mRNA的相对表达量极显著升高(P<0.01);与MG组相比,ABP-A组的LDL-R、SCARB-1F mRNA的相对表达量显著升高(P<0.05),CYP7a-1、PPAR-α mRNA的相对表达量极显著升高(P<0.01),SREBP-1C mRNA的相对表达量极显著降低(P<0.01)。
3 结 论
肝脏是机体内参与脂质代谢的重要器官,研究发现,长期饲喂高脂饮食会引起肝脏组织肿大[15-16]。本实验利用高脂饮食诱导建立高脂血症大鼠模型,MG组大鼠的肝脏指数,血清TC、TG、LDL-C显著升高,说明高脂大鼠模型建立成功。ABP-A干预后大鼠血清TC、TG、LDL-C显著降低,HDL-C显著升高,肝脏细胞内脂滴沉积减少,提示ABP-A具有降低高脂血症大鼠血脂作用。
机体内脂质代谢的过程极其复杂,受多种因素共同调节,维持机体脂类代谢的稳态依赖于脂质的合成、吸收及排泄这3条主要代谢途径[17]。PPAR-α高表达于肝脏,能与脂肪酸及其衍生物结合并活化,减少肝脏中脂质积累,从而启动一系列与脂质代谢有关的酶的转录,对维持脂质代谢的平衡起着十分重要的调节作用[18-19]。PPAR-α能通过诱导肝X受体的表达引起CYP7a-1表达的上调[20]。CYP7a-1是肝脏TC代谢为胆汁酸的第一步限速酶,催化TC分解为胆汁酸,主要分布于肝脏,在维持脂质代谢的内环境稳态中起着重要作用[21-22]。TC在机体内能够被彻底氧化分解,主要是通过细胞膜表面的LDL-R对外源性胆固醇的内吞作用,将其吸收入细胞内,并转化为类固醇激素等,起到维持人体生理功能的作用[23-24]。CYP7a-1基因的表达上调可以增加LDL-R的表达,进而影响TC和脂蛋白的代谢,加速TC转化为胆汁酸的代谢过程[25]。本实验结果提示,ABP-A干预后高脂大鼠肝脏中LDL-R、CYP7a-1、PPAR-α因子表达上调。SREBP-1C的靶基因是控制脂肪酸合成的限速酶,脂肪酸及其部分代谢产物是具有肝细胞毒性的分子,作用于肝细胞可引起线粒体肿胀和通透性增加,肝细胞变性、坏死和炎细胞浸润而诱发脂肪性肝炎[26]。SCARB-1F是清道夫受体蛋白的B类家族的成员,是一种具有特殊功能的膜蛋白,主要在肝脏中表达,在介导选择性脂质摄取并且在逆向转运TC中起关键作用[27-28],能够直接与多种蛋白质和脂质发生作用。SREBP-1C过度表达可以引起SCARB-1F表达的下调。实验结果表明,ABP-A干预后能下调高脂血症大鼠肝脏中SREBP-1C的表达,同时上调SCARB-1F的表达,因此,提示ABP-A可以减少脂质在肝脏中积累,调节脂质代谢紊乱,有明显的降脂作用。

*表示与NG组相比差异显著 (P<0.05),**表示差异极显著 (P<0.01);#表示与MG组相比差异显著(P<0.05),##表示差异极显著(P<0.01)。图8 ABP-A对高脂血症大鼠肝脏组织中mRNA表达量的影响Fig.8 Effect of ABP-A on mRNA expression in liver tissue of rats with hyperlipidemia
本研究证实ABP-A对高脂饮食诱导的高脂血症大鼠有显著的降血脂作用,作用机制与其对肝脏脂质代谢关键因子LDL-R、SREBP-1C、CYP7a-1、PPAR-α、SCARB-1F的调控有关。希望本研究可为进一步开展姬松茸降血脂功能食品和药品的研发提供理论参考。
