大黄酚对缺氧诱导的心肌细胞损伤保护作用及机制*
2021-04-01卢玉润李英胡涛唐宇帆何秋蓉
卢玉润 李英 胡涛 唐宇帆 何秋蓉
(1.四川省医学科学院·四川省人民医院老年内科,四川 成都 610072;2.四川大学华西公共卫生学院·四川大学华西第四医院检验科,四川 成都 610041)
缺血性心脏病是一种高发病率和高死亡率的临床常见疾病,心肌供氧不足所导致的心肌损伤是缺血性心脏病发生的重要因素之一,降低心肌耗氧量和/或增加心肌供氧的抗缺血疗法被证实是治疗缺血性心脏病的重要策略[1-4]。因此,寻找和开发有效的保护心肌细胞免受缺氧损伤药物对缺血性心脏病的治疗和预防具有重要意义。蒽醌类化合物大黄酚提取自中药大黄,具有抗炎、抗氧化和抗癌的药理作用[5-7]。研究[8-9]显示,大黄酚对缺血再灌注损伤的小鼠脑组织和缺血缺氧刺激的海马神经元等具有保护作用。然而,大黄酚在缺氧诱导的心肌细胞中是否具有保护作用及其机制并不清楚。氯化钴(CoCl2)是体外模拟心肌缺氧损伤常用的诱导剂[10-11]。本研究构建CoCl2诱导的心肌细胞系H9c2缺氧损伤模型,旨在阐述大黄酚对缺氧诱导的心肌细胞损伤的保护作用及其机制。
1 材料与方法
1.1 主要材料 大鼠心肌细胞系H9c2(上海美轩生物科技有限公司),大黄酚(四川省维克奇生物科技有限公司,纯度≥98%)。DMEM/F12培养基(美国Gibco公司),MTT试剂和二甲基亚砜(美国Sigma公司),LDH试剂盒(南京建成生物工程研究所),Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术研究所)。兔抗鼠Bax、Bcl-2和GAPDH抗体(美国Santa Cruz公司),兔抗鼠Cleaved caspase-3抗体(英国Abcam公司),HRP标记的山羊抗兔IgG抗体(北京中杉金桥生物公司)。
1.2 细胞培养 采用含10%胎牛血清和100 U/mL青链霉素双抗的DMEM/F12培养基在37 ℃、湿度饱和的5%CO2培养箱中常规培养H9c2细胞。待细胞贴壁80%左右时,以0.25%胰蛋白酶消化传代。
1.3 缺氧细胞模型的构建、分组与处理 参照文献[1]以 1200 μmol/L CoCl2处理H9c2细胞24 h,构建缺氧细胞模型。将长势良好的对数生长期H9c2细胞分为对照组(正常培养)、缺氧组(建立缺氧细胞模型)及1、10和20 μmol/L大黄酚处理组(分别加入终浓度为1、10和20 μmol/L大黄酚预处理细胞后,再给予缺氧处理)。其中,大黄酚浓度的选取参照文献[12]。每组设置3个复孔。
1.4 LDH试剂盒检测细胞上清液中LDH释放量 取处理结束后的各组细胞上清液100 μL,参照LDH试剂盒说明书检测各组细胞上清液中LDH释放量。实验重复3次。
1.5 MTT法检测细胞活力 将处理结束后的各组细胞以每孔104个接种至6孔细胞板上,并将不含细胞的培养基作为空白对照,置于37 ℃、湿度饱和的5%CO2培养箱中常规培养过夜。次日,弃培养液,加入20 μL MTT溶液(5 mg/mL)。孵育4 h后,弃上清液,再以150 μL二甲基亚枫震荡反应10 min。采用酶标仪检测各组细胞在490 nm处的OD值,并按照存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%计算各组细胞存活率。实验重复3次。
1.6 流式细胞仪检测细胞凋亡 胰蛋白酶消化收集处理结束后的各组细胞,以预冷的磷酸缓冲液洗涤细胞后,参照Annexin V-FITC凋亡检测试剂盒说明书步骤检测各组细胞的存活率。实验重复3次。
1.7 Western blot检测Bcl-2、Bax和Cleaved caspase-3蛋白水平 胰酶消化收集各组细胞后加入细胞裂解液抽提细胞总蛋白,采用BCA法检测总蛋白的浓度。将蛋白样品与等体积的上样缓冲液混匀后,置于沸水浴中煮沸5 min。采用12% SDS-PAGE凝胶将热变性后的蛋白样品以每孔60 μg电泳分离后,半干法转膜。经5%脱脂奶粉封膜2 h后,浸入Bcl-2(1∶500)、Bax(1∶1000)、Cleaved caspase-3(1∶1000)和GAPDH(1∶1000)一抗工作液中在4 ℃下孵育过夜。次日,再转入HRP标记的山羊抗兔IgG二抗(1∶2000)工作液室温孵育1 h。暗室内显影曝光后,以GAPDH为内参,采用凝胶成像系统扫描分析各组细胞中Bcl-2、Bax和Cleaved caspase-3蛋白水平。实验重复3次。

2 结果
2.1 大黄酚对缺氧心肌细胞上清液中LDH释放量的影响 与对照组相比,缺氧组细胞上清液中LDH释放量明显增多(P<0.05);与缺氧组相比,1 μmol/L 大黄酚组LDH释放量差异无统计学意义(P>0.05);但10、20 μmol/L大黄酚处理组中LDH释放量较缺氧组或1 μmol/L 大黄酚组明显减少(P<0.05),且20 μmol/L大黄酚组LDH释放量明显低于10 μmol/L大黄酚组(P<0.05),见表1。

表1 各组细胞上清液中LDH含量的比较
2.2 大黄酚对缺氧心肌细胞活力的影响 与对照组相比,缺氧组细胞存活率明显降低(P<0.05);与缺氧组相比,1 μmol/L大黄酚处理组细胞活力差异无统计学意义(P>0.05),但给予10、20μmol/L大黄酚处理后细胞活力较缺氧组或1μmol/L大黄酚处理组明显升高(P<0.05),且大黄酚浓度越高作用效果越显著(P>0.05),见表2。
2.3 大黄酚对缺氧心肌细胞凋亡的影响 与对照组相比,缺氧组细胞凋亡率明显升高(P<0.05);与缺氧组相比,10、20 μmol/L大黄酚处理组细胞凋亡率明显降低(P<0.05),且有一定的浓度依赖性;但1 μmol/L大黄酚处理组细胞凋亡与缺氧组心肌细胞凋亡比较差异无统计学意义(P>0.05),见图1和表2。

表2 各组细胞存活率和凋亡率的比较

图1 流式细胞仪检测各组细胞凋亡
2.4 大黄酚对缺氧心肌细胞凋亡相关蛋白表达的影响 与对照组相比,缺氧组细胞中Bcl-2/Bax水平明显降低,而Cleaved caspase-3蛋白水平明显升高(P<0.05);与缺氧组相比,1 μmol/L大黄酚组细胞中Bcl-2/Bax升高,Cleaved caspase-3蛋白水平差异无统计学意义(P>0.05),但10、20 μmol/L大黄酚处理组细胞中Bcl-2/Bax明显高于缺氧组或1 μmol/L大黄酚组,而Cleaved caspase-3蛋白水平明显低于缺氧组或1μmol/L大黄酚组(P<0.05)。同时,20 μmol/L大黄酚处理组的作用效果明显大于10 μmol/L大黄酚处理组(P>0.05),见图2和表3。
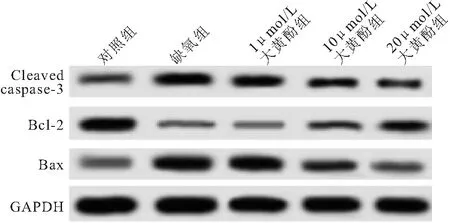
图2 各组细胞中Bcl-2、Bax和Cleaved caspase-3蛋白的表达
3 讨论
心肌缺血损伤的分子机制十分复杂,涉及炎症反应、氧化应激、能量代谢异常等,而这些最终会导致心肌细胞凋亡[13-15]。CoCl2是一种非常重要的低氧诱导因子,可通过促进LDH释放、降低细胞存活率和诱导心肌细胞凋亡等使心肌细胞发生缺氧损伤[16]。LDH是一种重要的糖酵解酶,其水平的升高常常被作为心肌细胞损伤的重要指标[17]。

表3 各组细胞中Bcl-2/Bax和Cleaved caspase-3蛋白相对表达水平比较
大黄酚又名大黄根酸、1,8-二羟基-3-甲基-蒽醌,主要来自蓼科植物掌叶大黄的干燥根,对肝、肾和脑等多种组织损伤具有重要的保护作用[18-20]。现代药理研究[21]表明,大黄酚具有广泛的药理作用,包括抗癌,抗氧化,神经保护,抗菌和抗病毒以及调节血脂。在小鼠脑缺血/再灌注损伤的研究中发现,大黄酚可通过抗缺氧作用和抗凋亡作用发挥保护效应[22]。有研究[12,23]指出大黄酚可通过减轻阿霉素诱导的心肌细胞凋亡、线粒体损伤和心脏功能障碍发挥心肌保护作用;还能够改善异丙肾上腺素注射诱导的心肌肥大大鼠心脏结构和功能,进而发挥心肌保护作用。然而大黄酚对缺氧诱导的心肌细胞损伤的作用和机制尚不明确。本研究以CoCl2模拟心肌细胞缺氧损伤,发现大黄酚对缺氧诱导的心肌细胞损伤具有一定的保护作用。
Xue等[24]研究显示大黄酚治疗可显著抑制糖尿病小鼠血清中LDH的活性,减轻糖尿病小鼠的心脏损伤。李俊杰等[9]报告指出,大黄酚可抑制缺血缺氧引起的大鼠海马组织细胞凋亡,保护缺氧诱导的神经细胞损伤。这与本研究结果相吻合,提示大黄酚可通过拮抗缺氧诱导的心肌细胞凋亡,提高细胞存活率,进而保护缺氧诱导的心肌细胞损伤。但本研究仅对大黄酚的心肌保护作用与机制进行初步探索,将来有必要在分子水平上进一步研究大黄酚的心肌损伤保护机制。
4 结论
大黄酚对缺氧诱导的心肌细胞损伤具有保护作用,其作用机制与拮抗缺氧诱导的心肌细胞凋亡有关;这为改善缺氧诱导的心肌细胞损伤及缺血性心脏病的防治提供了新线索。
