羊奶粉生产中金黄色葡萄球菌分离鉴定及其分子特性和耐药性检测
2021-03-31张鹏飞付雪婷赵春花刘心雨寇明莹葛武鹏
张鹏飞,付雪婷,赵春花,刘心雨,张 杰,张 萌,寇明莹,葛武鹏,王 新
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
金黄色葡萄球菌(Staphylococcus aureus)是一种人畜共患的致病菌,可引发人和动物的中毒和感染。近年来由金黄色葡萄球菌引发的食物中毒(S. aureusfood poisoning,SFP)事件屡见不鲜,主要是人们食用了污染金黄色葡萄球菌肠毒素的食物[1]。研究表明肠毒素由一组热稳定性的蛋白质组成,在100 ℃煮沸30 min后仍然具有生物活性和免疫活性[2]。目前根据肠毒素的催吐性,将金黄色葡萄球菌肠毒素划分为肠毒素和类肠毒素[3-5]。在肠毒素/类肠毒素中,葡萄球菌肠毒素A(staphylococcal enterotoxin A,SEA)被认为是SFP暴发的主要原因,其次是葡萄球菌肠毒素D(staphylococcal enterotoxin D,SED)、葡萄球菌肠毒素C(staphylococcal enterotoxin C,SEC)、葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB)和葡萄球菌肠毒素E(staphylococcal enterotoxin E,SEE)[6]。
近年来,羊奶粉作为一种新兴的奶粉品种,规模在不断扩大。羊奶是乳制品中最接近母乳、营养成分最全、最易被人体吸收的奶品,常作为婴幼儿配方奶粉的原料[1,7]。有研究报道,一些金黄色葡萄球菌存在于婴幼儿配方奶粉中[1,8]。虽然羊奶粉在加工生产过程中,都会经过巴氏杀菌杀死金黄色葡萄球菌等有害微生物,金黄色葡萄球菌产生的肠毒素仍可以导致人类食源性疾病[9-10]。目前,对金黄色葡萄球菌在羊乳到乳制品生产链上污染情况的研究还比较少。了解羊乳加工到成品这一生产环节中金黄色葡萄球菌的污染情况,可以有效阻止其对乳制品的污染。
为了解羊奶粉在不同加工环节中受金黄色葡萄球菌的污染情况,实验室已于2012—2013年对某4 个奶厂的不同生产环节进行样本的收集,结果发现4 个奶厂不同环节都存在一定的污染,且主要集中在罐奶、加工设备、加工人员和落地粉[10]。为进一步探明羊奶厂加工过程中受金黄色葡萄球菌污染的关键环节,本研究于2016年再次对其中一家羊奶粉加工厂不同生产环节进行金黄色葡萄球菌污染调查,并对分离菌株进行毒素基因、耐药性及葡萄球菌A蛋白(staphylococcal protein A,SPA)、多位点序列分型(multilocus sequence typing,MLST)和脉冲场凝胶电泳(pulsed field gel electrophpresis,PFGE)分型检测。通过了解不同环节金黄色葡萄球菌的污染情况和菌株的耐药性及分子特征,旨在确定金黄色葡萄球菌污染的关键环节及菌株特征,从而为有效防治羊奶粉加工过程中金黄色葡萄球菌污染提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样本来源
为了解羊奶粉加工过程中金黄色葡萄球菌的污染情况,随机选取了一家羊奶粉加工厂进行样本的收集。其中,样本的收集包括5 部分,分别为罐奶、加工设备、落地粉、加工人员以及成品。此次共采集样本112 份,其中罐奶23 份,加工设备35 份,加工人员10 份,落地粉29 份和成品15 份。
1.1.2 试剂
胰蛋白胨大豆琼脂(tryptic soy agar,TSA)、胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、甘露醇氯化钠琼脂、Baird-Parker(BP)基础培养基、亚碲酸盐卵黄增菌液、缓冲蛋白胨水(buffered peptone water,BPW)、7.5%氯化钠肉汤、Mueller-Hinton琼脂(Mueller-Hinton agar,MHA) 北京陆桥技术股份有限责任公司;Taq酶、Buffer(Mg2+-)、dNTP、MgCl2大连宝生物(TaKaRa)公司;药敏实验16 种待测抗生素 北京索莱宝科技有限公司。
1.2 仪器与设备
移液枪、高速离心机 德国Eppendorf公司;聚合酶链式反应(polymerase chain reaction,PCR)扩增仪、凝胶成像仪 美国伯乐公司;超净工作台 苏州安泰空气技术有限公司;恒温培养振荡摇床 上海智成分析仪器制造有限公司;超纯水机 四川优普超纯科技术有限公司;隔水式恒温培养箱 上海精宏实验设备有限公司;高压灭菌锅 上海申安高压仪器设备有限公司。
1.3 方法
1.3.1 样品的采集
1.3.1.1 粉状及液态样本的采集
参照GB 4789.10—2016《食品微生物检验 金黄色葡萄球菌检验》方法进行。将收集的样品置于无菌袋中并记录样品相关信息,低温运送到实验室,其间隔不超过4 h。
1.3.1.2 加工设备及加工人员样本的采集
涂抹样品的采集和处理参照王倩宁等[11]方法。用无菌棉签涂抹加工设备表面和加工人员手部或鞋子表面,将涂抹样置于装有30 mL新鲜BPW培养液的离心管中,并对涂抹区域进行消毒处理,防止微生物滋生。
1.3.2 菌株的分离与鉴定
参照Wang Xin等[1]方法对样本中金黄色葡萄球菌进行分离鉴定。对于液态或固态样本,称取25 g液体或者粉末样本于225 mL无菌BPW培养液中;涂抹样本不做处理,然后将盛有样本的BPW培养液至于恒温培养振荡摇床37 ℃、150 r/min培养18~24 h。将富集后的过夜培养液按照1∶10接种到30 mL 7.5%氯化钠肉汤中,37 ℃、150 r/min培养24 h。接着将培养后的菌液用接种环三线划法接种到BP平板上,37 ℃培养24 h。挑取可疑菌落接种在甘露醇平板中,做进一步鉴定。最后挑取甘露醇变色平板单菌落纯化在TSA平板37 ℃培养18~24 h。对纯化后的菌落用煮沸法制得DNA模板,并用PCR扩增nuc基因进行最后一步验证,nuc阳性的菌株被确定为金黄色葡萄球菌。将nuc基因阳性的所有菌株用棉签涮于50%的TSB-甘油管中,于-80 ℃冰箱保存。
1.3.3 毒素基因检测
运用PCR技术对所有的菌株进行23 种毒素基因检测。其中肠毒素基因21 种,包括:5 种经典肠毒素基因(sea、seb、sec、sed和see)和16 种新型肠毒素基因(seg、seh、sei、sej、sek、sel、sem、sen、seo、sep、seq、ser、ses、set、seu和sev);杀白细胞毒素基因(pvl)和中毒休克综合征毒素基因(tsst-1)。
1.3.4 耐药性检测
根据临床和实验室标准协会(Clinical and Laboratory Standard Institute,CLSI)推荐的琼脂稀释法,对分离到的6 株菌进行16 种常用抗菌药物的耐药性测定,并在37 ℃培养18~24 h后评估结果。16 种常用抗生素及最低抑菌浓度为:青霉素(penicillin,PEN,0.25 µg/mL)、氨苄西林(ampicillin,AMP,0.5 µg/mL)、苯唑西林(oxacillin,OXA,4 µg/mL)、红霉素(erythromycin,ERY,8 µg/mL)、四环素(tetracyclines,TET,16 µg/mL)、头孢西丁(cefoxitin,FOX,8 µg/mL)、头孢哌酮(cefoperazone,FOP,64 µg/mL)、氯霉素(chloramphenicol,CHL,32 µg/mL)、庆大霉素(gentamicin,GEN,16 µg/mL)、环丙沙星(ciprofloxacin,CIP,4 µg/mL)、利福平(rifampin,RIF,4 µg/mL)、万古霉素(vancomycin,VAN,16 µg/mL)、阿米卡星(amikacin,AMK,64 µg/mL)、甲氧苄啶/磺胺甲恶唑(trimethoprim/sulfamethoxazole,T/S,4/76 µg/mL)、阿莫西林/克拉维酸(amoxicillin/clavulanic acid,A/C,8/4 µg/mL)和利奈唑胺(linezolid,LZD,8 µg/mL)。药敏实验质控菌株为金黄色葡萄球菌ATCC 29213和大肠杆菌ATCC 25922。此外,运用PCR技术扩增mecA基因判断菌株是否为“超级耐药细菌”——耐甲氧西林金黄色葡萄球菌(methicillin-resistantS. aureus,MRSA)。
1.3.5 分子分型
1.3.5.1 SPA分型
运用PCR技术扩增spa基因,并将扩增产物送至北京奥科鼎盛生物科技有限公司进行测序。然后将测序结果进行处理,在线提交至分析网站http://spaserver.ridom.de进行分析,以此确定SPA类型。
1.3.5.2 MLST分型
运用PCR技术扩增7 对管家基因,并进行测序,将测序结果提交至MLST数据分析网站(http://www.MLST.net)进行分析,得到每个管家基因的等位基因谱,再递交至该网站,最终可获得每个菌株的ST型。
1.3.5.3 PFGE分型
参照王新等[12]方法对分离株进行PFGE分型,分型中以Salmonella braenderupH9812为标准质控菌株,以SmaI和XbaI为内切酶分别对金黄色葡萄球菌和H9812进行酶切,采用BioMerics-3.00软件进行聚类分析。
1.4 数据统计及图表绘制
所有数据采用Excel 2016软件进行数据统计分析,并运用Word 2003绘制三线表。PFGE聚类图采用BioMerics-3.00软件进行聚类分析。
2 结果与分析
2.1 金黄色葡萄球菌分离情况
对112 份样品进行选择培养和nuc基因鉴定,发现6 份样品被金黄色葡萄球菌污染,污染率为5.4%(6/112)。每份阳性样品分别分离出1 株金黄色葡萄球菌,其中1 株(4.3%,1/23)分离于罐奶,2 株(5.7%,2/35)分离于加工设备,2 株(20.0%,2/10)分离于加工人员,1 株(3.4%,1/29)分离于落地粉,结果如表1所示。
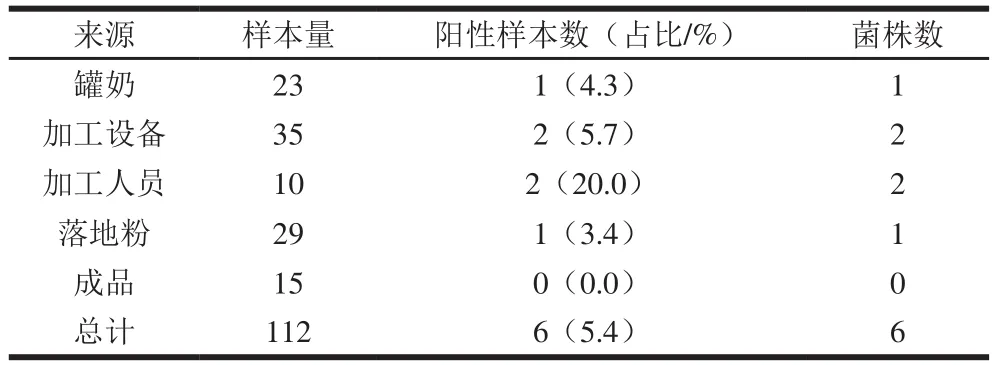
表 1 不同生产环节中金黄色葡萄球菌的流行情况Table 1 Prevalence of S. aureus in different production stages
2.2 菌株毒素基因携带情况
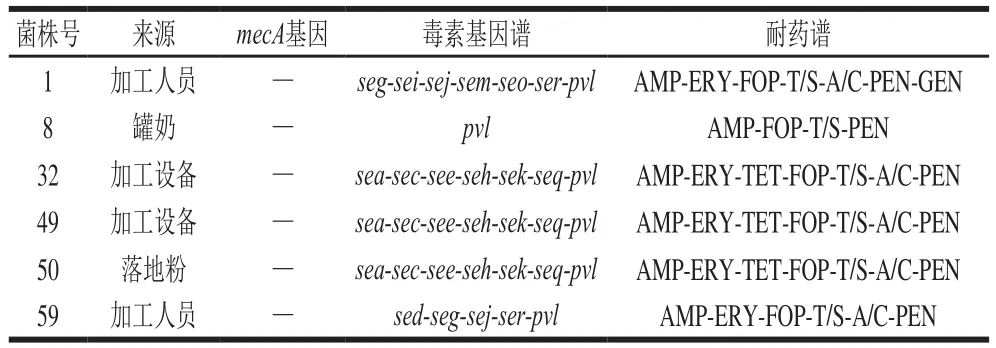
表 2 金黄色葡萄球菌毒素基因、耐药性及mecA检测情况Table 2 Virulence genes, antimicrobial susceptibility and mecA gene of S. aureus strains
对23 种毒素基因进行检测,结果如表2所示。所有的菌株至少携带1 种毒素基因,包括sea、sec、sed、see、seg、seh、sei、sej、sek、sem、seo、seq、ser和pvl基因。其中pvl基因的检出率最高为100.0%(6/6);其次为sea、sec、see、seh、sek和seq50.0%(3/6),seg、sej和ser33.3%(2/6),sed、sei、sem和seo16.7%(1/6);此外8 个肠毒素基因(seb、sel、sen、sep、ses、set、seu和sev)和中毒休克综合征毒素基因(tsst-1)没有检出。从23 种毒素基因的检出情况看,菌株携带杀白细胞素基因(pvl)比率较高,为100.0%(6/6),其次携带经典肠毒素基因的比率为33.3%(10/30)和携带新型肠毒素基因的比率为18.8%(18/96)。此外,在本研究中6 株金黄色葡萄球菌共有4 种不同的毒素基因谱,每株菌株携带1~7 种毒素基因不等,其中最常见的基因谱是sea-sec-see-seh-sek-seqpvl50.0%(3/6)。综上结果表明,此次羊奶厂分离的金黄色葡萄球菌都携带较多的毒素基因,且经典肠毒素基因的携带率较高,不仅增加了羊奶粉加工污染的概率,而且还会加重对婴幼儿健康的威胁。
2.3 菌株耐药情况
如表2所示,所有的菌株都表现为多重耐药,都至少耐3 种抗生素。其中,对AMP、FOP、T/S和PEN的耐药性最为普遍,耐药率达100.0%(6/6),其次对ERY和A/C的耐药率为83.3%(5/6),对TET的耐药率为50.0%(3/6)和对GEN的耐药率为16.7%(1/6)。所有菌株均对OXA、FOX、CHL、CIP、RIF、VAN、AMK和LZD敏感。在本研究中6 株分离株共有4 种不同的耐药谱,其中最常见的耐药谱是AMP-ERY-TET-FOP-T/S-A/C-PEN,检出率为50.0%(3/6)。此外,所有的菌株mecA基因检测都为阴性。
2.4 分子分型
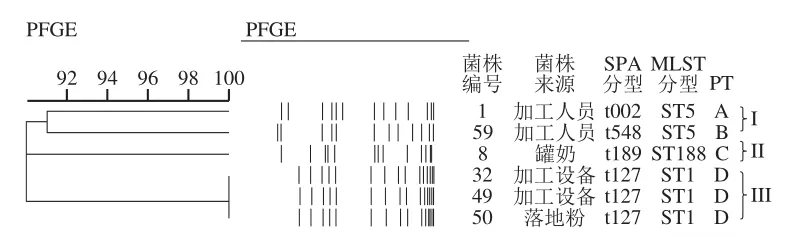
图 1 6 株金黄色葡萄球菌PFGE、SPA、MLST和PT分型Fig. 1 Dendrograms of PFGE, SPA, MLST and PT typing for the six S. aureus strains
对所有的分离株进行SPA、MLST和PFGE分型,结果如图1所示。6 株分离株共有4 种SPA分型和3 种MLST分型。对于SPA分型,主导分子型为t127 50.0%(3/6),其次为t002、t548和t189 16.7%(1/6)。对于MLST分型,主导分子型为ST1 50.0%(3/6),其次为ST5 33.3%(2/6)以及ST188为16.7%(1/6)。6 株分离株PFGE分型结果发现,所有的菌株均能被SmaI切开,共分为4 个脉冲型(pulsotypes,PT)(A、B、C和D),当使用90.01%的相似性聚簇时,可分为3 个不同的簇(I、II和III簇)。其中,2 株来源于加工设备和1 株来源于落地粉的ST1-t127菌株在相同的簇中且具有相同的PT。此外,来源于加工人员的2 株菌在相同的簇中,但PT不同。
3 讨 论
随着经济的发展和人们生活水平的提高,越来越多的人解决温饱之余,更注重产品的营养价值。羊奶以丰富的营养及不含过敏源,深受人们的喜爱[13]。在奶山羊饲养过程中,乳房炎是奶山羊疾病中发病率最高、影响范围最广的疾病之一,而金黄色葡萄球菌是引起奶山羊乳房感染的主要病原微生物之一[14]。被金黄色葡萄球菌感染引发乳房炎的奶山羊,在挤奶时很有可能将金黄色葡萄球菌带入羊奶中,进而增加了羊乳制品中金黄色葡萄球菌的污染。目前,对羊乳粉加工环节中金黄色葡萄球菌污染状况鲜有报道。
本研究结果表明羊奶粉加工环节受金黄色葡萄球菌污染率较低(5.4%,6/112),这与实验室前期的研究结果一致(7.2%,61/848)[10],说明羊奶粉加工过程中长期存在金黄色葡萄球菌污染的情况。虽然分离率较低,不能忽视金黄色葡萄球菌可能通过生产链进行传播的可能。此外,本研究从罐奶、加工设备、加工人员和落地粉样本中分离到金黄色葡萄球菌,该结果与Xing Xiaonan[10]和Papadopoulos[15]等报道比较一致,表明这四大环节是国内外在乳粉加工过程中被金黄色葡萄球菌污染的关键环节。众所周知,乳粉在加工过程中都会采用巴氏杀菌杀死有害微生物,本研究在乳粉成品中也未检测到金黄色葡萄球菌,表明巴氏杀菌可以有效杀死有害微生物,但不能有效灭活金黄色葡萄球菌分泌的一些耐热毒素[16]。因此,应该加强乳制品中耐热毒素(如肠毒素等)的检测,可以减少金黄色葡萄球菌引发食物中毒的风险。
对分离株进行毒素基因检测,结果发现较多金黄色葡萄球菌携带1 个或多个肠毒素基因(83.3%),这一比例高于实验室之前的研究(63.2%,38/61)[10]。有研究报道,sea单独或与其他葡萄球菌肠毒素基因一起,是引发食物中毒的主要原因,其次是sed、sec、seb和see[6]。在本研究中,经典肠毒素基因sea、sec和see(50.0%)最常被检测到,其次是sed(16.7%)。本研究还发现经典肠毒素基因sea、sec和see在同一株菌株中被检测到,且这些菌株具有相同的分子型(ST1-t127)。根据本实验室前期的研究发现携带sea基因的菌株一般均携带see基因[17],本研究结果与前期研究相似。但不同的是本研究中携带sea和see的菌株同时也携带sec基因,同时携带3 种经典肠毒素基因的菌株的报道还比较少。此外,也有研究报道称sec是羊源金黄色葡萄球菌中最常见的肠毒素基因[18-19],本研究也证实了这一点。在中国,携带经典肠毒素基因的菌株大多与葡萄球菌食物中毒事件相关,本研究从羊奶粉加工环节中分离出的所有菌株中,只有1 株分离株不携带任何经典肠毒素基因,因此有必要对生产设备及生产环境做深度清洁,减少携带毒素基因的金黄色葡萄球菌在生产环境中的长期定植,进而减少对乳粉原料的污染。目前,已经证明肠毒素和类肠毒素基因可以在移动遗传元件上编码和传播[20]。如sed和sej基因通常同时位于质粒pIB485上[21],这与本研究的结果一致,在加工人员样本中分离到的ST5-t548菌株同时携带这2 种基因。除此之外,在加工人员样本中还发现1 株携带不完整egc基因簇基因(seg-sei-sem-seo)的菌株。因此,建议不仅要重视产经典肠毒素菌株造成的污染,而且要重视新型肠毒素对乳粉的污染[22-24]。加工人员与工厂环境来源的菌株携带毒素基因情况不同,说明工厂环境的菌株来源比较广泛,需要进一步对工厂环境来源菌株进行溯源研究。在本研究中还发现所有的分离株均携带pvl基因,研究结果高于其他报道[12,25]。有报道称,pvl与人类感染和山羊乳腺炎有关[26-27]。因此及时对感染乳房炎的产奶羊进行治疗或淘汰可以从根源上减少羊奶的污染。大量研究发现,在中国pvl基因与社区获得性MRSA(community-associated MRSA,CA-MRSA)相关性较高,携带pvl基因的CAMRSA感染性更强[28]。本研究没有检测到mecA阳性的菌株,但要防止耐药基因的转移,一旦在生产环节中检测出MRSA菌株,将加重对人类健康的威胁尤其是免疫力较低的婴幼儿。
据统计,我国每年约有10万 t抗菌药物用于养殖业[29]。随着抗生素在动物养殖中的大量使用,细菌为适应新的环境,耐药性不断增强。在本研究中,100.0%的菌株都至少耐受4 种抗生素,都表现为多重耐药,该结果高于Xing Xiaonan[10]和Papadopoulos[15]等的报道。因此,相关部门要严格控制抗生素的使用,防止滥用现象。本研究从罐奶分离的菌株耐药性比较单一,除对β-内酰胺类抗生素耐药外,对其他抗生素均敏感。该结果提示在抗生素使用时,要防止同种抗生素的重复使用,以免长期使用造成细菌耐药性的产生。除此之外,分离于工厂设备和落地粉的菌株有相同的耐药谱,且有相同的分子型。因此怀疑可能由于设备定植金黄色葡萄球菌,进而造成乳粉污染。而这3 株分离株除了对β-内酰胺类抗生素耐药外,对ERY和TET抗生素有较强的耐药性。ERY和TET这2 种抗生素在动物养殖及人类治疗中的大量使用[30-31],可能是造成菌株耐药性的关键。此外,分离于加工人员的2 株菌,有不同的耐药谱。研究表明,20%的人群是金黄色葡萄球菌的持续携带者,而30%左右的人群是间歇性的携带者[32]。因此,加工设备和加工人员工作服定期的消毒清洗及加工人员的规范操作是保障乳粉不被污染的关键环节。
对分离株进行SPA、MLST和PFGE分型发现,所有的菌株共表现为4 种分型,主要为ST1-D-t127(50.0%,3/6,ST-PT-SPA分型),其次为ST5-A-t002,ST5-B-t548和ST188-C-t189(16.7%,1/6)。其中3 株ST1-D-t127型菌株,2 株来自加工设备,1 株来自落地粉,且这3 株菌在同一聚簇中,说明在羊奶粉加工过程中,存在不同操作环节的交叉污染。此外,有研究报道称ST1-t127型菌株是乳品中最常见的分子型菌株[15],本研究也证实了这一点。本研究在加工人员样本中分离到1 株ST5-t002型菌株,根据现有报道ST5-t002型菌株主要定植于医院和社区中[33],很少有在乳粉中分离的报道,但其高耐药和携带较多的新型肠毒素基因,一旦该类型菌株在乳粉中传播,将会给婴幼儿健康造成巨大威胁。本研究在加工人员中也其分离到1 株ST5型菌株,但该菌株SPA型为t548,该类型菌株主要存在动物食品中[34],该结果也说明在乳粉的加工过程中可能存在动物源菌株的入侵。此外,在罐奶中分离到1 株ST188-t189型菌株,该类型菌株主要分离于食品及食物中毒样本中[35]。综上所述,需要注意对人源和动物源菌株的防治。重要的是,有研究显示一些经巴氏杀菌处理的金黄色葡萄球菌在乳粉保质期内可以恢复活性[1],这可能会对消费者构成巨大威胁。因此,羊乳粉在加工过程中,一定要注意加工设备的清洗以及加工人员的消毒。
本次检测结果显示,羊乳粉加工过程中的罐奶、加工设备、落地粉及加工人员依旧是加工链条中金黄色葡萄球菌的重要来源。此外,分离到的金黄色葡萄球菌耐药性较强,分子型单一且毒素基因携带率较高。虽然在成品中没有分离到金黄色葡萄球菌,不能忽视其产生的耐热毒素对乳粉的污染。因此,加强奶源地、加工环节及加工人员的规范管理,有针对地对关键污染环节进行金黄色葡萄球菌的清除非常必要。
