双波长瑞利光散射技术检测糕点类食品中的甜蜜素
2021-03-31陈明朗
江 虹,陈明朗
(长江师范学院化学化工学院,重庆 408100)
甜蜜素是一种人工合成添加剂,具有增强食品甜味的功能,它的甜度是蔗糖的30~50 倍,鉴于此,食品业在较多市售饮料及某些焙烤食品中均添加甜蜜素作为甜味型添加剂。随着食品毒理学研究方法的发展,人们对食品添加剂可能对人体造成的慢性毒性、致畸、致癌、致突变等作用有了新的认识,并引起人们的高度重视。美国和日本已禁止使用甜蜜素作为食品甜味添加剂,中国、欧盟及新西兰等国则对食品中添加甜蜜素作出严格规定。我国GB 2760—2014《食品添加剂使用卫生标准》中明确规定各种饮料中的甜蜜素不得超过0.65 g/kg,焙烤食品蛋糕及面包中的甜蜜素不得超过1.6 g/kg,饼干中的甜蜜素不得超过0.65 g/kg等。可见,对食品中甜蜜素含量进行研究有着重要意义。近年来,国内外对食品中甜蜜素检测进行了大量的研究工作,主要方法有高效液相色谱法[1-4]、高效液相色谱-质谱联用法[5-15]、电化学法[16-19]、分光光度法[20-21]、气相色谱法[22-25]、气相色谱-质谱联用法[26]等。高效液相色谱法、气相色谱法、液相色谱-质谱联用法和气相色谱-质谱联用法的前处理工作相对较为繁琐,日常运行费用较高;电化学法要求特殊电极,对实验条件要求较高;分光光度法的灵敏度不高,选择性欠佳。采用双波长瑞利光散射(dual-wavelength Rayleigh light scattering,DWO-RLS)技术研究食品中甜蜜素的检测方法,RLS技术是近年新发展起来的一种简便、高灵敏(可达纳克级)的检测技术,已广泛用于生物大分子、无机物及有机物的分析中,尤其在药物分析中应用甚多[27-29],而在食品分析中相对较少[30]。本实验以灿烂绿作探针,借助灿烂绿与甜蜜素反应生成具有2 个强散射峰的缔合物,建立了简便、快速测定甜蜜素的DWORLS方法,目前尚鲜见文献报道。该法用于食品中低脂蛋糕、面包及饼干中甜蜜素的测定,结果满意。
1 材料与方法
1.1 材料与试剂
低脂类蛋糕(1#、2#)、饼干(3#、4#、5#、6#)及面包(7#、8#、9#、10#)(脂肪<15%) 重庆市售;甜蜜素标准物质(纯度99.3%) 中国食品药品检定研究院;灿烂绿(分析纯) 上海迈瑞尔化学技术有限公司;三羟甲基氨基甲烷(Tris,分析纯) 上海吉至生化科技有限公司;HCl(分析纯) 重庆川东(化工)集团有限公司;超纯水。
1.2 仪器与设备
F-2500型荧光分光光度计 日本日立公司;TD5A-WS离心机 湖南湘仪离心机仪器有限公司;KQ-200VDE超声波清洗机 昆山市超声仪器有限公司;pHS-3C精密酸度计 上海虹益仪器仪表有限公司;EL104电子天平 上海精密仪器仪表有限公司。
1.3 方法
1.3.1 溶液配制
甜蜜素标准溶液:准确称取甜蜜素0.020 12 g,加水溶解后定容至100 mL,即配成1.00×10-3mol/L贮备液,取贮备液稀释100 倍,配成1.00×10-5mol/L操作液,于冰箱4 ℃保存。灿烂绿溶液:称取适量灿烂绿,用水溶解后配成1.00×10-4mol/L。Tris-HCl溶液:pH 3.0~9.8(用pH计测定0.20 mol/L Tris和0.10 mol/L HCl的混合液)。
1.3.2 样品处理
准确称取低脂蛋糕、饼干及面包样品各2 g左右(精确至±0.000 1 g)于小烧杯中,加适量水,水浴中温热、搅拌,浸提10 min,加10 mL无水乙醇(沉淀蛋白),搅拌、热水浴中超声20~30 min,4 500 r/min离心5~10 min,上清液用水定容至100 mL,待用。
1.3.3 RLS强度的测定
取10 mL具塞比色管,准确加入0.00~2.50 mL甜蜜素标准操作液、1.00 mL pH 9.27 Tris-HCl溶液及3.00 mL灿烂绿溶液,用水稀至刻度。待反应20 min后,在荧光分光光度计(λex=λem=220 nm,Ex=2.5 nm,Em=5.0 nm)上扫描RLS光谱,用DWO-RLS(341 nm+470 nm)法测定溶液的RLS强度IRLS(体系)、I0(试剂空白)及RLS增强强度ΔIRLS(341+470)(ΔIRLS=IRLS-I0)。
1.4 数据统计及图表绘制
所有实验至少重复扫描3 次,平行测定3~5 份,各数据以平均值表示,用Excel作数据统计,Origin制图,Word中插入表格制表。
2 结果与分析
2.1 甜蜜素与灿烂绿的RLS光谱特征
灿烂绿与甜蜜素的反应原理:灿烂绿在溶液中以阳离子形式存在,而甜蜜素在溶液中,分子上的Na+离去后以环己基氨基磺酸根阴离子形式存在。带正电荷的灿烂绿与带负电荷的甜蜜素以静电引力结合生成二元离子缔合物,使RLS显著增强,并产生具有2 个强的特征瑞利散射峰的新光谱,在2 个特征散射峰处,甜蜜素浓度与RLS增强强度有一定的线性关系,可用于甜蜜素的定量分析。
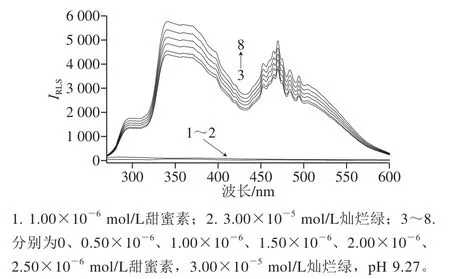
图 1 甜蜜素与灿烂绿的RLSFig. 1 Rayleigh light scattering spectra of cyclamate and brilliant green
从图1可知,甜蜜素溶液和灿烂绿溶液自身的RLS信号均十分微弱(曲线1和曲线2)。当在灿烂绿的碱性溶液(pH 9.27 Tris-HCl溶液)中加入不同浓度的甜蜜素标准操作液后,二者互相反应生成离子缔合物,新物质的生成使RLS显著增强,并产生具有2 个强的特征散射峰的新RLS光谱(曲线3~8),最大RLS峰位于341 nm,次大RLS峰位于470 nm,在296、452、463、484 nm及494 nm等多处出现小的RLS峰。在2 个强散射峰处,随着加入的甜蜜素溶液浓度的增大,体系的RLS强度随之增强,且呈良好的线性关系,因此,若选择341 nm或470 nm作为测定波长,均可用单波长瑞利光散射(single wavelength Rayleigh light scattering,SWO-RLS)法测定甜蜜素的含量,且有高的灵敏度。采用DWO-RLS(341 nm+470 nm)法测定时,因散射强度具有加和性,可大幅提高方法的测定灵敏度(约为SWO-RLS法的2 倍)。故实验选用DWO-RLS法定量测定甜蜜素。
2.2 适宜条件的确定
2.2.1 Tris-HCl溶液pH值及用量
取1.00 mL甜蜜素标准操作液、2.00 mL灿烂绿溶液,按1.3.3节RLS强度的测定方法,考察1.00 mL不同pH值的Tris-HCl溶液在用SWO-RLS法和DWO-RLS法测定时对甜蜜素-灿烂绿体系ΔIRLS的影响(n=3)。从图2可知,当pH<7时,ΔIRLS值很小,说明溶液pH值不合适,甜蜜素与灿烂绿基本不反应或少量反应;当pH>7时,随着pH值的逐渐增大,ΔIRLS随之增大,当pH 9.27时,ΔIRLS达最大,之后有所下降;这说明甜蜜素与灿烂绿反应的最适pH值为pH 9.27,pH值大于或小于9.27,不利于甜蜜素与灿烂绿的完全反应,因此,ΔIRLS有所下降。随即考察pH 9.27 Tris-HCl溶液用量对体系ΔIRLS的影响(n=3),结果表明,适宜用量为1.00 mL。从图2还可知,用DWORLS法测定的灵敏度比单波长法高。

图 2 溶液酸度对ΔIRLS的影响Fig. 2 Effect of solution acidity on ΔIRLS
2.2.2 灿烂绿浓度
取1.00 mL甜蜜素标准操作液、1.00 mL pH 9.27 Tris-HCl溶液,按1.3.3节RLS强度的测定方法,考察SWO-RLS法和DWO-RLS法测定时灿烂绿浓度对甜蜜素-灿烂绿体系ΔIRLS的影响,结果见图3。当灿烂绿浓度为3.00×10-5mol/L时,ΔIRLS达最大,当灿烂绿浓度为0.50×10-5~3.00×10-5mol/L范围时,随着浓度增大,体系的ΔIRLS随之增大;当灿烂绿浓度为3.00×10-5~4.00×10-5mol/L范围时,随着浓度增加,体系ΔIRLS不断下降。原因是当灿烂绿浓度低于3.00×10-5mol/L时,因用量不够,甜蜜素反应不完全;当灿烂绿浓度大于3.00×10-5mol/L时,用量过多导致自聚作用增强,影响其与甜蜜素的完全反应。从图3还可知,用DWO-RLS法测定的灵敏度比SWO-RLS法高。

图 3 灿烂绿浓度对ΔIRLS的影响Fig. 3 Effect of brilliant green concentration on ΔIRLS
2.2.3 试剂加入顺序
取1.00 mL甜蜜素标准操作液、1.00 mL pH 9.27 Tris-HCl溶液和3.00 mL 灿烂绿溶液,按1.3.3节RLS强度的测定方法,考察这几种物质的不同加入顺序在用SWORLS法和DWO-RLS法测定时对甜蜜素-灿烂绿体系ΔIRLS的影响。结果表明,ΔIRLS相对最大(ΔIRLS(341)=422,ΔIRLS(470)=346,ΔIRLS(341+470)=768),灵敏度最高的试剂加入顺序为甜蜜素溶液、Tris-HCl溶液、灿烂绿溶液。故实验按此最佳试剂加入顺序进行。
2.2.4 反应时间及稳定性
按选定的各物质的最佳条件及试剂的最佳加入顺序,加入1.00 mL甜蜜素标准操作液、1.00 mL pH 9.27 Tris-HCl溶液和3.00 mL灿烂绿溶液,按1.3.3节RLS强度的测定方法,用DWO-RLS法考察甜蜜素与灿烂绿的反应在0~100 min内生成的新物质对ΔIRLS的影响。实验表明,20 min内,随着反应时间的延长,ΔIRLS逐渐增大,到20 min达最大(ΔIRLS(341+470)=824);20 min后,随着反应时间的不断延长,ΔIRLS不再增大,基本处于同一平台。故实验选在20 min后测定。
2.3 标准曲线及相关参数
按1.3.3节RLS强度的测定方法,配制0.00、0.50、1.00、1.50、2.00、2.50 mL甜蜜素标准操作液的标准系列溶液。用SWO-RLS法和DWO-RLS法测定各溶液的ΔIRLS(341)、ΔIRLS(470)及ΔIRLS(341+470),作ΔIRLS-ρ标准曲线,标准曲线的相关参数见表1。可见,用DWO-RLS测定的灵敏度比SWO-RLS法更高。DWO-RLS检测样品的定量限分别为1.05 mg/100 g(蛋糕)、0.974 mg/100 g(饼干)和0.994 mg/100 g(面包)。

表 1 甜蜜素标准曲线相关参数Table 1 Calibration curve equations, detection wavelengths, LOD and LOQ for cyclamate detected by different RLS methods
2.4 共存物质的影响
按1.3.3节RLS强度的测定方法,考察相对误差≤±5%时,某些共存物质对测定0.201 mg/L甜蜜素的干扰情况,见表2。结果显示,氨基酸、糖类及常见绝大多数阴、阳离子不干扰甜蜜素的测定。故本方法有良好的选择性。
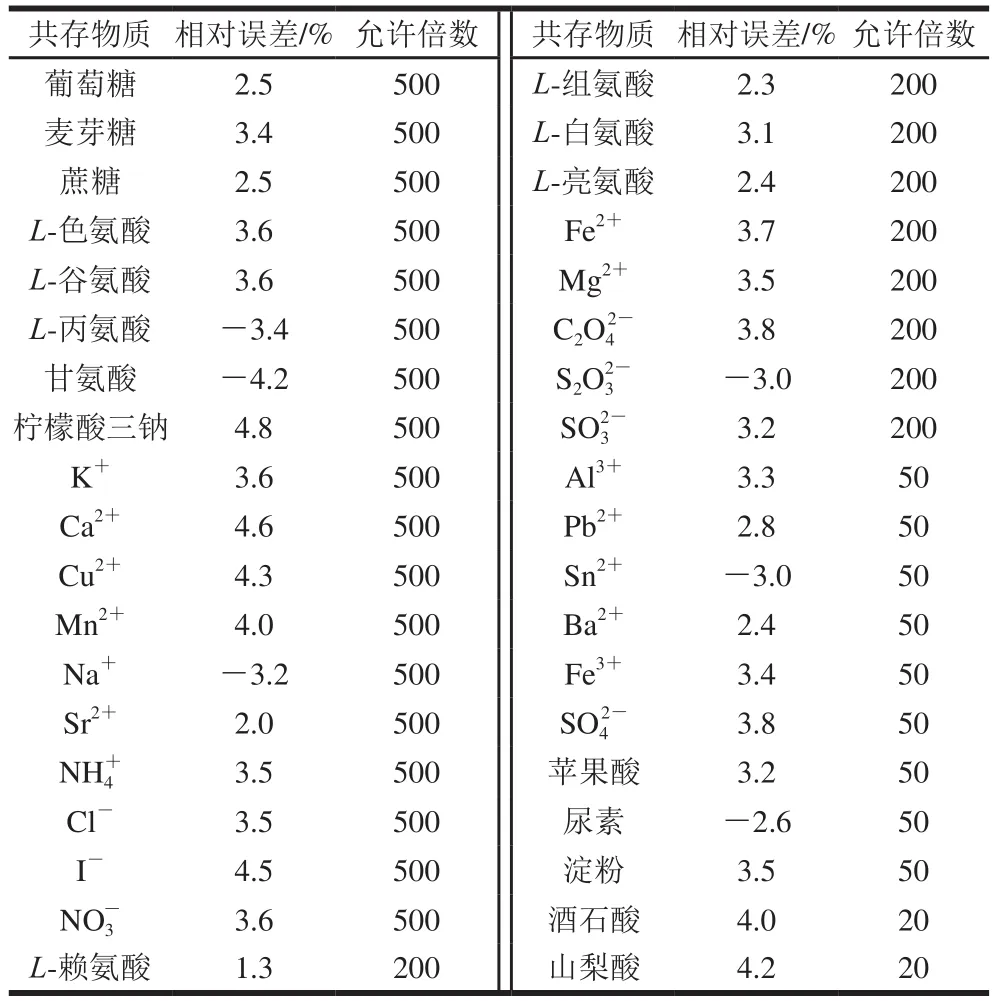
表 2 共存物质的影响Table 2 Effect of coexistent substances
2.5 样品分析
2.5.1 样品测定结果
移取1.3.2节已制备的各待测液0.30 mL代替1.3.3节中的甜蜜素标准操作液,并按1.3.3节方法加入其他试剂溶液,用水定容至10 mL。在选定的荧光仪条件下扫描RLS光谱,用DWO-RLS法测定341 nm和470 nm波长处待测液的甜蜜素含量(各平行测定5 份),计算出原食品样中甜蜜素含量,并与国标法(GB 1886.37—2015《食品添加剂 环己基氨基磺酸钠(又名甜蜜素)》)测定结果对照,结果见表3。
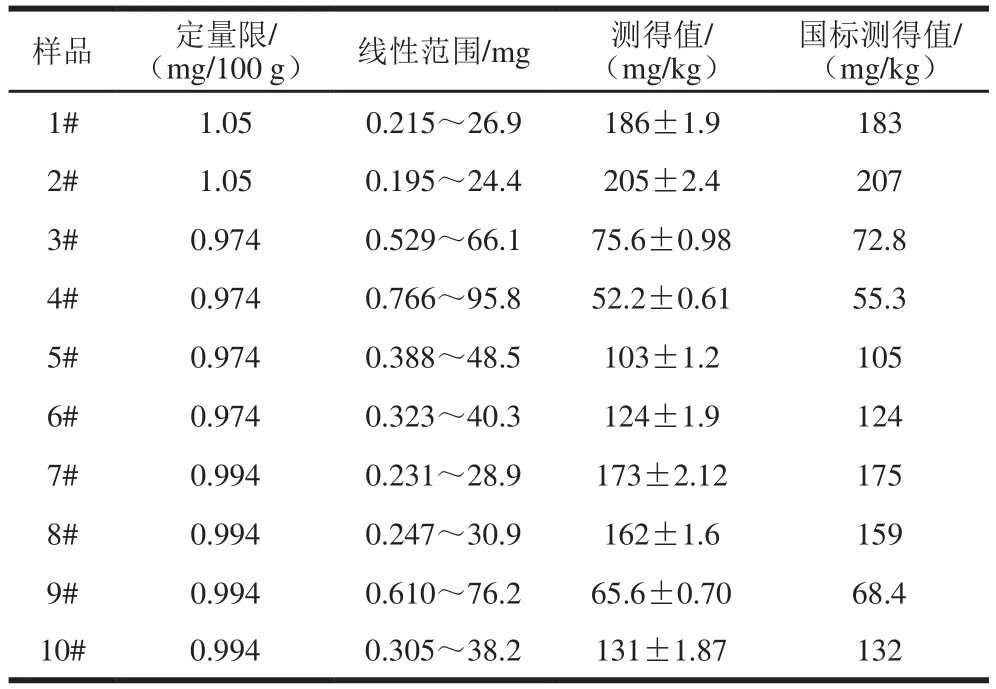
表 3 样品分析结果Table 3 Analytical results of samples
2.5.2 加标回收实验结果
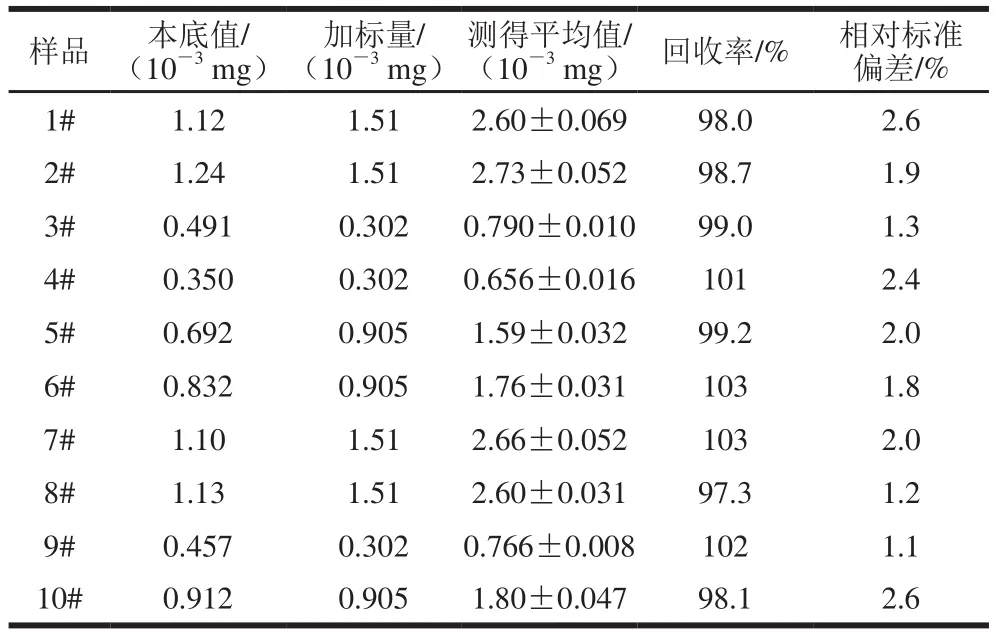
表 4 样品加标回收率(n=5)Table 4 Recoveries for spiked samples (n= 5)
按1.3.2节方法称取已粉碎、混匀的各食品样2 g左右(精确至±0.000 1 g),加适量水后,再加入0.50~2.50 mL范围的甜蜜素标准贮备液,后续操作按1.3.2节样品处理方法制备各待测液。取该待测液0.30 mL,按1.3.3节方法测定甜蜜素含量,并计算回收率及相对标准偏差(各平行测定5 份),以判断新方法的准确度,结果见表4。样品的加标回收率(n=5)为97.3%~103%,相对标准偏差(n=5)为1.1%~2.6%,说明本方法具有较高的准确度和精密度。
3 结 论
依据甜蜜素与灿烂绿的缔合反应,采用DWO-RLS法测定低脂食品中的甜蜜素,具有方法简便、操作简单及有很高灵敏度的优点,方法选择性良好,准确度和精密度符合定量分析要求,样品处理安全、简单,测定成本低,易于普及,适于糕点类食品的批量分析。
