载气类型对气相色谱法分离顺-反脂肪酸异构体的影响
2021-03-31裴紫薇赵云峰陈达炜方从容
裴紫薇,杨 杰,张 磊,周 爽,赵云峰,陈达炜,苗 虹,方从容,*
(1.国家卫生健康委员会食品安全风险评估重点实验室,国家食品安全风险评估中心,北京 100021;2.广州市花都区疾病预防控制中心,广东 广州 510800)
食品中反式脂肪酸(transfatty acids,TFA)主要是指部分氢化植物油、反刍动物的牛奶和肉类产品脂肪中的C18:1TFA异构体,食用油加工中除臭步骤导致全顺式多不饱和脂肪酸中双键异构化产生的C18:2TFA和C18:3TFA异构体。流行病学研究已揭示TFA摄入过多可增加心血管疾病的风险,因此,食品营养标签规定必须标出TFA的含量[1-5]。2018年世界卫生组织将评估和监测食品供应中TFA的含量及人群中TFA消费量的变化列为13 个工作规划的优先目标之一,因此准确定量TFA含量极为重要。
气相色谱-火焰离子化检测法是国际上油脂中TFA、饱和脂肪酸(saturated fatty acids,SFA)、单不饱和脂肪酸(monounsaturated fatty acids,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)最常用的定量技术。通用检验方法包括美国石油化学家学会(American Oil Chemists Society,AOCS)AOCS Ce 1h-05[6]、AOCS Ce 1j-07[7],国际标准化组织(International Standards Organization,ISO)ISO 12966[8]、BS ISO 16958:2015[9]和美国分析化学家协会(Association of Official Analytical Chemists,AOAC)AOAC 2012.13[10]等,分析柱是涂有极性氰基烷基聚硅氧烷固定相的100 m毛细管柱如CP-Sil88或SP-2560,操作温度为等温180 ℃或梯度温度程序,能分离出油脂中大多数脂肪酸的顺式异构体和相应的反式异构体[6-11],油脂中的TFA、SFA、MUFA和PUFA同时被分析并定量。我国食品中的TFA和其他脂肪酸(SFA、MUFA和PUFA)测定方法分属不同的标准,方法间实验条件也不同,其中包括色谱分离所用载气。AOCS Ce 1f-96-2001[11]载气为氢气、氦气和氮气,但ISO、AOCS和AOAC方法中[6-10]的载气为氢气和氦气,特别是ISO 12966:4-2015中明确指出载气不能为氮气[8]。GB 5009.257—2016《食品中反式脂肪酸的测定》[12]的载气为氦气,而GB 5009.168—2016《食品中脂肪酸的测定》[13]、GB 5413.27—2010《婴幼儿食品和乳品中脂肪酸的测定》[14]和GB 5413.36—2010《婴幼儿食品和乳品中反式脂肪酸的测定》[15]3 个方法的载气为氮气。TFA和顺式脂肪酸异构体的最佳分离条件受色谱柱型号、色谱柱温度、载气类型、入口压力以及进样浓度等参数的影响,在以往研究中色谱柱极性及温度敏感性对分离TFA和顺式脂肪酸异构体的影响已有报道[16-21],但载气的类型对TFA分离的影响鲜有报道,针对国标TFA和其他脂肪酸分析方法[12-15]中载气应用不统一,特别是GB 5413.36—2010推荐载气为氮气的情况,本研究选择C18:1单个TFA异构体间含量差异较大的起酥油、黄油、饼干和蛋糕4 种样品和含有C18:2TFA、C18:3TFA的植物油样品,在等温180 ℃和梯度温度2 种操作温度条件下,分别以氮气和氦气为载气,考察载气的类型对顺反式脂肪酸异构体的分离和准确定量的影响,以满足食品营养标签中对TFA定量的要求。
1 材料与方法
1.1 材料与试剂
起酥油、黄油、饼干、蛋糕和植物油 市购。
52 种混合脂肪酸甲酯标准品(GLC 674)、二十一碳酸甘油三酯(内标,纯度≥99.0%) 美国Nu-Chek Prep公司;亚油酸甲酯异构体标准品(10 mg/mL,C18:29t,12t、C18:29c,12t、C18:29t,12c和C18:29c,12c)(Catalog No 47791)、亚麻酸甲酯异构体标准品(10 mg/mL,C18:39t,12t,15t、C18:3 9t,12t,15c、C18:3 9t,12c,15t、C18:3 9c,12t,15t、C18:3 9c,12c,15t、C18:39c,12t,15c、C18:39t,12c,15c和C18:39c,12c,15c)(Catalog No.47792) 美国Supelco公司;C18:1顺-反脂肪酸异构体混标(2.5 mg/mL)(Catalog No. 40495-U) 美国Sigma公司;乙醚、石油醚、乙醇、异辛烷(均为色谱纯)美国Fisher Chemical公司;盐酸 北京化工厂;焦性没食子酸、氢氧化钾(均为优级纯),硫酸氢钠(分析纯) 上海麦克林生化科技有限公司。
1.2 仪器与设备
7890气相色谱仪(配火焰离子化检测器) 美国安捷伦科技有限公司;HH-6型水浴锅(40~100 ℃) 北京科伟永兴仪器有限公司;B-300旋转蒸发仪 瑞士Büchi公司;VORTEX-2涡旋混合器 美国Scientific Industries公司;3K15离心机 美国Sigma公司。
1.3 方法
1.3.1 GC条件
CP-Sil88色谱柱(100 m×0.25 mm,0.2 μm);温度程序1:等温180 ℃,保持60 min;温度程序2:120 ℃,持续10 min;以3 ℃/min升至180 ℃;以1.5 ℃/min升至200 ℃,保持3 min;再以2 ℃/min升至225 ℃,保持20 min;进样口温度240 ℃;检测器温度250 ℃;高纯氦气(纯度>99.999%);高纯氮气(纯度>99.999%);恒压模式,压力38 psi;分流比100∶1;进样量1.0 μL。
1.3.2 样品前处理
市购固体样品用研磨机粉碎,于-20 ℃以下冷冻保存,分析时将其解冻后,在室温条件下使用。
黄油、饼干和蛋糕样品处理采用GB 5009.168—2016《食品中脂肪酸的测定》[13]酸水解提取-酯交换法:称取均匀试样0.5~1.5 g(精确至0.1 mg,约含脂肪60~100 mg)移入到125 mL三角瓶中。加入约100 mg焦性没食子酸,再加入2 mL 95%乙醇溶液和4 mL水,混匀。加入盐酸溶液10 mL混匀。将三角瓶放入70~80 ℃水浴中水解40 min。每隔10 min振荡三角瓶,使黏附在三角瓶壁上的颗粒物混入溶液中。水解完成后,取出三角瓶冷却至室温。加入10 mL 95%乙醇溶液,混匀。将水解液转移至分液漏斗中加入25 mL乙醚,振摇1 min,再加入25 mL石油醚振摇1 min,静置10 min,将醚层提取液收集到150 mL烧瓶中。按照以上步骤重复提取水解液1 次。全部提取液收集到150 mL烧瓶中,准确加入2.0 mL C21:0TAG内标溶液3.00 mg/mL,于旋转蒸发仪浓缩至干,残留物为脂肪提取物。将脂肪提取物用7 mL异辛烷溶解并转移至15 mL离心管中,加入350 µL氢氧化钾-甲醇溶液,盖上塞猛烈振摇30 s后静置至澄清。加入约1 g硫酸氢钠,猛烈振摇。4 000 r/min离心5 min,将上层溶液移至进样瓶中,待测。
起酥油和植物油样品:称取0.1 g样品于50 mL烧瓶中,准确加入2.0 mL C21:0TAG内标溶液3.00 mg/mL,于旋转蒸发仪浓缩至干。用7 mL异辛烷溶解并转移至15 mL离心管中,加入350 µL氢氧化钾-甲醇溶液,盖上塞猛烈振摇30 s后静置至澄清。加入约1 g硫酸氢钠,猛烈振摇。4 000 r/min离心5 min,将上层溶液移至进样瓶中,待测。
1.3.3 顺-反脂肪酸甲酯异构体的确证和定量
取C18:1、C18:2和C18:3顺-反脂肪酸甲酯混合标准溶液分别注入气相色谱仪。C18:1顺-反脂肪酸异构体混标(40495-U,2.5 mg/mL)中单个C18:1反式异构体出峰顺序的识别和定量区间根据BS ISO 16958:2015[9]和AOAC 2012.13[10],C18:2和C18:3顺-反异构体根据标准保留时间对色谱峰进行定性,采用内标(C21:0)-响应因子法定量。单个C18:1反式异构体加和为C18:1TFA总量,单个C18:2反式异构体加和为C18:2TFA总量,单个C18:3反式异构体加和为C18:3TFA总量。
1.4 数据统计
每组数据重复3 次,利用Origin 8.5软件处理数据作图。利用SPSS 19.0软件进行配对t检验及相关性分析。
2 结果与分析
2.1 TFA异构体的分离度及含量
2.1.1 C18:1TFA异构体分离度
反式C18:1脂肪酸异构体位于4t~11t双键位置的峰很容易与油酸甲酯(C18:19c)的峰分离,但双键位置位于12t~14t之间的反式C18:1异构体的峰易与C18:19c的峰重叠[21],因此,BS ISO16958:2015[9]和AOAC 2012.13[10]中规定当C18:1TFA含量不小于0.5 g/100 g时,C18:113t,14t(6-8c)与C18:19c的分离度不小于(1.00±5)%。根据文献[9-10]提供分离度的计算公式,分别计算出顺-反C18:1异构体混标40495-U(2.5 mg/mL)、4 种样品(起酥油、黄油、饼干和蛋糕)分别在2 种载气2 种温度条件下分离度。如表1、图1所示,以氦气为载气,40495-U标准溶液和4 种样品在等温180 ℃和梯度程序升温条件下的分离度范围分别为1.20~1.58和1.02~1.20,都达到分离度的要求,且等温分离度大于梯度升温。以氮气为载气,40495-U标准溶液和4 种样品在等温180 ℃条件下分离度范围为0.93~1.34,除饼干略低于0.95外,其他样品都达到了分离度要求;梯度程序模式下,饼干样品中的分离度为0.67,其他样品由于C18:113t,14t(6-8c)与C18:19c峰重叠,因此无分离度。从TFA和其他脂肪酸分离的效率及柱效角度考虑,氢气是最适合的载气,因此国际通用方法推荐的载气首推为氢气,其次为氦气。但氢气因其自身安全性的问题,在国内较少使用。氦气的分离效率好于氮气,这在色谱柱对同分异构体进行拆分时表现尤为重要[22],通过分离度结果也表明,氦气为载气可以满足不同温度操作条件的要求,而氮气只适用于等温操作条件,因此以氦气为载气优于以氮气为载气。

表 1 2 种载气2 种温度操作条件下C18:1异构体分离度(n=3)Table 1 Resolution of C18:1 isomers using two carrier gases under two temperature modes (n= 3)


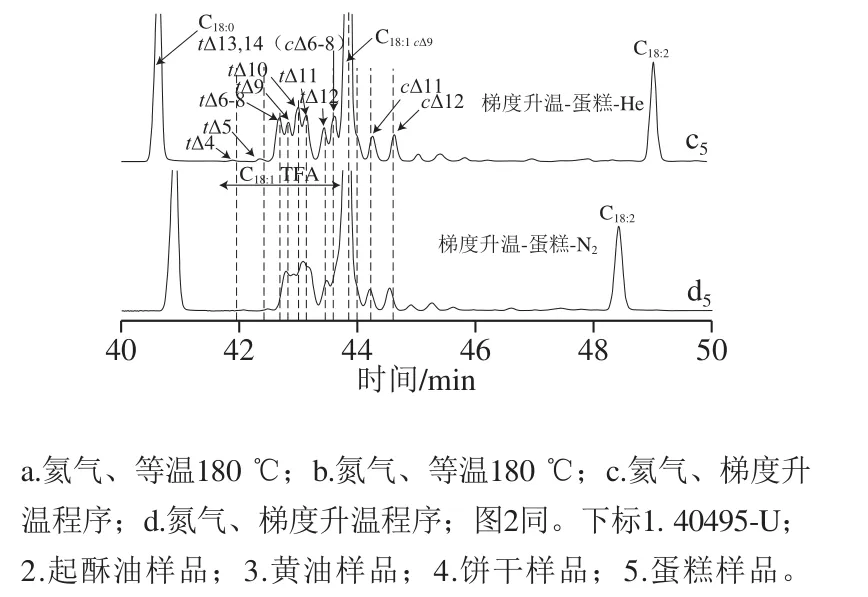
图 1 不同样品C18:1顺反异构体甲酯色谱分离谱图Fig. 1 Chromatograms of methyl esters of C18:1 isomers in cake samples
2.1.2 C18:1TFA异构体计算结果

表 2 2 种载气2 种温度操作条件下C18:1 TFA异构体含量(n=3)Table 2 C18:1 TFA isomer contents determined using different carrier gases under different temperature conditions (n= 3)%
采用内标-响应因子法对4 种样品中的单个C18:1TFA异构体定量,再将单个TFA异构体加和计算出样品中总TFA含量。如表2所示,以氦气为载气,C18:14t~C18:114t反式异构体在等温180 ℃和梯度程序升温2 个分离条件下全部检出,配对样品t检验结果显示P值大于0.05,C18:1TFA总量无显著性差异,且单个TFA异构体分离清晰,能显示出C18:1TFA异构体的构成,如起酥油样品中C18:110t含量为主,黄油样品中C18:111t含量最高;饼干样品中C18:1的6-8t、10t、13t,14t(6-8c)含量相当,蛋糕样品中C18:16-8t~13t,14t(6-8c)各异构体含量差异不大。以氮气为载气,2 种温度条件下,C18:19t、C18:110t和C18:111t三个异构体峰几乎全部重叠或勉强能识别;等温180 ℃条件下,配对样品t检验结果显示P值大于0.05,C18:1TFA总量与氦气测定结果下的总量无差异,而梯度升温条件下,起酥油、黄油和蛋糕样品中由于C18:113t,14t(6-8c)与C18:19c重叠没有检出,因此C18:1TFA总量明显低于氦气条件下测定的总量,但饼干样品,虽然C18:113t,14t(6-8c)与C18:19c的分离度只有0.67,但因为C18:113t,14t(6-8c)与C18:19c的含量仅相差1 倍,因而这两异构体能较明显分离,C18:1TFA总量与氦气条件下的总量基本无差异,可见除分离度外,C18:19c含量的高低也是能否准确定量C18:1TFA影响因素之一。
以氦气为载气,能分离出大部分C18:1TFA异构体,并独立定量,这对于反刍动物衍生的食品(尤其是乳脂)尤为重要,因为C18:111t是主要的C18:1TFA异构体,约占总反式C18:1异构体的30%~50%,其对人类的潜在健康益处与其作为顺式共轭亚油酸(C18:29c,11t)前体的作用有关[21,23-25]。C18:110t是另一种值得注意的C18:1TFA异构体,其在牛奶和肉类中的含量等于或大于C18:111t的含量,当某些饮食不适合反刍动物时,表明存在替代的生物氢化途径,C18:110t与C18:111t不同,不会对人类产生任何有益的健康影响[25-29]。含有部分氢化植物油的食品中,主要的TFA也是C18:1异构体,C18:19t占反式-C18:1总异构体的20%~30%[5]。现在,国际上通用方法都要求准确测量TFA单个异构体含量,特别是C18:1TFA异构体,GB 5009.257—2016也要求对C18:1TFA中的6t、9t、11t准确定量。氮气为载气,等温180 ℃条件下可以满足TFA定量的要求,但等温分析中短链脂肪酸如C4:0等易和溶剂峰重叠,而长链脂肪酸如C22:6n3则洗脱时间长,因此样品适用范围窄。本研究通过实验证明氦气替代氮气作为同时测定于食品中的TFA、SFA、MUFA和PUFA的载气,C18:1TFA异构体的分离度高,定量结果准确,样品适用性广。
2.1.3 C18:2TFA和C18:3TFA的分离度及含量
选择植物油为样品,分别考察在2 种载气2 种温度操作条件下C18:2TFA和C18:3TFA的分离度和含量。如表3、图2所示,载气类型和不同的温度操作条件对C18:2TFA异构体的分离和定量影响不大,定量结果无差异。在2 种载气2 种温度条件下,大多数C18:3TFA异构体分离度无区别,C18:39t,12c,15c与C20:1基线分离,C18:3TFA异构体总量无差异,但以氦气为载气,C18:39t,12t,15c和C18:39t,12c,15t之间有可见的分离,与氮气相比有一定优越性。

表 3 不同条件下C18:2 TFA和C18:3 TFA含量(n=3)Table 3 Contents of C18:2 TFA and C18:3 TFA determined using different carrier gases under different temperature conditions (n= 3)%
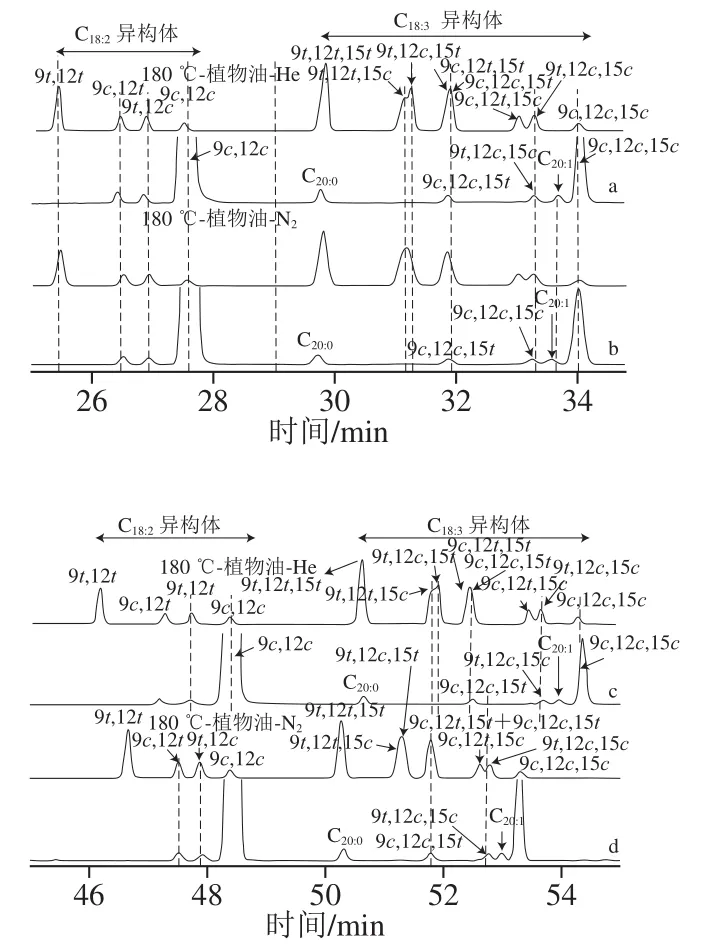
图 2 植物油样品C18:2和C18:3顺-反异构体甲酯色谱分离谱图Fig. 2 Chromatograms of methyl esters of C18:2 and C18:3 isomers in vegetable oil samples
2.2 不同批号色谱柱分离的一致性
精炼植物油中C18:3TFA异构体是加工过程中产生的,菜籽油和花生油等食用油脂中均含有大量C20:1及C18:3n3反式异构体,特别是C18:39c,12c,15t和C18:39t,12c,15c大量存在[30]。在色谱分离中,C20:1与C18:39t,12c,15c易出现部分或全部重叠,因此C20:1与C18:3n3异构体的分离非常重要。在2017—2019年内购入Sil88 100 m色谱柱,每个色谱柱批号都不同,购买后每次采用同一植物油样品在等温180 ℃进行C20:1和C18:3n3反式异构体的分析,发现不同批次的Sil88色谱柱分离C18:39t,12c,15c、C20:1和C18:3n3的能力有所差别,这种差异很可能源于制造过程中柱极性的变化[30-32]。这提示,应用高极性氰丙基柱测定顺反式脂肪酸含量,应根据色谱柱实际分离情况,对操作温度进行适当的调整,并定期仔细监测脂肪酸的出峰顺序和保留时间,以确保准确评估TFA含量。
3 结 论
本研究以CP-Sil88毛细管柱为分析柱,在等温180 ℃和梯度升温2 种温度操作条件下,分别以氦气和氮气为载气,考察起酥油、黄油、饼干和蛋糕4 种样品中的18:1单个TFA异构体的分离度及C18:1TFA总量。以氦气为载气,能分辨出不同浓度的C18:19t、C18:110t和C18:111t异构体,并单独准确定量,不会低估C18:1TFA异构体总量。载气类型对植物油中18:2反式异构体的分离度和含量无影响,氦气相较于氮气,在植物油中C18:3反式异构体的分离上有一定优势。不同批号的CP-Sil88毛细管柱在C20:1与C18:39t,12c,15c分离上具有一定不一致性,因此,有必要使用标准品监测不同脂肪酸甲酯的出峰顺序和保留时间,并对温度程序仔细进行微调。
