腊肠发酵过程中细菌多样性评价及其对风味的影响
2021-03-31王玉荣葛东颖尚雪娇张振东赵慧君
郭 壮,王玉荣,葛东颖,尚雪娇,张振东,赵慧君
(湖北文理学院,湖北省食品配料工程技术研究中心,湖北 襄阳 441053)
腊肠作为我国传统发酵肉制品的典型代表,因其风味独特、口感醇厚和特有的“腊香味”而深受人们的喜爱[1-2]。传统腊肠的制作方法一般较为简便,以猪肉为主要原料,将其绞碎后拌入食盐、香辛料、白糖和酒等辅料腌制一段时间后灌入肠衣,经微生物发酵制作而成[3]。研究表明,腊肠制品的好坏与腊肠中的细菌构成和动态变化有着紧密的联系[4]。Pasini等[5]发现以乳酸菌作为发酵剂时能加速肉制品中生物胺的生成从而促进其成熟,Zhang Yulong等[6]发现乳酸菌在腊肠的发酵过程中具有抗氧化活性,且大量研究也表明葡萄球菌[7]、红曲菌[8]和戊糖乳杆菌[9]对腊肠品质的提升具有显著影响。传统腊肠通常采用自然发酵法,其细菌受环境影响较大。随着发酵的进行及环境的变化其细菌结构也在不断发生变化,而不同的细菌构成对腊肠的风味品质有极大影响。目前,对于腊肠的研究主要集中在纯种发酵[10]和抗氧化[11]等方面,而少有关于腊肠发酵过程中风味品质和细菌的变化研究,因此研究腊肠发酵过程中细菌结构和风味的变化就显得尤为重要。
电子鼻作为一种仿生设备,能够模仿人类的鼻子,通过传感电极准确识别食品中特定的风味物质,并给出数字化的评价,其结果具有准确性好、可重复性高和不受主观影响等优点[12]。目前,电子鼻已经广泛应用于虾膏[13]和鱿鱼[14]等发酵食品的风味品质评价中。随着测序技术的发展和普及,以Illumina MiSeq测序平台为代表的第2代测序技术具有检测速度快和通量高等特点,可以全面、客观、无偏地了解某一微生态系统中微生物群落结构[15],因而被广泛应用于解析环境样品中的微生物多样性[16]。目前,该技术在腊肠[17]和酸奶[18]等发酵食中应用广泛。
本研究采集不同时间点的自制腊肠样品共计9 个,首先采用电子鼻技术对其风味品质进行评价,继而使用MiSeq高通量测序技术对其细菌多样性进行解析。通过对发酵过程的动态监测,以期为腊肠的发酵工艺改良、发酵剂菌株的筛选和品质改良提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
五花肉、八角、香叶、桂皮 市售;食盐 中盐东兴盐化股份有限公司;白砂糖 上海上棠食品有限公司;白酒 北京顺鑫农业股份有限公司牛栏山酒厂。
DNeasy mericon Food Kit DNA基因组提取试剂盒德国QIAGEN公司;DNA 1000试剂盒 美国Agilent公司;5×TransStartTMFastPfuBuffer、FastPfuFly DNA Polymerase、dNTPs Mix 北京全式金生物技术有限公司。
1.2 仪器与设备
PEN3电子鼻 德国Airsense公司;ND-2000C微量紫外分光光度计 美国Nano Drop公司;vetiri梯度基因扩增仪 美国AB公司;R920机架式服务器 美国Dell公司;UVPCDS8000凝胶成像分析系统 美国Bio-Rad公司;2100芯片生物分析仪 美国Agilent公司;MiSeq高通量测序平台 美国Illumina公司。
1.3 方法
1.3.1 腊肠样品的制作与取样
选取五花肉进行适当修整,绞碎,按原料肉比例添加白砂糖1%、食盐1.8%、白酒1%、味精0.2%、生抽2%、冰水10%和八角、香叶及桂皮等辅料0.15%与肉搅拌均匀后进行灌肠。腊肠灌制时间为2018年12月14日,灌制好的腊肠置于室外晾晒,遇降雨或降雪则取回室内,并于晾晒第1、4、7、10、13、16、19、22、25天时进行采样,合计9 个样品。12月中旬至次年1月中旬,湖北省襄阳市每天的平均气温约在1~6 ℃之间。
1.3.2 样品中细菌宏基因组DNA提取
称取2 g腊肠样品捣碎后参照QIAGEN DNeasy mericon Food Kit DNA基因组提取试剂盒说明书进行样品宏基因组DNA提取。使用1%的琼脂糖凝胶电泳和分光光度法对宏基因组DNA的质量进行检测[19]。并将检验合格的DNA样本保存于-20 ℃的冰箱中备用。
1.3.3 细菌16S rRNA V3-V4区聚合酶链式反应(polymerase chain reaction,PCR)扩增和测序
本研究选用细菌16S rRNA V3-V4区的序列作为目的扩增片段,选用的正、反向引物分别为338F和806R通用引物。以提取的DNA为模板进行PCR扩增,反应体系和条件参照王玉荣等[20]方法。并将DNA样品的扩增产物使用Illumina MiSeq高通量测序平台进行测序。
1.3.4 生物信息学分析
根据Illumina MiSeq高通量测序平台质控规则对下机序列进行质控[20]。本研究使用QIIME(v1.70)平台对高质量的序列进行物种注释和多样性分析[21]。主要流程可参照王玉荣等[22]对鲊广椒细菌多样性的解析流程。通过GreenGene数据库对高质量序列进行同源性比对并构建可操作分类单元(operational taxonomic units,OTU)数据矩阵,使用PICRUSt对不同样本中细菌的基因功能进行预测[23]。
1.3.5 核酸登录号
本研究所有序列数据已提交至MG-RAST数据库,登录号为mgp90773。
1.3.6 基于电子鼻技术腊肠风味品质的评价
参考杨江等[24]方法并进行适当调整。准确称取15 g泥状腊肠样本于50 mL烧杯中,并用封口膜密封,室温放置30 min后进行顶空进样,平行测定3 次。电极响应曲线在50 s后达到平台期,选用59、60 s和61 s所对应的响应值进行后续分析。
1.3.7 腊肠水分含量的测定
参考邹金等[25]方法并进行适当调整。准确称取5 g切碎的腊肠样本于铝制托盘上,平铺均匀后选择卤素水分测定仪的快速烘干模式进行直接测定。
1.4 多元统计学分析
基于电子鼻测得的数据矩阵进行非加权组平均法(unweighted pair-group method witharithmetic means,UPGMA)聚类分析;基于OTU矩阵采用非加权和加权的UniFrac距离主坐标分析(principal coordinate analysis,PCoA)和肠型分析对腊肠细菌多样性进行研究;分别对优势细菌属(平均相对含量大于1.00%)与风味品质评价指标之间的相关性和显著性进行计算,选取相关系数绝对值大于0.5、且矫正后P值小于0.05的相关关系,采用Cytoscape软件进行相关性网络图绘制;同时对腊肠样本中优势细菌属和代谢通路进行相关性和显著性分析,并使用热图对结果进行可视化。使用R软件进行相关计算分析,并调用数据包(ggplot2)进行图形绘制,使用Origin 2017软件进行绘图。
2 结果与分析
2.1 不同发酵时间腊肠的风味品质分析
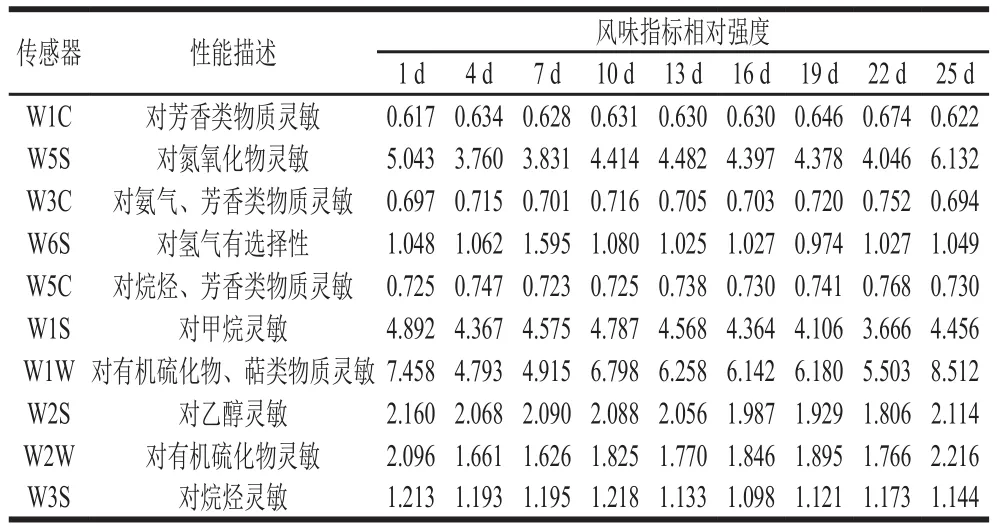
表 1 不同发酵时间腊肠风味指标相对强度(n=9)Table 1 Flavor intensity of sausage at different fermentation times (n= 9)
使用电子鼻技术对不同时间点腊肠的风味品质进行评价。由表1可知,电子鼻的不同类型传感器电极对腊肠样品中的风味物质均有很好的响应,能够准确反映腊肠风味品质随着发酵时间延长而发生的变化。W1C、W3C和W5C等对芳香类物质敏感的电极随着发酵时间的延长,其相对强度呈现出了一定的上升趋势,W2S、W3S和W6S等对烷烃、乙醇和氢气敏感的电极则呈现出一定的下降趋势,而其他电极并没有明显的变化趋势。
2.2 不同发酵时间腊肠中关键风味指标的甄别
在使用电子鼻对腊肠风味品质进行研究的基础上,进一步对腊肠样本进行聚类分析,使用UPGMA聚类分析对其进行划分,由图1可知,当距离为15时,不同发酵时间的腊肠样品整体上可划分为2 个明显的聚类,其中聚类I包括发酵时间为1、4 d和7 d的腊肠样品,而聚类II则是由发酵时间为10、13、16、19、22 d和25 d的腊肠样品构成。由此可见,当腊肠发酵到第10天时,其风味品质会发生较大的变化。值得注意的是,腊肠在发酵的前10 d中,不同时间点之间的距离较大,而发酵中后期样品之间的距离较小。由此亦说明,腊肠在发酵初期时风味变化较大,而随着时间延长,腊肠样品的风味也逐渐趋于稳定,从而形成腊肠特有的风味。因此推测腊肠初期发酵的好坏可能直接影响腊肠成品的风味。

图 1 基于UPGMA聚类分析的不同发酵时间对腊肠风味品质的影响Fig. 1 Effect of fermentation time on flavor quality of sausages evaluated based on UPGMA cluster analysis
以聚类结果为分组依据,将9 个时间点的腊肠样品分为两组进行研究,便于更好地探究腊肠的最优发酵时间。同时,使用Wilcoxon检验对不同分组中10 种电极的风味指标相对强度进行分析,结果如图2所示。
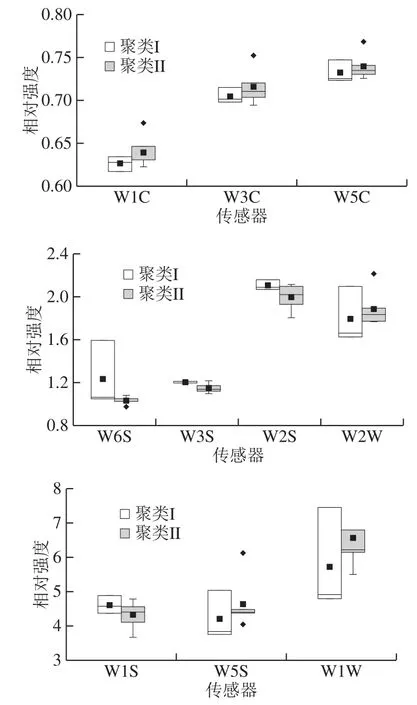
图 2 隶属于聚类I和聚类II腊肠样品典型风味物质的比较分析Fig. 2 Comparative analysis of typical flavor substances belonging to cluster I and cluster II of sausage samples
由图2可知,隶属于聚类I的腊肠在W1C、W3C、W5C、W2W、W5S和W1W传感器的风味指标相对强度均低于隶属于聚类II的腊肠样品,而在W6S、W3S、W2S和W1S风味指标则呈相反的趋势。经Wilcoxon检验发现,尽管所有风味指标在两组中均不存在显著性差异(P>0.05),但在芳香类物质和烃类物质的相对强度上却存在较为明显的变化趋势。
2.3 不同发酵时间腊肠中细菌多样性解析
在使用电子鼻对腊肠的风味品质进行评价的基础上,使用MiSeq高通量测序技术对腊肠中的细菌多样性进行解析。不同发酵时间腊肠样品中细菌门和属的比较分析如图3所示。
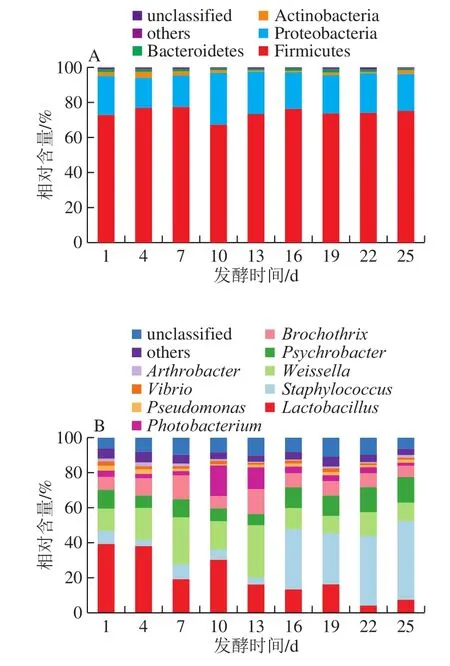
图 3 不同发酵时间腊肠中细菌门(A)和属(B)水平的比较分析Fig. 3 Comparative analysis of bacterial community compositions at phylum (A) and genus (B) levels in sausages at different fermentation times
由图3可知,在门水平上,腊肠中的细菌主要隶属于11 个门,其中优势细菌门(平均相对含量大于1%)分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),平均相对含量分别为74.10%、21.91%、1.65%和1.39%。在属水平上,腊肠中共发现169 个细菌属,其中优势细菌属共计9 个,分别为乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)、嗜冷杆菌属(Psychrobacter)、环丝菌属(Brochothrix)、发光杆菌属(Photobacterium)、假单胞菌属(Pseudomonas)、弧菌属(Vibrio)和节杆菌属(Arthrobacter),平均相对含量分别为20.57%、19.69%、16.68%、10.49%、9.12%、5.70%、1.76%、1.66%和1.10%。由此可知,腊肠中的细菌主要是由厚壁菌门和变形菌门构成,其平均相对含量为96.00%。值得注意的是,所有优势细菌属在9 个腊肠样品中均有出现,其累计平均相对含量为86.77%。
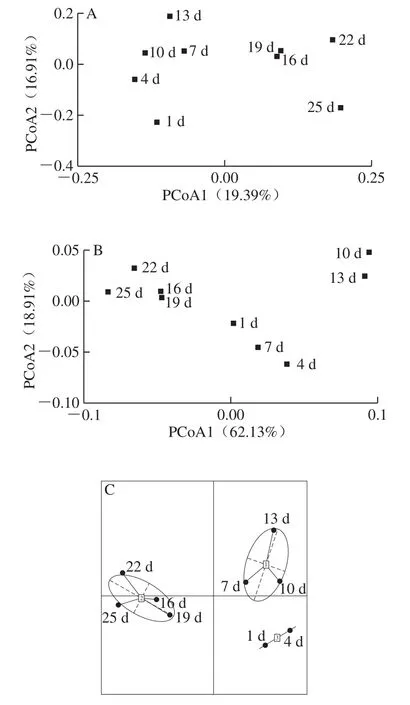
图 4 基于OTU矩阵的非加权(A)和加权(B)UniFrac距离PCoA及肠型分析(C)Fig. 4 PCoA of unweighted (A) and weighted (B) UniFrac distance based on OTU matrix and classification of sausages with different fermentation times (C)
进一步对样品间的细菌群落结构进行解析,结果如图4所示。不同发酵时间腊肠在空间排布上存在明显的分布规律。如图4A所示,前5 个时间点的腊肠全部分布在坐标空间的左侧,而后4 个时间点的腊肠则全部位于空间右侧,且前后时间点的样品也呈现出明显的变化趋势。由图4B可知,前3 个时间点的腊肠样品均分布在Y轴下端,发酵10 d和13 d的腊肠分布在空间右上角,而后4 个时间点的腊肠则全部集中在右上角。而通过图4C结果发现,其与聚类分析和PCoA结果一致。
2.4 腊肠发酵过程中关键细菌的甄别
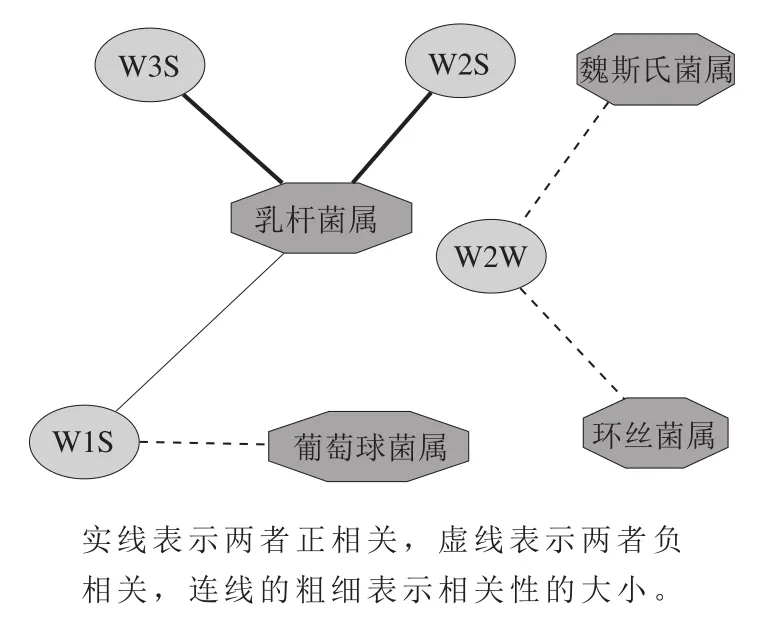
图 5 腊肠优势细菌属和风味指标相关性的网络图Fig. 5 Network diagram for the correlation between dominant bacteria and flavor indexes of sausages
进一步使用相关性分析对腊肠中优势细菌属和风味品质之间的关系进行探究,同时对腊肠发酵过程中的关键细菌进行甄别。由图5可知,有4 个优势细菌属与4 个风味指标之间存在显著相关(r>0.5,P<0.05)。乳杆菌属对腊肠风味形成有着较大的作用。研究发现,乳杆菌属与W1S、W2S和W3S之间显著正相关,葡萄球菌属与W1S之间显著负相关,而魏斯氏菌属和环丝菌属与W2W之间存在显著负相关。发酵时间对部分优势细菌和水分含量具有明显的影响,结果如图6所示。
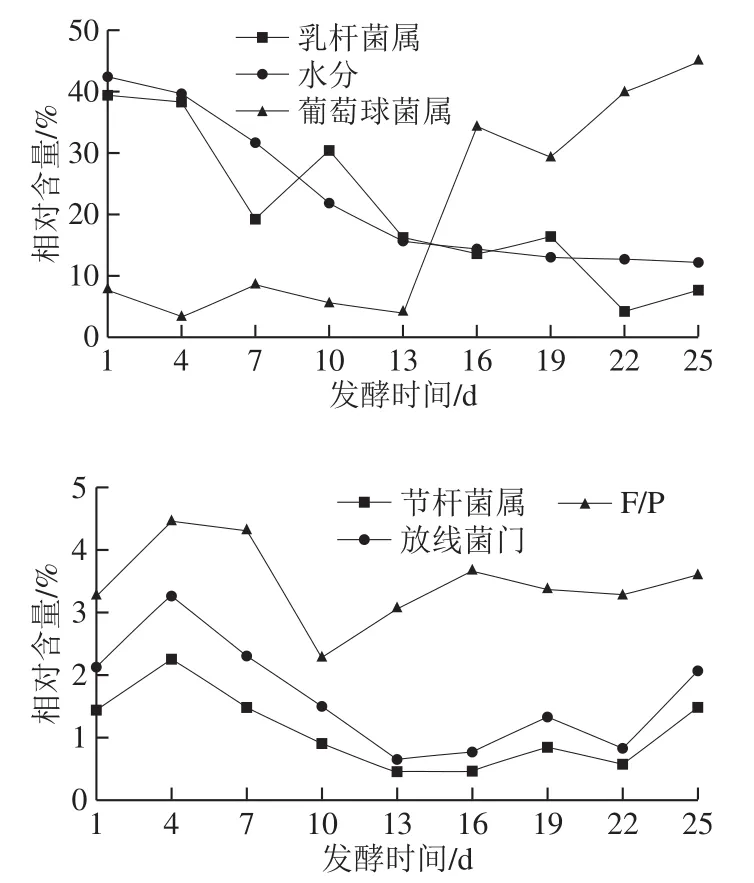
图 6 发酵时间对部分优势细菌和水分含量的影响Fig. 6 Effect of fermentation time on some dominant bacteria and water content
由图6可知,放线菌门、乳杆菌属、葡萄球菌属、节杆菌属、水分含量和F/P(Firmicutes/Proteobacteria)随着发酵时间的延长均呈现规律性的变化。乳杆菌属和水分含量随着时间延长逐渐下降,葡萄球菌属呈现出明显的上升趋势,而节杆菌属、放线菌门和F/P则呈现出上升-下降-上升的变化规律。经Wilcoxon检验发现,以聚类结果为分组依据,除葡萄球菌属外均存在显著性差异(P<0.05)。值得注意的是,尽管葡萄球菌属并不存在显著差异,但其在13 d以后的相对含量迅速增加。
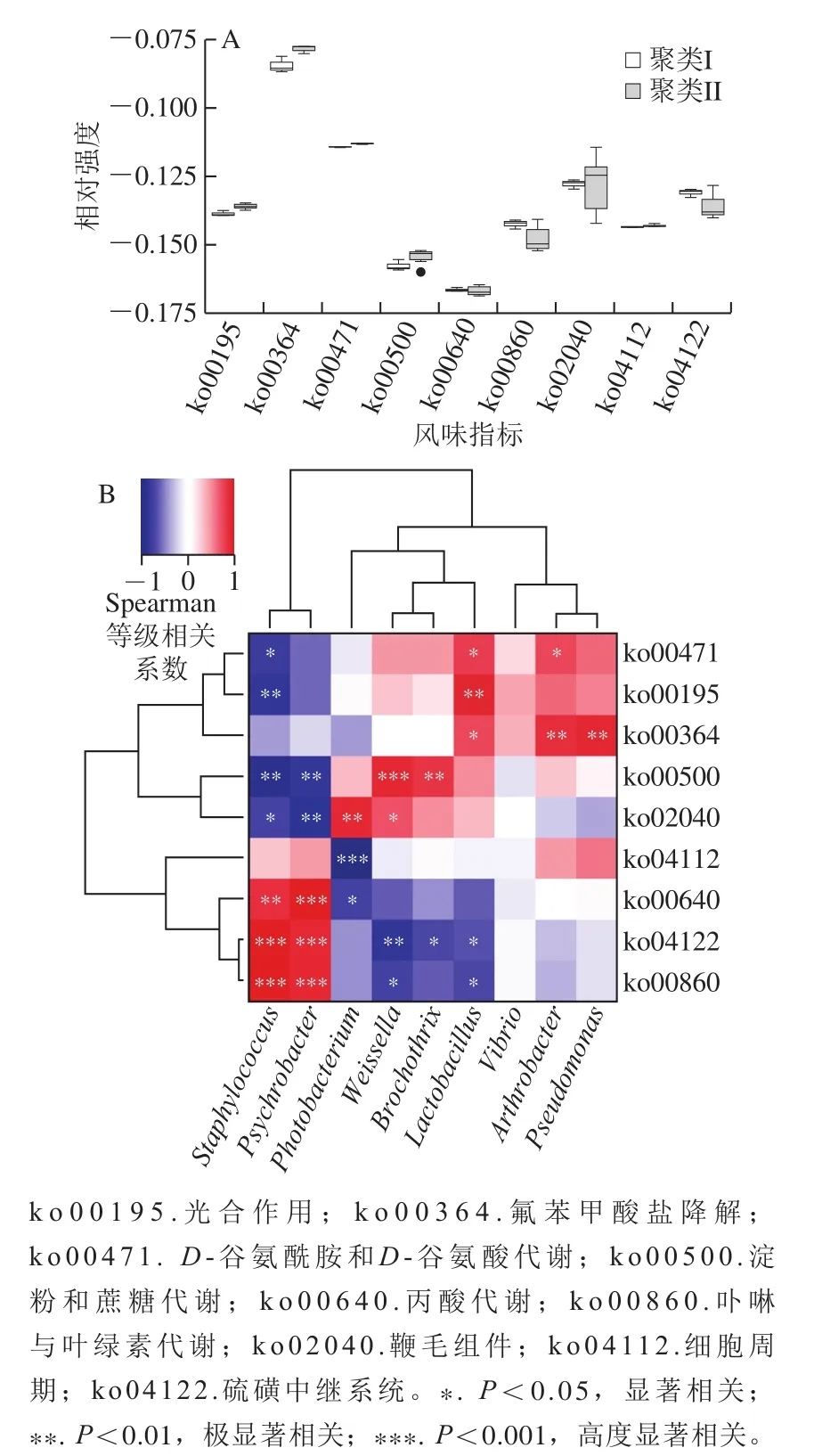
图 7 差异代谢通路相对丰度的箱型图(A)和差异代谢通路与优势细菌属之间的相关性热图(B)Fig. 7 Box diagram showing the relative abundances of differential metabolic pathways (A) and correlation heat map between differential metabolic pathways and dominant bacteria (B)
基于PICRUSt软件进行基因预测,并依据KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库进行基因功能注释,结果如图7所示。通过与KEGG数据库进行比对,共注释到5 类一级功能层,分别为细胞过程、环境信息处理、遗传信息处理、代谢和生物系统。其中与代谢和生物系统相关的代谢通路占比最多,分别为65.02%和15.25%。由图7A可知,注释到的223 个代谢通路中有9 条通路在两组之间存在差异。而与代谢相关的差异代谢通路有6 条,其中光合作用、D-谷氨酰胺和D-谷氨酸代谢、氟苯甲酸盐降解、淀粉和蔗糖代谢等功能在发酵前期较为活跃,而卟啉与叶绿素代谢、丙酸代谢等功能在发酵后期较为活跃。由图7B可知,葡萄球菌属、嗜冷杆菌属、发光杆菌属、魏斯氏菌属和乳杆菌属均与多条代谢通路存在显著相关。
3 讨论与结论
近年来,随着仿生设备的发展和普及,电子鼻因可以对食品中不同类型的挥发性风味物质进行客观、准确的数字化分析而使其在食品风味研究中得到了广泛应用。本研究采用电子鼻技术对不同发酵时间腊肠的风味进行了评价。结果发现随着发酵的进行,芳香类物质的相对强度逐渐上升,而烷烃、乙醇和氢气等的相对强度逐渐降低。研究发现[26],细菌可以代谢产生多种芳香类物质,赋予发酵食品特殊的芳香味,从而形成腊肠特有的芳香气。通过对腊肠进行聚类分析发现腊肠依据其风味指标可明显分为两个聚类,且前3 个时间点之间的距离较大,后6 个时间点之间的距离较小。由此说明,在第10天时腊肠的风味品质发生了较大变化。研究认为,腊肠风味形成的时间主要是发酵初期,并在第10天左右逐渐趋于稳定。
在使用电子鼻技术对腊肠中风味品质进行评价的基础上,采用MiSeq高通量测序技术对不同发酵时间腊肠中细菌多样性进行解析,结果发现腊肠中细菌主要由厚壁菌门和变形菌门构成,而在属水平上主要是由乳杆菌属、葡萄球菌属和魏斯氏菌属等构成。乳杆菌属是发酵食品中常见的发酵菌种,对发酵过程中挥发性和非挥发性风味化合物的代谢有重要的作用,是影响发酵制品风味的关键因素[27-28];葡萄球菌属可以促进腊肠的成熟,从而缩短腊肠的制作时间[29];而魏斯氏菌属同样可以缩短发酵制品的制作时间和提升其风味品质[30]。在发酵过程中,乳酸菌发酵碳水化合物产生乳酸和各种代谢产物,从而使腊肠逐渐成熟完成发酵过程。对腊肠中细菌的整体结构进行研究,PCoA和肠型分析结果显示不同发酵时间腊肠样品在空间排布上和基于腊肠风味指标的聚类结果相近。由此说明腊肠样品中的细菌影响腊肠风味品质的形成。
此外,本研究通过将优势细菌属和风味指标进行关联分析发现,乳杆菌属、葡萄球菌属和魏斯氏菌属均与风味指标之间存在显著相关。由此说明,乳酸菌对腊肠特有风味的形成有重要作用。通过PICRUSt软件对腊肠中细菌功能进行预测发现在发酵前期淀粉、蔗糖、氟苯甲酸盐、D-谷氨酰胺和D-谷氨酸代谢等功能更为活跃,且与乳酸菌之间呈显著相关。随着发酵的开始,乳酸菌大量消耗碳水化合物(淀粉和蔗糖)生成乳酸和各种代谢产物为腊肠风味品质的形成奠定基础。综上所述,不同发酵时间腊肠中细菌主要以乳酸菌为主,各种乳酸菌含量的变化也影响腊肠的发酵成熟和特殊风味的形成。而以细菌和风味指标作为考察依据反映发酵时间对腊肠品质的影响时,发酵时间控制在10 d左右,所得的腊肠品质较好。
