高产植酸酶乳酸菌发酵对黑豆面包蛋白质品质及烘焙特性的影响
2021-03-31曹伟超马子琳OmediJacobOJOBI郑建仙黄卫宁FilipARNAUT
罗 昆,曹伟超,马子琳,武 盟,Omedi Jacob OJOBI,郑建仙,黄卫宁,*,李 宁,Filip ARNAUT
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.华南理工大学食品科学与工程学院,广东 广州 510641;3.广州焙乐道食品有限公司,广东 广州 511400;4.焙乐道食品集团,比利时 布鲁塞尔 1201)
烘焙食品已成为世界主流食品,而随着人们消费水平的不断提高,营养单一的普通小麦面包已经越来越不能满足人们的需求。近年来,使用豆粉对谷物类食品进行营养品质强化已经被认为是一种良好的方法[1]。其中黑豆由于高蛋白、营养丰富的特点得到深入研究[2]。但和大部分豆类一样,黑豆也含有多种抗营养因子,其中植酸含量(干物质)较高,可达(18.32±1.18)mg/g[3];植酸具有结合食物中带正电荷的蛋白质、氨基酸的能力,得到的复合物不溶,人体在消化过程中难以吸收[4]。用酸面团技术减少植酸含量,改善面包蛋白质和烘焙品质已被证明是一种简单、低成本和成功的生物技术。杨文丹[5]使用马克斯克鲁维酵母发酵麦麸,发现发酵麦麸面包植酸含量显著降低;Coda等[6]通过添加蚕豆酸面团改善小麦面包的蛋白质品质;苏晓琴等[7]利用酸面团技术得到一款感官特性较优的绿豆面包。但是由于谷物内源植酸酶活力较低,即使通过酸化激活,植酸也无法有效降解[8]。因此使用含有植酸酶活力的乳酸菌发酵酸面团可能是提高面包蛋白质和烘焙品质的一种天然工具。
本研究使用高产植酸酶乳酸菌发酵黑豆粉,以小麦面包、黑豆面包和不含植酸酶黑豆酸面团面包为对照,探究高产植酸酶乳酸菌发酵对面包蛋白质品质和烘焙特性的影响,旨在为开发功能性黑豆面包提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
黑豆粉 山东呆豆家健康食坊;高级面包粉 中粮鹏泰面业有限公司;乳酸片球菌(Pediococcus acidilactici)L-19筛选自自然发酵的黑豆粉;胰蛋白酶(2 500 U/mg)、胃蛋白酶(1 200 U/g)(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
搅拌机 美国Kitchenaid公司;醒发箱、SM-302切片机 新麦机械(无锡)有限公司;FE20实验室pH计梅特勒仪器(上海)有限公司;SPX-150C型恒温恒湿培养箱 上海博迅实业有限公司医疗设备厂;TU-1810型紫外分光光度计 北京普析通用仪器有限责任公司;CT3型质构仪 美国Brookfield公司;1100高效液相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 酸面团制备
将高产植酸酶乳酸片球菌L-19接至MRS液体培养基培养24 h至对数稳定,6 000 r/min离心5 min弃上清液,并用无菌生理盐水洗涤离心2 次。洗涤后的菌体悬浮于无菌水,与称量好的黑豆粉混匀,使乳酸菌初始接种量为107CFU/g,DY(dough yield)值300。搅匀后放入37 ℃培养箱培养30 h,得到酸面团。使用不产植酸酶的乳酸菌K-12作为对照。
1.3.2 酸面团发酵过程中pH值、TTA和生长曲线测定
取10.00 g黑豆酸面团样品,与90 mL无菌水搅拌混匀20 min,静置10 min后测定其pH值;用0.1 mol/L NaOH溶液进行滴定,滴定终点为pH 8.6,消耗的NaOH溶液体积(mL)为黑豆酸面团总可滴定酸度(total titratable acidity,TTA)[9]。称取10 g黑豆酸面团在90 mL无菌生理盐水中,用无菌生理盐水进行梯度稀释,选取合适稀释梯度。取100 µL混合液在MRS固体培养基上涂布,37 ℃培养36 h,观察并进行菌落计数[10]。
1.3.3 酸面团发酵过程中蛋白酶活性测定
通过测定发酵过程中酸面团α-氨基态氮变化表征蛋白酶活性变化[11]。将不同发酵时间段的酸面团样品冷冻干燥,取1.0 g冻干样品,加入质量分数7% KClO4溶液2.5 mL,1 h混匀,11 000 r/min离心10 min,取0.8 mL上清液,加入0.6 mL 0.43 mol/L KOH溶液,静置1 h后8 000 r/min离心10 min,上清液即为待测液。配制溶液I和II[12],取待测液50 µL,加入溶液I 500 µL,蒸馏水950 µL,在100 ℃反应16 min,反应结束后快速冷却至室温,加入溶液II 2.5 mL,在570 nm波长处测定吸光度并以甘氨酸为标样制备标准曲线。
1.3.4 黑豆面包制备
小麦面包(WB)、黑豆面包(BB)和黑豆酸面团面包(L-19SDB,K-12SDB)配方见表1。制作流程:提前溶解盐和糖,将所有原料(除黄油外)倒入搅拌缸,慢搅3 min,快搅1 min;加入黄油后, 慢搅2 min,快搅3 min。搅拌后滚圆并松弛5 min,按90 g/个进行分割,松弛10 min后整形,置于模具,在38 ℃、相对湿度85%醒发箱中醒发90 min,放入烤箱(上火165 ℃,下火210 ℃)烘烤20 min。
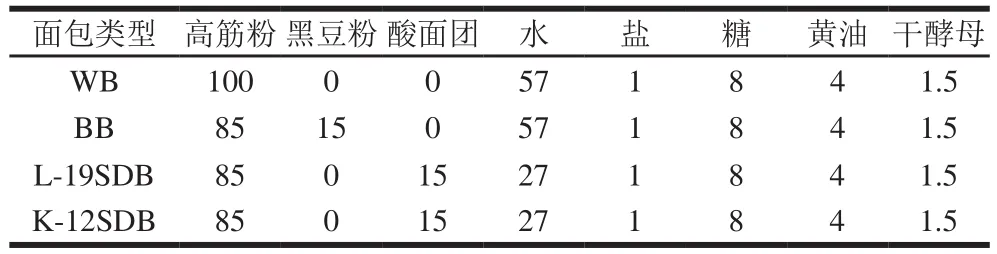
表 1 不同类型面包配方Table 1 Recipes for different types of bread%
1.3.5 面包植酸含量测定
参照Buddrick[13]和Zhao Huimin[14]等方法并略作修改。称取0.5 g样品,置入50 mL离心管中,加入30 mL 0.5 mol/L的HCl溶液,在150 r/min下室温振荡提取3 h。5 000 r/min离心30 min弃沉淀,取上清液。将1 mL上清液(空白组以1 mL HCl溶液代替)和2 mL 0.02% NH4Fe(SO4)2溶液混匀并沸水30 min,立即冰浴冷却,6 000 r/min离心30 min取上清液。将2 mL上清液与3 mL 1%双吡啶混匀进行颜色反应,在519 nm波长处测定吸光度。标准曲线制作:用HCl溶液溶解植酸标准品,使其质量浓度为1.0 mg/mL,再分别稀释成0、0.04、0.08、0.12、0.16 mg/L和0.2 mg/L植酸溶液,用作标准溶液绘制标准曲线。
1.3.6 面包蛋白含量及其IVPD测定
采用胃-胰蛋白酶两步消化法测定面包样品蛋白质体外消化率(in vitroprotein digestibility,IVPD)[15]。称取0.5 g面包芯样品于50 mL离心管,加入20 mg/mL胃蛋白酶溶液(pH 2.0)5 mL,置于恒温培养箱37 ℃、210 r/min振荡培养3 h。再添加0.5 mol/L NaOH溶液1.0 mL和5 mg/mL胰蛋白酶溶液(pH 8.0)15 mL,继续振荡2 h。消化后,立即取出并加入5 mL 10%三氯乙酸(trichloroacetic acid,TCA)溶液混匀静置1 h,沉淀未降解成小分子肽和氨基酸的可溶性蛋白[16]。静置后,将上述样品10 000 r/min离心20 min,同时以不加面包芯样品为空白对照。采用微量凯氏定氮法测定上清液、空白对照和样品中的氮含量,按式(1)计算IVPD:

1.3.7 面包游离氨基酸组成分析
称取1.000 g面包样品,置于容量瓶中,采用5% TCA定容至25 mL,振荡混匀[17],12 000 r/min离心1 h,取上清液过0.22 µm膜,收集待测液。色谱条件:醋酸钠∶甲醇∶乙腈=1∶2∶2(V/V);紫外检测器波长338 nm、262 nm(脯氨酸、羟脯氨酸);色谱柱:ODS Hyoersil柱(250 mm×4.6 mm,5 µm);流速1.0 mL/min;柱温40 ℃,每个样品重复3 次。
1.3.8 蛋白组分的营养指标估算
必需氨基酸与总氨基酸之比(E/T)即8 种必需氨基酸之和与全部氨基酸之和的比值。必需氨基酸指数(essential amino acid index,EAAI)使用必需氨基酸含量作为标准评估蛋白质的质量。EAAI根据式(2)计算[18]:
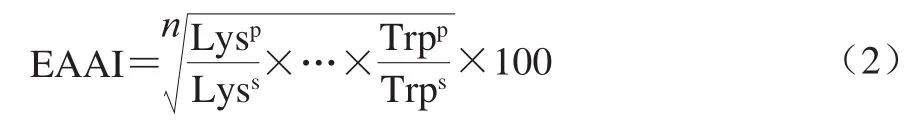
式中:Lysp为待测蛋白赖氨酸含量,Lyss为标准蛋白中赖氨酸含量,其他类同;n为比较的氨基酸数。
生物价(biological value,BV)表示测试蛋白的可利用部分,按Albanes等[19]式(3)计算:

预测蛋白质功效比值(protein efficacy ratio,PER),根据Alsmeyer等[20]式(4)计算:
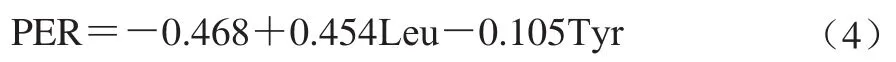
式中:Leu为样品中亮氨酸含量;Tyr为样品中酪氨酸含量。
营养指数(nutritional index,NI)将实验蛋白定性和定量的变化与其营养状况进行比较,参考文献[21]测定。
1.3.9 面包全质构分析
面包冷却2 h后,用面包切片机将面包切成厚度为10 mm薄片,将中间的两片进行叠加,使用质构仪进行测定。参数:探头型号为P/36,测试前速率1.0 mm/s,测试速率3.0 mm/s,测试后速率3.0 mm/s,压缩程度50%,感应力5 g,两次压缩间隔时间1 s。
1.3.10 面包比容测定
将面包于室温下冷却2 h,用油菜籽置换法[22]测定面包体积。面包的比容计算如式(5)所示:
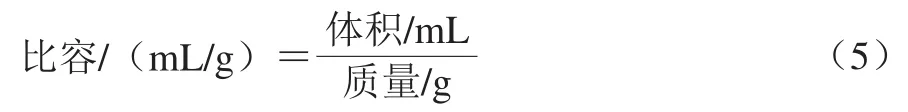
1.3.11 面包芯气孔成像分析
使用扫描仪对面包芯进行扫描,利用ImageJ成像分析法,计算气孔稠密度(cell density,CD)和气孔表面积分率(area fraction,AF),对面包芯囊组织结构进行分析。
1.3.12 面包感官评定
采用9 分嗜好法进行感官评定[23],由20 位经过培训的人员(10 名女性,10 名男性)对面包外观、内部结构、柔软度、口感以及整体可接受度进行评分。
1.4 数据分析
2 结果与分析
2.1 酸面团发酵过程中pH值、TTA和菌落数变化
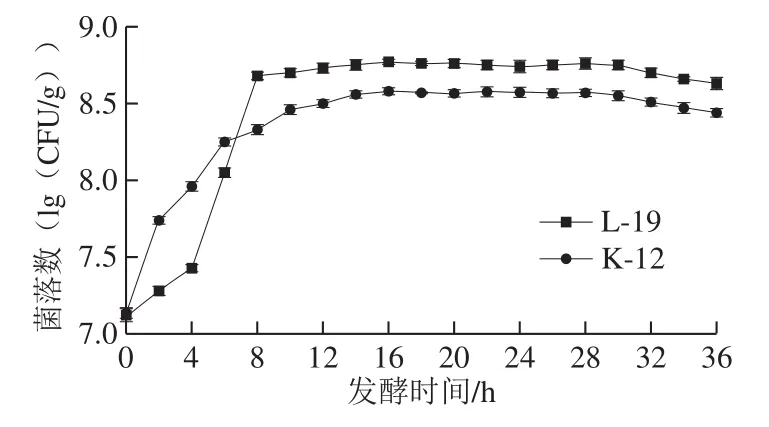
图 1 黑豆酸面团发酵过程中菌株生长曲线Fig. 1 Growth curves of strains during fermentation of black bean sourdough
如图1所示,2 株菌都能在酸面团中良好生长。酸面团中L-19和K-12的初始接种量均为107CFU/g左右,在经过短暂生长延滞期后即进入对数增长期。发酵至12 h,L-19进入稳定期,活菌数保持在5.4×108CFU/g,K-12进入稳定期相对较慢,需发酵至14 h,稳定在3.6×108CFU/g。但在发酵后期(32~36 h),2 株乳酸菌均出现不同程度的衰败。因此,选择30 h作为酸面团发酵时间,再将酸面团加入到面包制作中,使得2 株菌在未进入衰亡期前,在酸面团中有效积累有机酸、酶、风味化合物等代谢物质[24],有利于植酸等抗营养因子的减少,提高面包品质。
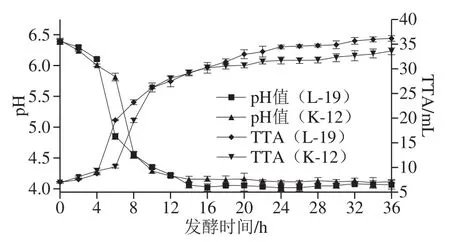
图 2 黑豆酸面团发酵过程中pH值和TTA变化Fig. 2 Changes of pH and TTA in black bean sourdough during fermentation
如图2所示,随着发酵时间的延长,两种酸面团pH值都显著降低,这可能是因为乳酸菌发酵黑豆酸面团过程中,会产生乳酸、乙酸等有机酸,导致酸的积累。最终,L-19黑豆酸面团pH值稳定在4.05左右,K-12黑豆酸面团pH值稳定在4.12左右。两种酸面团TTA的变化趋势与pH值变化都呈负相关,但在发酵30 h后,TTA略有上升,而酸面团pH值却保持稳定。这可能是因为黑豆粉中灰分相对较高,对酸具有一定的缓冲作用[25]。有报道表明,当酸面团持续发酵时,低pH值环境会激活相关酶使淀粉、蛋白质等大分子发生降解[26]。同时,酸性环境下,植酸酶活性较高[27],有利于植酸降解。
2.2 发酵过程中酸面团蛋白酶活性
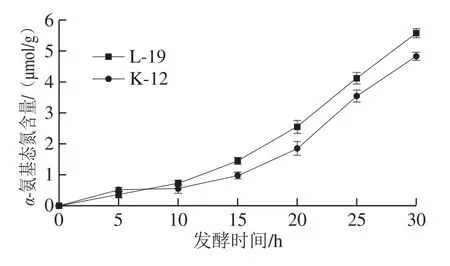
图 3 黑豆酸面团发酵过程中α-氨基态氮含量变化Fig. 3 Changes of α-amino nitrogen content in black bean sourdough during fermentation
α-氨基态氮通常用来表征面团中蛋白酶活性[28]。如图3所示,随着发酵的进行,两种黑豆酸面团中α-氨基态氮含量都不断提高,蛋白水解活性增大。这可能是因为酸面团中蛋白水解酶和乳酸菌的作用导致豆粉蛋白降解,有研究表明,由于乳酸菌在发酵过程中不断释放乳酸等酸类物质,导致酸面团的pH值降低,从而激活内源性蛋白酶活性,同时乳酸菌也依赖于自身蛋白水解系统降解蛋白质满足其对氨基酸的需求。因此这也解释了在发酵前期,两种黑豆酸面团中α-氨基态氮含量增长速度缓慢的原因:α-氨基态氮在乳酸菌生长过程中作为氮源会被部分消耗[29],而在进入稳定期后,氮源消耗减少,α-氨基态氮含量不断积累。发酵至30 h,L-19和K-12黑豆酸面团α-氨基态氮含量分别达到5.59、5.12 μmol/g,表明L-19黑豆酸面团中蛋白水解活性更大。
2.3 面包植酸、蛋白含量和IVPD
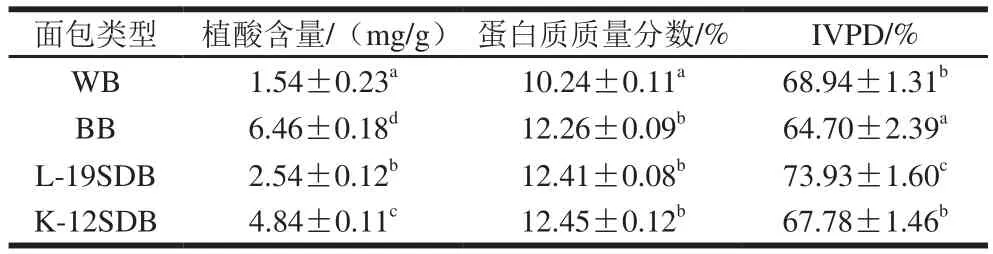
表 2 不同类型面包的植酸含量和IVPDTable 2 Phytic acid contents and IVPD in different types of breads
如表2所示,小麦面包WB中植酸含量为1.54 mg/g,添加黑豆粉后,植酸含量上升至6.46 mg/g。而添加黑豆酸面团的L-19SDB和K-12SDB植酸含量分别降低至2.54 mg/g和4.84 mg/g。其中相比于黑豆面包BB,L-19SDB植酸降解率最大,为60.68%。不产植酸酶乳酸菌K-12发酵黑豆酸面团后,其制成的面包植酸含量也降低,可能是由于低pH值环境下,内源性植酸酶被激活。但内源性植酸酶活性相对不高,对植酸含量降解有限,产植酸酶乳酸菌L-19的加入,显著降低了植酸含量(P<0.05)。添加黑豆粉后,BB中蛋白质含量得到提高,但SDB组与BB组相比并未发生显著变化(P>0.05)。该结果与前人研究相似[30],可能是由于乳酸菌以及植物内源蛋白酶诱导的蛋白质水解,大分子蛋白质被分解成较小分子的蛋白质、肽和氨基酸,因此可以认为发酵仅改变蛋白质的分子大小而不影响其含量[31]。
IVPD是食品蛋白质最重要、最直观的营养评价指标之一。添加黑豆粉后,IVPD值降低至64.70%,这可能是因为黑豆粉含较高的可以与蛋白质相结合的抗营养物质(单宁、植酸)影响消化。而添加酸面团后,黑豆面包IVPD值分别升高至73.93%和67.78%。可以看出酸面团发酵显著提高黑豆面包的IVPD(P<0.05)。在乳酸菌发酵过程中,大分子蛋白被降解,使其更易被消化吸收,因而营养价值得到提高。而相比于K-12SDB,L-19SDB的IVPD值更高,可能源于植酸酶分解了体系中的植酸蛋白质复合物,释放出蛋白质,提高其生物利用度[32]。
2.4 面包游离氨基酸组成分析

图 4 面包游离氨基酸含量Fig. 4 Free amino acid contents of breads
图4显示不同面包(WB、BB、L-19SDB、K-12SDB)的游离氨基酸含量。相对于小麦粉,黑豆粉中蛋白质含量较高,富含多种氨基酸,因此在氨基酸组成分析中,黑豆面包BB总游离氨基酸含量(2 253.23 mg/kg)是小麦面包WB(1 478.73 mg/kg)的1.52 倍。经乳酸菌发酵后,得益于蛋白水解的加强,两种酸面团(L-19、K-12)面包中总游离氨基酸含量分别达到了3 897.91 mg/kg和3 339.35 mg/kg,远高于WB和BB。同时,L-19SDB总游离氨基酸含量比K-12SDB增加16.73%,这与图3结果相符。这可能是因为L-19释放的植酸酶降解了植酸。植酸的存在会与蛋白底物复合形成难降解不溶性物质,同时,植酸还可能会与酶本身相结合而降低酶活,Khan等[33]研究表明植酸的存在对消化蛋白酶起到抑制作用,并且随着含量的增加,抑制作用更强。
同时,产植酸酶乳酸菌的发酵对蛋白质质量的提高也体现在氨基酸谱上(图4)。与WB和BB相比,L-19SDB和K-12SDB中,所有必需氨基酸含量均增加。以典型的赖氨酸为例,由于小麦粉中赖氨酸含量较低,黑豆粉中球蛋白含量较高,且其中赖氨酸组成较为丰富,因此黑豆粉的添加,可以与缺乏赖氨酸的谷类形成蛋白质的互补作用。经过发酵后,这种作用更加明显,K-12SDB赖氨酸含量可以达到230.97 mg/kg,为WB的2.23 倍。同时,得益于植酸的降解、蛋白水解活性的提高,高产植酸酶乳酸菌L-19SDB在氨基酸组成分析上表现的更好,其赖氨酸含量为K-12SDB的1.31 倍。
2.5 面包蛋白质营养特性分析

表 3 面包蛋白质营养特性分析Table 3 Analysis of protein nutritional characteristics in breads
面包中蛋白质营养特性分析主要集中于蛋白质的氨基酸组成分析,特别是人体必需氨基酸,是衡量食品中蛋白质营养价值的一个重要指标。如表3所示,WB中E/T为21.41%,添加黑豆粉后,BB中E/T上升为24.32%,经过乳酸菌发酵后,L-19SDB和K-12SDB的E/T值更是达到了37.44%和35.28%。总体而言,面包EAAI介于60.4~71.29之间,且L-19SDB的EAAI最高。同样,L-19SDB的BV也为最高(66.01)。EAAI表示样品中必需氨基酸与参考样品之比,BV反映食用后人体可能保留的氮。而反映蛋白质支持体质量增加能力的PER对于WB和BB并没有显著差异(P>0.05),但添加黑豆粉后PER值略有提高,经过发酵后,酸面团组PER值都显著提升(P<0.05)。同时,NI结合了定性和定量因素,被认为是蛋白质品质的全球预测指标[34]。如表3所示,虽然高产植酸酶L-19SDB的NI与K-12SDB并无显著差异,但是也略有提高,并且相对于WB和BB,都显著提升(P<0.05)。
2.6 感官评定
由图5可知,L-19SDB的整体接受度最高,且单纯添加黑豆粉的面包(BB)整体接受度最低。豆类蛋白的添加会对小麦面筋产生稀释作用,导致面团面筋强度的减弱从而影响面包整体质构特性,这与柔软度和内部结构评分结果较低一致。而在风味评分方面,酸面团面包评分最高,特别是L-19SDB组。黑豆粉经过高产植酸酶乳酸菌L-19发酵后,由于蛋白质更高程度降解,以及游离氨基酸大量的生成,一定程度上抑制了“豆腥味”,以及利用风味前体(氨基酸)生成相应的风味物质,从而掩盖了部分“豆腥味”[35]。在整体可接受度上,L-19SDB评分为7.72,表现最好。
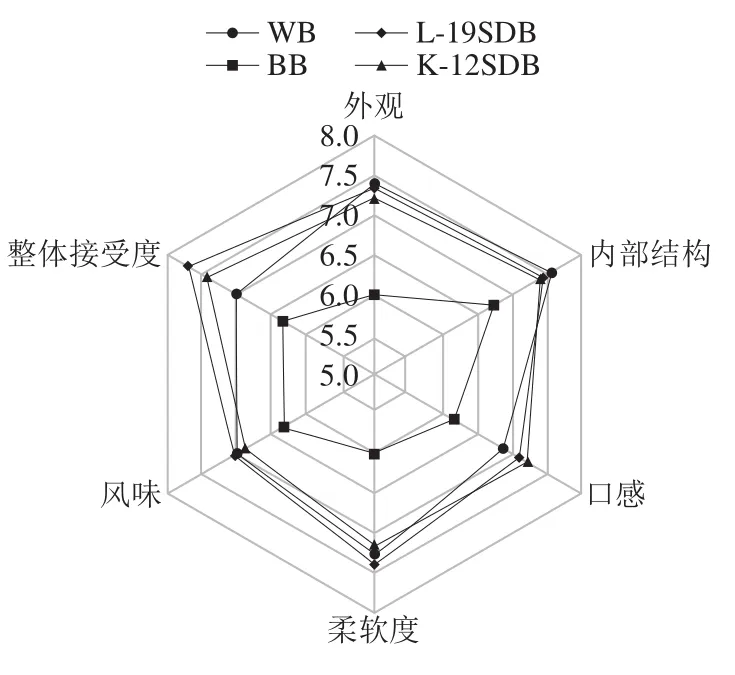
图 5 面包感官评定Fig. 5 Sensory evaluation of breads
2.7 面包烘焙特性分析

表 4 不同类型面包品质特性评估Table 4 Assessment of quality characteristics of different types of breads
本研究从面包比容、硬度、弹性、咀嚼性和面包芯囊结构分析评估黑豆酸面团面包的烘焙特性。如表4所示,相比于其他3 组,黑豆面包BB比容最小,硬度最大,咀嚼性最差。黑豆粉是无面筋体系,替代小麦粉后,豆类蛋白质对小麦面筋产生一定的稀释作用,使面筋网络结构遭到破坏,面包整体品质变差。经酸面团发酵后,面包品质得到改善,L-19SDB和K-12SDB的比容相比黑豆面包BB分别提高31.45%和23.59%,硬度降低68.79%和56.59%,咀嚼性值降低64.05%和57.16%,弹性也有所提高,这与上述感官评定结果一致,酸面团组整体接受度都要高于黑豆面包组。研究表明,酸面团的酸化程度[35]、乳酸菌某些代谢产物致使酵母发酵能力提高[36],以及如胞外多糖[37]等产物可能是酸面团技术改善面包烘焙品质的重要原因。但与K-12SDB相比,含有高产植酸酶的L-19SDB改善效果更加明显。这可能是因为植酸酶降解植酸盐,增加内源α-淀粉酶活性所必需的游离钙离子浓度,减少植酸盐和α-淀粉酶之间的相互作用,从而增大内源α-淀粉酶活性。淀粉酶活性的增加,导致面团中小糊精的释放,因此在面团发酵、醒发和烘焙早期给酵母提供必需的糖,最终改善面包品质[38]。
CD表示为单位面积下所含气孔个数,它与面筋网络结构、体系中蛋白质与淀粉交互作用等有关[39],CD值相对越大,面包芯囊结构越细腻。如表4所示,SDB组CD值均大于黑豆面包BB。AF表示为气孔总面积与图像总面积的百分比,间接反映面包内部芯囊结构的稳定性和持气能力。添加黑豆粉后,面包AF值显著减小(P<0.05),与上述比容全质构结果相似。而酸面团组,特别是L-19SDB的CD值和AF值较其他组有明显优势,其芯囊组织更加均匀,更加细腻(图6)。
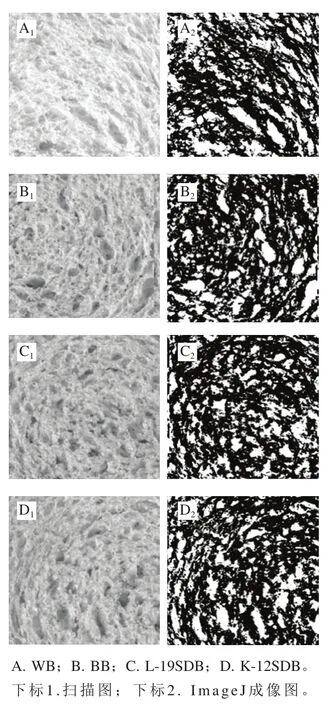
图 6 不同类型面包芯囊结构Fig. 6 Core structure of different types of breads
3 结 论
酸面团面包蛋白质营养品质和烘焙品质都得到明显的改善,其中L-19SDB效果最显著。与BB相比,L-19SDB植酸含量下降60.68%,IVPD值由64.70%升高至73.93%。并且L-19酸面团蛋白酶活性更高,L-19SDB总氨基酸含量为WB的2.64 倍,BB的1.73 倍。同时与其他3 组相比,L-19SDB有更好的氨基酸特征,更高的蛋白质BV。面包烘焙品质方面,L-19SDB和K-12SDB相比黑豆面包BB比容分别提高了31.45%和23.59%,硬度降低68.79%和56.59%。通过ImageJ分析发现,L-19SDB芯囊组织更加均匀,更加细腻,且有更高的整体可接受度(7.72 分)。结果表明,高产植酸酶乳酸菌发酵黑豆在降低小麦-黑豆面包植酸含量和改善蛋白质营养品质和烘焙特性方面具有良好的应用潜力。
