非共价作用力对鱼明胶-果胶复合凝胶体系的影响
2021-03-31王梦楠涂宗财胡月明
王梦楠,涂宗财,2,3,胡月明,王 辉,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西师范大学 国家大宗淡水鱼加工技术研发分中心,江西 南昌 330022;3.江西师范大学 江西省淡水鱼高值化利用工程技术研究中心,江西 南昌 330022)
明胶是由哺乳动物的结缔组织或表皮组织中胶原部分通过降解变性而得到的一种天然高分子多肽聚合物。明胶具有良好的生物相容性和生物可降解性,具有很多功能特性。据报道,约95%的商业用明胶来源于哺乳动物猪、牛等的骨与皮筋腱膜,约5%来源于猪和牛的骨[1]。在食品工业中,明胶的凝胶性、起泡性、乳化性、成膜性等功能性质,被广泛用于食品、医药品、化妆品和摄影行业等领域[2]。但是,由于疯牛病和“口蹄疫”等人畜共患病的肆意传播,加之工业明胶代替食品级明胶的食品安全问题,哺乳动物明胶的安全性越来越受广大消费者的质疑[1-3]。食品安全原因使哺乳动物明胶在食品领域中的应用受到很大限制,从而使哺乳动物明胶市场份额占有率不足1.5%[3]。为此,人们开始着眼于其他来源的胶原与明胶产品来替代由哺乳动物制成的明胶。
研究者们主要寻找鱼明胶、禽类明胶、植物来源的多糖体系以及蛋白质-多糖复合体系代替哺乳动物明胶[4-5]。鱼明胶作为渔业副产物加工利用的产物,虽然其凝胶特性比哺乳动物明胶的凝胶特性稍差,但是大量研究证明,只要对鱼明胶进行稍加改性或修饰,即可达到更佳的效果。目前物理法、化学法、酶法及复合修饰法等方法研究的较多[5-15]。其中,对于蛋白质-多糖复合体系的研究已经有很多成果,这些研究多集中在改善复合胶体的理化特性和凝胶特性[16]。其中,蛋白质-多糖修饰法在明胶改性实验中颇受欢迎,一方面,大多数多糖属于植物胶,如果胶、槐豆胶、海藻胶和纤维素胶等,具有优良的胶凝性和稳定性;另一方面这些多糖在抗肿瘤、降血糖、抗衰老、免疫促进等方面都发挥着生物活性作用。
果胶是富含D-半乳糖醛酸的植物细胞壁多糖,具有保持植物水分和固定纤维网络结构等作用,水果和蔬菜也因此具有较硬的质地。果胶是一种天然的食品添加剂,主要从食品加工业废物(柠檬或苹果皮)获得,具有很多功能特性[17]。果胶物质的分子不是以直线形式存在的,而是曲折折叠样式,因此分子内极易形成氢键;但其酯化程度较高时,分子内氢键相对含量较小,导致溶解度在一定程度上增加。在食品工业中,果胶常用做食用薄膜、运输材料等[18-19]。鱼明胶-果胶复合胶体主要是通过非共价相互作用(静电相互作用、疏水相互作用和氢键)结合,达到稳定结构[20]。这种结合的本质就是分子水平上自发的、有序的物理自组装过程。鱼明胶-果胶复合胶体正是属于蛋白质-多糖复合体系,对其改性应用的研究也较为常见[18,21-24]。但是很少有人对其中的机理进行探索。
在许多食品中,一些高聚物分子(如多糖或蛋白质)能形成海绵状的三维网状凝胶结构。连续的三维网状凝胶结构是由高聚物分子通过氢键、疏水相互作用、范德华引力、离子桥联、缠结或共价键形成的连接区,网孔中充满了由分子质量小的溶质和部分高聚物组成的水溶液。在蛋白质多糖体系中,形成复合物的作用力受到体系的pH值和离子强度的影响,其中,pH值通过影响鱼明胶氨基酸侧链电荷分布,改变蛋白质分子间的相互作用,进而影响鱼明胶-果胶复合凝胶的非共价键作用力和结构[25]。
基于上述研究现状分析,本实验拟以鱼明胶、果胶为原料,通过改变体系pH值,研究非共价相互作用类型(氢键、疏水相互作用和静电排斥作用等)对鱼明胶-果胶复合凝胶体系的影响,以期为多糖修饰鱼明胶的研究提供理论基础。
1 材料与方法
1.1 材料与试剂
罗非鱼鱼皮明胶(260~270 Bloom) 苏州吉利鼎海洋生物科技有限公司;高酯化果胶 中国Sigma Chemical公司;盐酸、氢氧化钠等均为分析纯。
1.2 仪器与设备
ML104/02电子天平 中国Mettler-Toledo公司;HH-4数显恒温水浴锅 常州润华电器有限公司;PHS 25雷磁pH计 上海仪电科学仪器股份有限公司;紫外-可见分光光度计 日本日立公司;台式离心机 上海安亭科学仪器厂;Nano ZS90粒度仪 英国马尔文仪器有限公司;LabRAM HR激光拉曼光谱仪 法国HORIBA Jobin Yvon公司;Synergy H1酶标仪 美国Bio Tek公司;MCR302流变仪 德国Anton Paar公司。
1.3 方法
1.3.1 样品的制备
称取8 mg/mL的果胶和6.67%的鱼明胶混匀后加入蒸馏水,45 ℃水浴溶解至完全,并用1.0 mol/L的NaOH和HCl溶液调pH值至4、5、6、7、8、9,即为鱼明胶-果胶复合溶液,分别命名为FG-P 4、FG-P 5、FG-P 6、FG-P 7、FG-P 8、FG-P 9。
1.3.2 浊度和粒径
对复合胶体进行浊度测试[26]。将凝胶溶液用去离子水稀释100 倍,使用紫外-可见分光光度计在600 nm波长处对样品稀释液进行浊度测量,用去离子水校准至100%的透射率,测试温度为25 ℃。
对复合凝胶进行粒度分析测试[27]。采用纳米粒度仪对复合凝胶稀释液粒度分布情况进行测定,测定强度设定在90°,每个样品测定3 次,取平均值。
1.3.3 非共价相互作用
疏水相互作用、氢键[28]:将所有样品放置在载玻片上4 ℃冰箱孵化16~18 h,然后用激光拉曼光谱仪进行测量激发波长514 nm;激光出射功率:10 mW;显微物镜:50 倍长焦距;光栅:1 800;狭缝:200 μm;积分时间:20 s;重复3 次,累加得谱。
静电相互作用[29]:对凝胶溶液进行稀释100 倍处理,每次测定最终电位值为连续3 次测试的平均值。
1.3.4 鱼明胶-果胶复合胶体流变学特性[20]
温度扫描:应变0.5%,频率1 Hz,按照0.5 ℃/min,从40 ℃降至5 ℃,5 ℃保持30 min,再从5 ℃升至40 ℃。剪切速率:测试温度为25 ℃,剪切速率为0.01~100 s-1。
1.3.5 鱼明胶-果胶复合胶体的凝胶强度[20]
取配制好的鱼明胶溶液10 mL倒入25 mL的小烧杯中(胶体为33 mm×22 mm,直径×长度),并置于10 ℃恒温培养箱中放置16~18 h。使用质地分析仪测定胶体的凝胶强度。测定参数如下:探头为直径1.27 cm的P 0.5R,测试前、测试中、测试后速率均为1.0 mm/s。凝胶强度即为探头下压深度为4 mm所承受的最大压力。
1.3.6 鱼明胶-果胶复合胶体的质构学特性
将制备好的明胶溶液倒入直径为2.2 cm的模具中,4 ℃孵化16~18 h。取出胶体并切成高度为1.5 cm的圆柱胶体,利用质地分析仪进行TPA检测,探头为P 36R,形变量为40%,循环测量2 次,测试前、测试中、测试后探头移动速率均为1.0 mm/s。
1.4 数据分析
所有实验均重复3 次。采用Origin 2018软件进行作图,SSPS 24软件对数据进行单因素分析。P<0.05,差异显著。
2 结果与分析
2.1 浊度和粒径
浊度代表着不溶性复合物的形成[26,30]。通常蛋白质-多糖不溶性复合物是通过以下3 个步骤形成:1)形成可溶性“主要”蛋白质-多糖复合物,主要是通过带正电的蛋白质和阴离子多糖之间的静电吸引作用;2)引发主要复合物的聚集以形成准中和的主要复合物和聚集体;3)通过进一步聚集形成电荷中和的不溶性复合物,导致宏观相分离成富含复合物和富含溶剂的相[16,31-33]。由图1A可知,在pH 5时,体系的浊度特别高,此时体系中鱼明胶和果胶之间存在强烈的静电吸引,鱼明胶-果胶体系自组装形成较大的不溶性聚合物分子,而大量不溶性复合物(凝聚物)的积累导致体系达到最高的浊度。这与Yang等[33]研究结果类似,鱼明胶与阿拉伯胶混合物电荷被中和时,不溶性复合物形成最为密集。而且,成熟的胶体(图2)在pH 5条件下,果胶处于最稳定状态,果胶处于最稳定状态的静电引力促使大而致密络合物的形成,鱼明胶-果胶颜色呈乳白不透明状[34]。主导的非共价相互作用变化后的复合胶体溶液都变得透明,因此在pH值略微变大或变小的过程中,浊度均呈现降低的趋势[35]。随着pH值再次增大,复合体系的浊度显著降低。在pH值达到7以后,复合胶体的浊度不再有显著性差异。这可能是因为大分子的果胶在强酸强碱性环境下,分解成较小的分子或者是半乳糖醛酸等小分子物质,同时静电斥力阻止了络合物的形成[36]。

图 1 不同pH值条件下复合胶体的浊度(A)和粒径(B)Fig. 1 Turbidity (A) and particle size (B) of composite gel systems under different pH conditions

图 2 成熟的复合胶体Fig. 2 Mature complex gel systems
由图1B可知,鱼明胶-果胶复合体系在pH值为5时,蛋白质在靠近等电点附近时,表面净电荷最少,静电斥力最小,粒径最大。这是因为蛋白发生解聚,充分伸展,结构变得无序,疏水基团等活性残基的暴露,非共价作用力形成,蛋白质之间的作用较强,蛋白聚集速度最快,形成较大的聚集体[25,28]。聚合体的形成主要受到分子间氢键作用、蛋白或多糖结构及体系电荷分布的影响[37]。因此,采用0.45 μm的滤膜对溶液进行过滤处理,消除了外来聚集体的影响,在25 ℃测试。由图1B可以发现,弱酸或弱碱性条件下,果胶分解程度较小,果胶分子和鱼明胶分子自组装形成的聚合物粒径较大[38]。在等电点附近时(pH 5),蛋白质分子以双极离子存在,总净电荷接近零,静电引力较大,易凝集成大颗粒,因而最不稳定,溶解度最小,易沉淀析出。而在碱性条件下果胶降解成小分子物质,通过氢键作用,填充在鱼明胶的三维凝胶网络结构中,致使体系的平均粒径显著降低,稳定性也显著增加[39]。
2.2 非共价相互作用的测定
2.2.1 疏水相互作用
色氨酸、酪氨酸等疏水性氨基酸残基的拉曼光谱图能够反映蛋白质微环境的变化[38,40]。在拉曼光谱图中,因苯丙氨酸环在1 003 cm-1处的强度不随蛋白质的结构改变而发生变化,因此将该频谱的呼吸振动作为内标,用于标准化频谱。将760 cm-1附近的拉曼谱带的归一化强度归因于色氨酸残基环的拉伸振动,可用于研究Trp残基的疏水性,然后反映蛋白质凝胶的疏水相互作用[41-42]。如图3所示,在酸性条件下,鱼明胶-果胶复合体系的疏水相互作用先增大后减小,在pH 5时,疏水相互作用最大,蛋白分子间静电作用的减弱有利于疏水相互作用的增强,pH 5时体系静电排斥作用最小,疏水作用最强,鱼明胶之间的作用加强,鱼明胶与果胶以及鱼明胶与水之间的作用减弱,同样印证了这一结论;在碱性环境下,随pH值的增大,I760/I1003值逐渐增大,疏水相互作用逐渐增强,且随着pH值的不断增大,鱼明胶与鱼明胶、鱼明胶与果胶、果胶和果胶之间的疏水作用不断增大,这与粒径、浊度的变化刚好相反,说明在碱性环境下,体系随pH值的增大,越来越稳定。

图 3 不同作用力下,复合体系的I760/I1 003和I850/I830双峰带的归一化比率Fig. 3 Normalized I760/I1 003 and I850/I830 ratios of composite gel systems under different pH conditions
2.2.2 氢键
I850/I830值可以用来判断酪氨酸残基的暴露和包埋状态,I850/I830值越小,体系的氢键越大[28,40]。其中,当I850/I830值<0.9,表明酪氨酸酚羟基被包埋在疏水环境中,或者它们作为强氢键供体存在;比值在0.9~2.5之间时,表明酪氨酸残基处于暴露状态,在极性环境或水环境中可以参与中等或较弱的氢键形成[25]。由图3可知,在所有pH值下的I850/I830值均在0.9~2.5之间,说明复合体系均表现为酪氨酸残基暴露在非极性环境中,与水结合形成了中等或弱氢键。本实验中,氢键含量随pH值先减小后增大,在pH 5时达到最小,在碱性条件下不断增大。静电斥力不断增大,蛋白质结构完全伸展,蛋白质表面与水的结合位点增多,水化面积增大,因此鱼明胶蛋白质分子与水的氢键作用增强。相比之下,FG-P 7比FG-P 9有更弱的疏水相互作用,因此,在pH 7时,体系中的氢键含量较多,氢键为主导作用力;FG-P 9时静电排斥相互作用较强。
2.2.3 静电相互作用
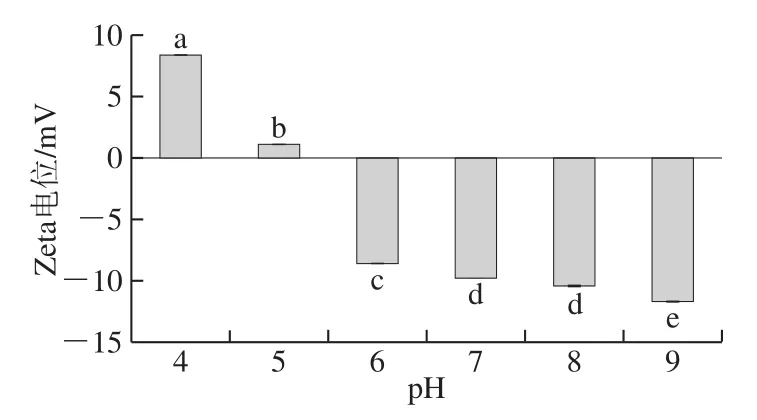
图 4 不同pH值条件下复合体系的静电相互作用Fig. 4 Electrostatic interaction of complex gel systems under different pH conditions
通过电位分析可以了解不同pH值条件鱼明胶-果胶复合体系的稳定性以及影响体系稳定性的静电相互作用强弱。混合体系的电位一般受到体系的pH值、鱼明胶和果胶比例及总固形物含量等因素的影响[43-44]。因为鱼明胶和果胶带异性电荷,因此在混合过程中,鱼明胶和果胶最先发生静电吸引作用,即在pH 5时是其复合物充分混合后的原始状态。如图4所示,在酸性条件下,随着样品pH值的增大,鱼明胶-果胶复合凝胶溶液的Zeta电位绝对值显著降低(P<0.05),当pH 4时,体系电负性为正值,说明FG-P复合体系是以FG-FG作用为主导的凝胶体系。在pH 5时,Zeta电位为1.14 mV,绝对值最小。此时,静电吸引力作用最强,粒径最大,体系浊度最高,说明鱼明胶和果胶通过静电结合并发生凝聚[35]。蛋白分子间静电斥力的减弱有利于疏水相互作用的增强,这与pH 5时鱼明胶-果胶复合体系的疏水作用最强结果一致[35]。Zeta电位的绝对值大小可以反映溶液体系的稳定性,绝对值越大,则体系越稳定。带正电荷的鱼明胶和带负电荷的果胶通过静电吸引,倾向于凝聚或凝结,形成不稳定的复合物[35]。在碱性条件下,鱼明胶-果胶复合凝胶体系随着pH的增加,静电斥力增强,疏水作用主导的体系表现得更加稳定。
2.3 不同作用力对复合胶体融胶温度的影响
胶融温度是评价明胶凝胶性质的重要因素之一。它在食品加工及应用中也起到很重要的作用,如软糖、药物胶囊等,高温条件下很有可能会缓慢融化,使得产品口感黏滑[20]。因此,较高的胶融温度将会使产品易于贮藏、药物得到更好的缓释效果。
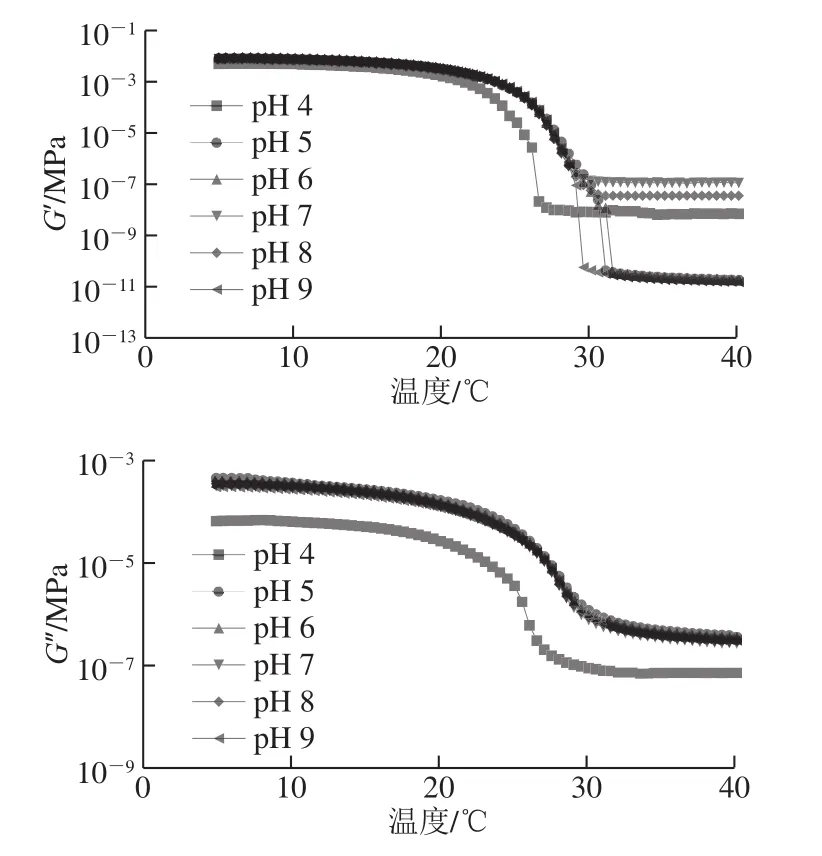
图5 不同非共价作用力条件下鱼明胶-果胶复合胶体的融胶过程模量变化Fig. 5 Changes in storage and loss moduli during melting of composite gel systems under different pH conditions
由图5可知,复合胶体在融胶过程中,Gʹ和G″均随着温度的升高而降低,明胶体系表现出单一的相转变(固体到液体)。本实验中,罗非鱼鱼皮明胶-果胶复合胶体的胶融温度在(26.37~28.06)℃、pH 5条件下,达到最高为(28.06±0.16)℃。且由表1可知,鱼明胶-果胶复合体系中,FG-P 5的胶融温度(28.06±0.16)℃略高于FG-P 9的胶融温度(27.84±0.1)℃,分析可能因为在pH 5时,静电(排斥)相互作用减弱,分子间氢键含量较多,在pH 9时,静电排斥作用最强,氢键相互作用较强,因此样品FG-P 5和FG-P 9的胶融温度较大。但整体上看,pH 5~9时的胶融温度差异并不是很大,而pH 4时,体系的胶融温度最低,推测可能是因为酸性条件下,FG-P交联占据主导地位,蛋白质的分子间氢键含量较少,疏水相互作用和静电引力是该环境下的主要作用力。
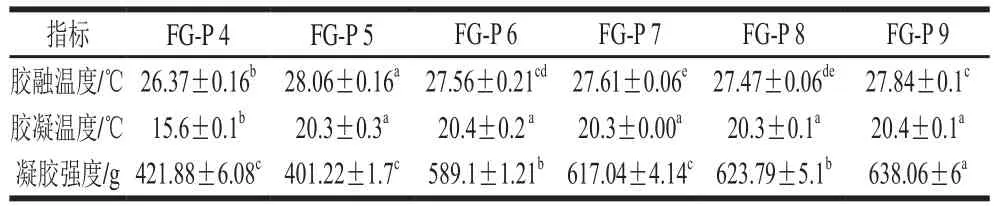
表 1 复合胶体的胶融温度、凝胶温度和凝胶强度Table 1 Melting temperature, gelling temperature and gel strength of composite gel systems
2.4 不同作用力对复合胶体凝胶强度的影响
凝胶强度是反映胶体品质的主要参数之一[45]。如表1所示,随着pH值的增加,鱼明胶-果胶复合体系的凝胶强度先降低后增加,最后基本平稳。当pH 5时,体系的凝胶强度最小(401.22±1.7)g,在pH 9时,达到最大(638.06±6)g。凝聚主要发生在静电吸引较高且Zeta电位几乎为零时[35]。当pH值为5时,体系的疏水相互作用最强,静电排斥作用最弱,鱼明胶分子与果胶分子通过静电吸引,凝聚形成超大分子聚集体,但这种结构并不稳定,很容易遭到破坏[35]。体系pH值为4时与FG-P 5凝胶强度的差异不大。随着pH值的增加,疏水相互作用逐渐减弱,而静电排斥作用及氢键逐渐增强,鱼明胶分子形成稳定的凝胶网络结构,与此同时,果胶分子受到强碱性环境的影响会降解成小分子的糖链,通过静电排斥和氢键作用贯穿并交联于鱼明胶网络结构中,增强了体系的凝胶网络结构,使得鱼明胶-果胶复合胶体的凝胶强度逐渐增强[39]。
2.5 不同作用力对复合胶体溶液表观黏度的影响
黏度反映了明胶产品的加工特性,也是评价明胶品质的关键因素[46]。一般采用溶液的表观黏度表征其流动性。明胶的水溶液具有黏性,并决定了其产品的加工特性。表观黏度的增大与pH值有极大的关系。实验证明,在等电点处,明胶溶液的黏度达到最低。果胶可以显著提高鱼明胶的黏度,一方面是果胶增大了溶液的总物质的量,另一方面是果胶通过氢键和静电相互作用与鱼明胶形成了大量聚集体。鱼明胶溶液为非牛顿流体,通常表现为剪切稀释现象[9]。实验表明,随着果胶含量的增大,其溶液剪切变稀现象越明显,说明此时的复合胶体溶液表现为非牛顿流体特征[20]。本实验还发现,一些鱼明胶-果胶复合胶体,在低剪切速率下,具有较高的表观黏度。分析认为,在剪切速率较低时,剪切压力也较低,未能破坏溶液的稳定状态,因而呈现出较高的表观黏度值;然而随着剪切速率的逐渐增大,剪切速率也随之变大,氢键和其他弱键的断裂,蛋白质网络结构解体,导致复合胶体溶液的表观黏度逐渐降低,最终趋于一种平衡状态。

图 6 剪切速率扫描对不同作用力下的鱼明胶-果胶体系的表观黏度Fig. 6 Apparent viscosity versus shear rate curves of composite gel systems under different pH conditions
研究认为,剪切速率为50 s-1时所对应的黏度值(η=50)与食品的黏度、润滑性等品质相关[47]。由图6可知,鱼明胶-果胶复合胶体均表现出较高的黏度值(η=50),尤其样品FG-P 7和FG-P 9最为显著。体系pH值为7时,疏水相互作用比较弱,氢键和静电排斥较强,胶体的三股螺旋网络结构增强,促进凝胶体系的增强,从而表现出较高的黏度。FG-P 9较FG-P 7略低,但高于其余样品的黏度。体现了以氢键和静电排斥主导的复合胶体的三股螺旋含量较高,促进凝胶网络结构的增强,凝胶体系更加稳定。
2.6 不同作用力对复合胶体质构学特性的影响
胶体的质构学特性测试可以模拟其在口腔中咀嚼时的品质变化,表达胶体食物在人口腔中被咀嚼时的物理特性。鱼明胶-果胶复合凝胶体系的硬度在pH 5时,达到最小;在pH 6~9范围内不断增大;FG-P 4与FG-P 6的硬度值接近。复合胶体FG-P 5是由静电相互吸引作用以及疏水相互作用维持的FG-P主导的凝胶网络结构,形成的分子凝胶网络结构较弱,弹性较低,表明复合胶体FG-P 5被破坏时,需要的能量较低。其他复合胶体的网络结构较强,想要破坏其凝胶结构则需要较多的能量。表2列出了复合胶体的所有质构数据,FG-P 5内聚性是最差的,此时的鱼明胶和果胶复合胶体主要是通过静电相互吸引而形成的超大分子聚集体,其稳定性很差[35],因此,在探头挤压穿刺之后,其完整性很难得到维持。而其他胶体均表现出较强的内聚性,说明其凝胶网络结构比较稳定,不易被破坏。这与前文数据保持一致。
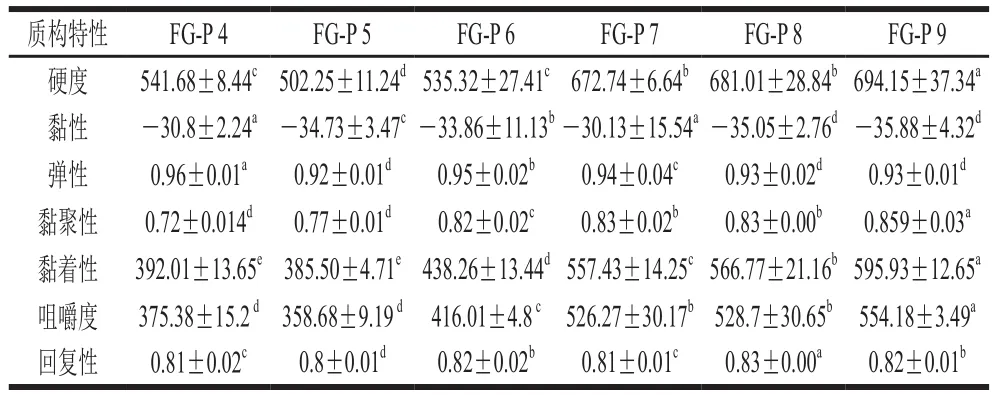
表 2 不同pH值条件下,果胶修饰鱼明胶对复合胶体质构特性的影响Table 2 Texture properties of composite gel systems under different pH conditions g
3 结 论
当鱼明胶-果胶复合凝胶体系在pH值为5时形成导致超大分子的复合聚集体,疏水相互作用最强,而复合体之间也具有强烈的静电引力。体系pH值为7时,疏水相互作用整体减弱,而氢键较强。体系pH值为9时,Zeta电位绝对值在所有的样品中达到最大,因此FG-P 9的静电斥力最强。所有样品体系均不是单一作用力形成的,且这些非共价作用力均是弱相互作用,这些弱的相互作用力虽然不是形成复合胶体的主要作用力,但却对蛋白质折叠起着至关重要的作用。因此,每一种稳定体系都是由不同比例的不同作用力共同平衡存在的。以疏水相互作用主导的复合胶体稳定性较差,但鱼明胶-果胶复合胶体的胶融温度和凝胶温度均较高;而以静电排斥主导的复合胶体具有较高的凝胶强度和稳定性;以氢键主导的复合胶体具有更强的凝胶网络结构,体系更加稳定。因此,不同的非共价相互作用对鱼明胶-果胶复合胶体的性质作用不同,这对建立蛋白质-多糖复合凝胶体系目标性质具有基础作用。
