鸡弱精症相关精浆蛋白组分析
2021-03-30李云雷孙研研武艳平唐维国陈继兰谢金防
魏 岳,李云雷,孙研研,武艳平,唐维国,陈继兰*,谢金防*
(1. 江西农业科学院畜牧兽医研究所,南昌 330200; 2. 中国农业科学院北京畜牧兽医研究所, 农业农村部动物遗传育种与繁殖(家禽)重点实验室,北京 100193)
精子活力是衡量精液质量的重要标准之一,精子活力低下引起的弱精症主要表现为精子前向运动数量(A类和B类)的比例小于50%或快速直线前向运动数量的比例小于25%,其严重影响人和动物的生殖能力[1-3],据不完全统计,每年有5%~12%的种公鸡因产精能力低下而被淘汰[4]。中国地方鸡中,由于各种因素普遍存在着精子活力偏低的问题,精子活力低下成为制约地方鸡种产业化发展的限制因素之一。鸡精子主要贮藏于输精管中,精浆来自睾丸、附睾和输精管,与哺乳动物相比,由于缺少副性腺,鸡精液具有体积小、浓稠且精子密度大的特点。精浆是精子重要的环境载体,为精子提供营养和能量,其中的重要成分精浆蛋白影响精子在雌性生殖道中的贮存,参与精子获能、顶体反应和免疫应答等诸多生殖过程[5-7]。目前,人和动物中对弱精症的研究主要集中于精子、染色体异常或相关生殖器官病变的研究[8-10],而对精浆的研究较少。富丽等[4]采用 RT-qPCR技术在公鸡睾丸组织中进行检测发现,COX7B、hPTGDS和WNT2等候选基因在弱精组个体睾丸中的表达量与正常个体相比有显著差异。许红等[11]研究发现,SOX5基因在弱精症公鸡睾丸中的表达显著低于正常公鸡,而且SOX5基因和蛋白的表达趋势与公鸡性成熟和繁殖机能衰退的趋势一致,推测SOX5基因对公鸡睾丸发育水平和精子活力具有重要调控作用。刘一帆[12]利用转录组学技术构建鸡精子活力相关mRNA-miRNA-lncRNA 互作网络和蛋白质互作网络,预测到一个包括35个lncRNAs、119个mRNAs和18个miRNAs的调控因子集合。
本试验以宁都黄鸡作为研究对象,采用液相色谱-质谱联用(LC-MS/MS)技术开展鸡精浆蛋白组学的研究,筛选与弱精症相关的差异蛋白,分析差异蛋白可能参与的调控通路以及在精子运动中的作用,为进一步阐明弱精症的病理学基础,寻找弱精症诊断的新靶点并以提高繁殖性能为目标的分子育种奠定理论基础。
1 材料与方法
1.1 试验材料和试剂
1.1.1 试验材料 试验动物为来自江西惠大实业有限公司宁都黄鸡原种场同批次孵化的宁都黄鸡公鸡。筛选方法参考文献[4],从42周开始每隔3 d进行1次镜检,共进行3次,选择前向精子比例<20%,且直线前向精子比例<10%的个体作为弱精组样本,前向精子比例>80%,且直线前向精子比例>40% 的个体作为对照组样本,每组各4只。
1.1.2 主要试剂 考马斯亮蓝G250、蛋白酶抑制剂混合物和BCA试剂盒均购自北京康为世纪生物科技有限公司;10% SDS-PAGE预制胶购自伯乐生命医学产品(上海)有限公司;肽N-糖苷酶F(PNGase F)购自NEB(北京)有限公司。
1.2 试验方法
1.2.1 样品制备 采集宁都黄鸡公鸡精液,按精液体积加入蛋白酶抑制剂混合物(终浓度为1%),4 500×g 4 ℃离心10 min;吸上清,重复2~3次。采用BCA法测定上清液总蛋白浓度,-80 ℃保存。
1.2.2 蛋白质去糖基 取30 μg总蛋白,加入0.8 μL PNGase F,100 ℃消化10 min。
1.2.3 SDS-PAGE 取25 μg去糖基总蛋白,加入4×DTT buffer,变性,10% SDS-PAGE电泳(200 V·h-1),考马斯亮蓝染色,脱色。
1.2.4 胶内酶解 切下电泳胶上目标条带,置于EP管中,同时切下空白胶块作对照;加入200~400 μL 100 mmol·L-1NH4HCO3/30% ACN脱色,清洗至透明,弃上清,冻干;每管加入90 μL 100 mmol·L-1NH4HCO3,10 μL 100 mmol·L-1DTT,56 ℃孵化30 min;弃上清,每管加100 μL 100% ACN,5 min后吸除;每管加入70 μL 100 mmol·L-1NH4HCO3,30 μL 200 mmol·L-1IAA(现配,避光保存),暗处放置20 min;弃上清,加入100 μL 100% ACN,5 min后吸去,冻干;冻干后加入5 μL 2.5~10 ng·μL-1Trypsin溶液,置于4 ℃ 冰箱30~60 min,使胶块充分吸胀(弃除剩余液);再加入20~30 μL 50 mmol·L-1NH4HCO3缓冲液(无Trypsin),pH 7.8~8.0,37 ℃反应过夜20 h左右;吸出蛋白酶解液,转移至新EP管中,原管中加入100 μL 60% ACN/0.1% TFA超声15 min, 吸出溶液并入前次溶液,反复抽提3次,合并,冻干;样品制备完成。
1.2.5 质谱分析 质谱上机分析由中国农业科学院北京畜牧兽医研究所农业农村部动物遗传育种与繁殖(家禽)重点实验室完成。
1.3 试验数据分析
使用Thermo Proteome Discoverer 软件进行蛋白质检索和鉴定,比对红原鸡参考蛋白质组数据库(Gallusgallus(Red jungle fowl)Reference proteome);数据差异分析使用SPSS 23.0软件T检验完成;选择表达差异倍数≥2(上调)或≤0.5(下调)且错误发现率q< 0.05的蛋白为差异表达蛋白;对每个样品中蛋白相对含量进行聚类分析并进行Z值校正,利用聚类热图观察不同蛋白在不同样品间比较时的上调、下调情况;针对筛选出来的差异蛋白进行GO注释、KEGG功能富集分析和互作网络分析。
2 结 果
2.1 弱精和正常鸡只筛选
42周龄开始筛查宁都黄鸡公鸡的精子质量,包括精子密度、精子活力和精液量,从中筛选出对照组和弱精组个体各4只,T检验显示,弱精组个体的精子密度和精子活力极显著低于对照组(P<0.01,表1)。

表1 对照组与弱精组精液质量比较
2.2 SDS-PAGE电泳
总蛋白去糖基化后,SDS-PAGE结果显示,同组内平行样本间一致性较好,弱精组和对照组间的差异条带明显(图1)。
2.3 弱精组与对照组差异表达精浆蛋白分析
本研究在弱精组与对照组中共发现584个蛋
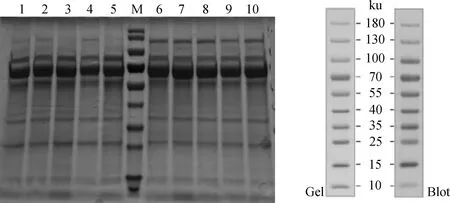
M. 蛋白质相对分子质量标准;1. 弱精组混合样;2~5. 弱精组L1-L4;6~9. 对照组N1-N4;10. 对照组混合样 M.Protein marker; 1. Mixed samples in asthenospermia group; 2-5. L1-L4 in asthenospermia group; 6-9. N1-N4 in control group; 10. Mixed samples in control group图1 SDS-PAGE电泳结果(左)和蛋白marker分子量(右)Fig.1 SDS-PAGE result(left) and protein marker molecular mass (right)
白,两组间差异表达蛋白有78个。差异蛋白聚类分析显示,蛋白被分为两个主要的簇(纵向),每一组中又被分为上调(红色)和下调(蓝色)表达蛋白,样品聚类分析结果(横向)与样品实际组别相符(图2)。与对照组相比,弱精组中有5个精浆蛋白表达上调,包括KRT9、SEPP2、VTG2、ABHD14B和一个未知蛋白,其余73个蛋白均表达下调,其中,VNN1、PLCZ1、GK和SLC2A3等蛋白表达下调倍数较大(q<0.05),值得注意的是,HOGA1、PAH和LCAT仅在对照组的全部样品中检测到表达,KRT9和SEPP2仅在弱精组全部样品中检测到表达(表2)。
2.4 差异蛋白的GO注释和KEGG富集分析
利用DAVID在线进行弱精组和对照组精浆差异蛋白的基因功能注释和信号通路富集分析,结果显示,差异蛋白分子功能涉及蛋白酶活性和蛋白域特异结合;涵盖的生物学过程包括糖代谢、蛋白质水解和高尔基体建立等;涉及的细胞功能包括细胞器、细胞膜、细胞质和髓鞘等(图3)。KEGG富集分析发现,差异蛋白富集于新陈代谢、糖酵解、碳代谢、抗体合成和氨基酸合成等信号通路(图4)。
2.5 蛋白互作分析
利用SRTING在线软件分析差异蛋白间的互作情况,将互作程度为高置信度(Score≥0.7)的蛋白列出(图5),其功能主要涵盖了糖代谢、脂代谢、ATP合成和小分子代谢等生物学功能(表2)。
3 讨 论
本研究仅在正常组或弱精组中检测到的蛋白在人或其他动物中均与能量代谢和精子功能有关。相关研究表明,HOGA1参与谷氨酸和天冬氨酸的代谢过程,将4-羟基-2-氧代戊二酸的物质分解为丙酮酸和乙醛酸盐,其分解产物参与多种能量代谢和新陈代谢,HOGA1突变与原发性高草酸尿3型(pH3)有高度的相关性[21]。PAH是苯丙氨酸羟化为酪氨酸的限速酶,PAH活性下降或显著缺乏会导致苯丙氨酸及其旁路代谢产物堆积和酪氨酸的生物合成减少[22],而酪氨酸磷酸化程度与精子超激活运动有着一定的相关性[23]。PAH基因突变还是引起人先天性、常染色体隐性遗传的氨基酸代谢病—高苯丙氨酸血症的主要原因[24]。LCAT是脂蛋白代谢过程中起关键作用的一种酶,对维持胆固醇稳态、调节胆固醇在血液循环中的转运及胆固醇在外周组织中的清除有十分重要的作用[25-27]。膜脂质主要由胆固醇、磷脂和糖脂组成,它们分别在精子生成的不同阶段发挥细胞黏附、信号转导等作用[28]。有研究表明,人精浆中总胆固醇含量与精子的密度、数量、活力以及形态均呈正相关,包括LCAT在内的多个参与胆固醇代谢和转运的标志物在所研究的组织标本中均有不同程度的表达,而精浆中胆固醇浓度与血清胆固醇、血脂水平、血清中生殖激素(FSH、LH、睾酮、雌二醇、性激素结合球蛋白、抑制素B)水平均无相关性,表明精浆中的胆固醇可能对精子发生具有重要作用[29]。KRT9基因属于细胞骨架中间丝结构蛋白家族,能与均质状基质共同构成的一种硬蛋白质,保护上皮细胞免受损坏或机械压力,KRT9致病突变是导致表皮松解性掌跖角化病的主要原因[30]。目前为止,SEPP2基因被发现仅存在于非哺乳动物基因组内[31],在鸡体内主要负责硒转运,在鸡肝和肾中,该基因的表达随饲喂硒浓度升高而增加[32-33]。有研究显示,在不同浓度硒作用下,鸡不同脑区部位中SEPP2的表达呈现不同趋势。在高硒组,鸡脊髓中SEPP2基因与对照组相比,表达呈极显著增加,而在小脑中表达呈极显著下降;而在低硒组,脊髓中SEPP2基因表达与对照组相比,表达仍呈显著的增加,而在小脑中表达与对照组相比,差异不显著;在鸡嗅球中无论是高硒还是低硒组SEPP2基因表达差异均不显著[34]。相关文献报道显示,硒有利于人和动物精子活力的水平提升[35-36],而本研究中,仅在弱精组公鸡中检测到与硒转运相关的SEPP2蛋白表达,SEPP2蛋白表达量高低与公鸡体内硒含量的高低以及精子活力的关系仍需进一步研究。除此之外,本研究结合差异表达倍数和蛋白互作等信息,筛选出若干与精子获能和代谢等作用相关,可作为研究弱精症发病机理的候选蛋白。其中,VNN1基因编码泛酰巯基乙胺酶,在其催化作用下生成的半胱胺是防止脂类过氧化的强抗氧化剂[37],VNN1基因还受到类固醇生长因子SF-1和SOX9调控,有助于调节睾丸的应激反应以及维持CoA水平[38]。PLCZ1基因是睾丸特异表达基因,它与CAPZA3、IGPB1b和TUBA3b基因具有维持精子头部形状的功能[39]。SLC2A3基因编码葡萄糖转运蛋白3,负责葡萄糖转运。研究显示,热应激通过激活ERK1/2信号通路增加HSP70表达,进而通过上调SLC2A3和LDHA的表达促进乳酸合成[40],SLC2A3在人类精子获能过程中磷酸化水平升高[41]。

图2 弱精组(L1-L4)和对照组(N1-N4)样本差异表达蛋白聚类热图Fig.2 Results of differentially expressed proteins cluster analysis in asthenospermia (L1-L4) and control (N1-N4) groups

生物学过程:1.糖酵解过程;2.糖异生;3.中间丝形态;4.细胞骨架形态;5.甘油醛-3-磷酸生物合成;6.蛋白质水解;7.基于微管进程;8.上皮细胞分化;9.his细胞束浦肯野肌细胞黏附参与细胞通讯;10.高尔基体的建立;11.氧化还原法;12.心室心肌细胞动作电位的调节。细胞组分:13.胞外外切体;14.细胞外间隙;15.髓鞘;16.胞质溶胶;17.角蛋白丝;18.血液微粒;19.中间丝;20.细胞;21.焦点黏附;22.细胞黏附连接;23.质膜外侧;24.细胞外基质。分子功能:25.结构分子活性;26.蛋 白域特异性结合;27.丝氨酸型内肽酶活性;28.β-半乳糖苷酶活性 Biological process: 1.Glycolysis process;2.Gluconeogenesis;3.Intermediate filament morphology;4.Cytoskeleton morphology;5.Glyceraldehyde-3-phosphate biosynthesis;6.Proteolysis;7.Microtubule based process;8.Epithelial cell differentiation;9.His cell bundle Purkinje myocyte adhesion and participation in cell communication; 10.Establishment of Golgi body;11.Redox method;12.Regulation of action potential of ventricular cardiomyocytes. Cell component:13.Extracellular body; 14. Extracellular space;15.Myelin sheath;16.Cytoplasmic sol;17.Keratin filament;18.Blood particles;19.Intermediate filament;20.Cell;21.Focal adhesion;22.Cell adhesion;23.Outer plasma membrane;24.Extracellular matrix. Molecular function: 25.Structural molecular activity;26.Protein domain specific binding;27.Serine endopeptidase activity;28.β-galactose glucosidase activity图3 GO功能注释结果Fig.3 Functional annotation result of gene ontology
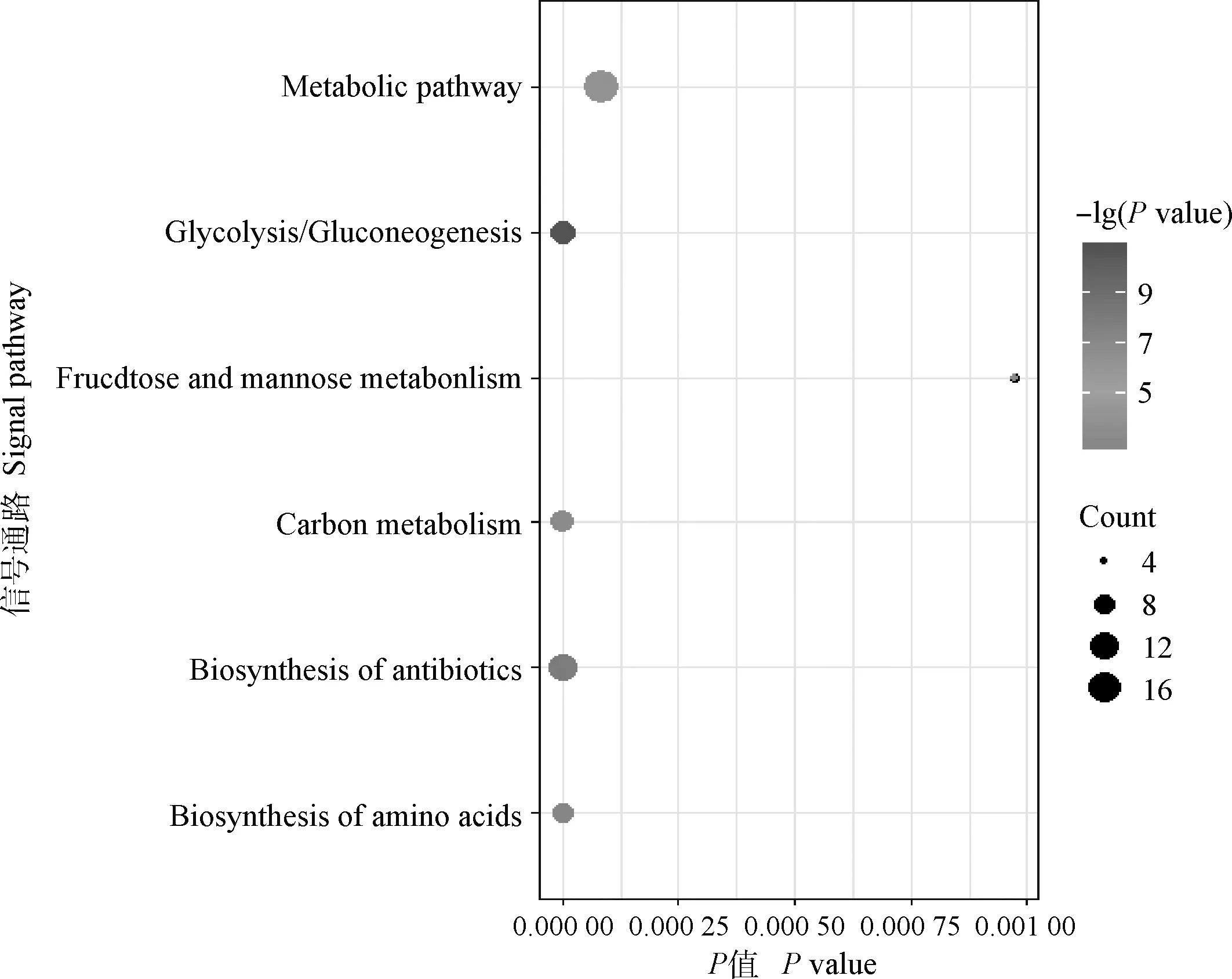
图4 KEGG功能富集分析Fig.4 Functional enrichment analysis of KEGG
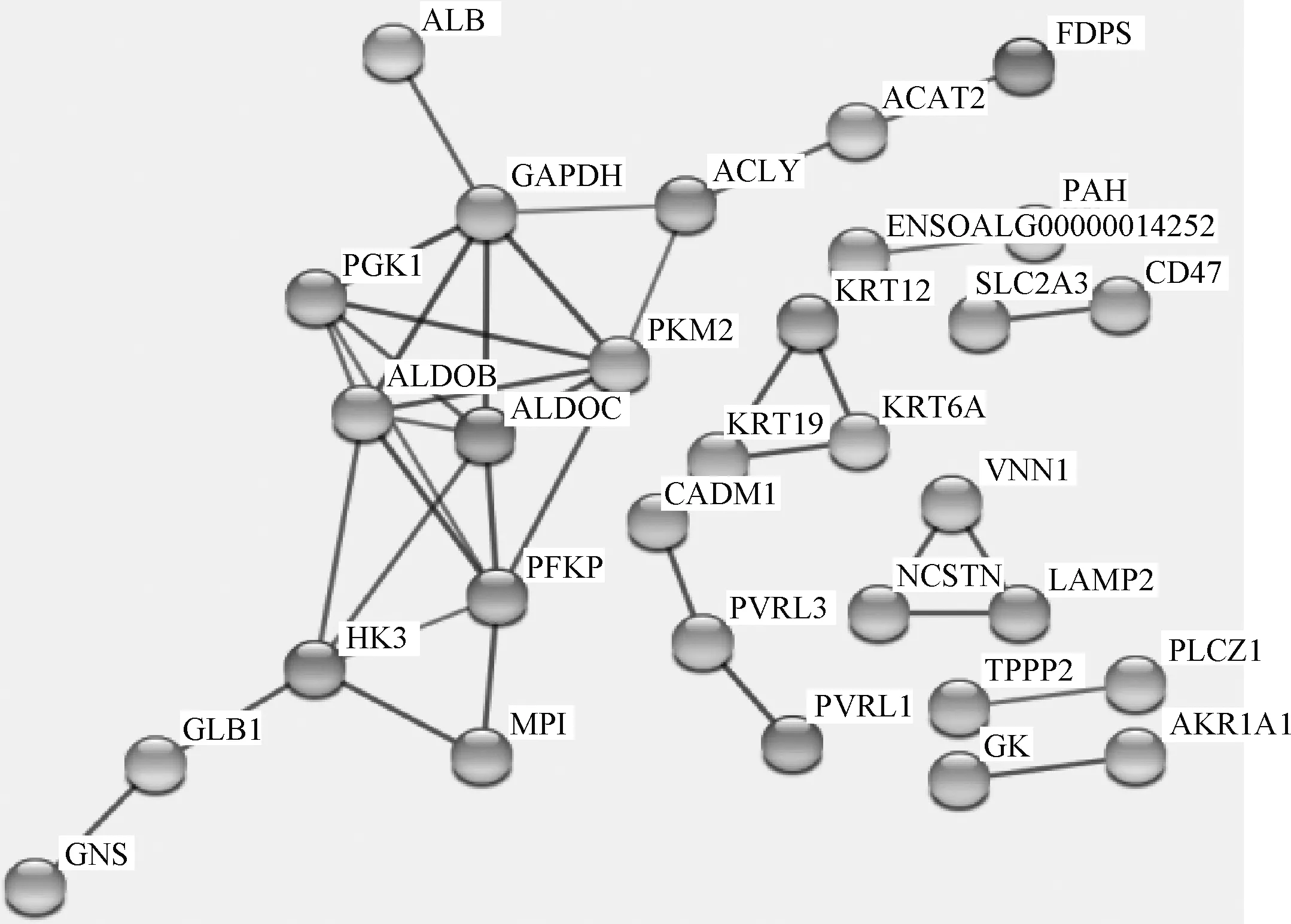
图5 差异蛋白互作分析图Fig.5 Differential protein interaction analysis graph
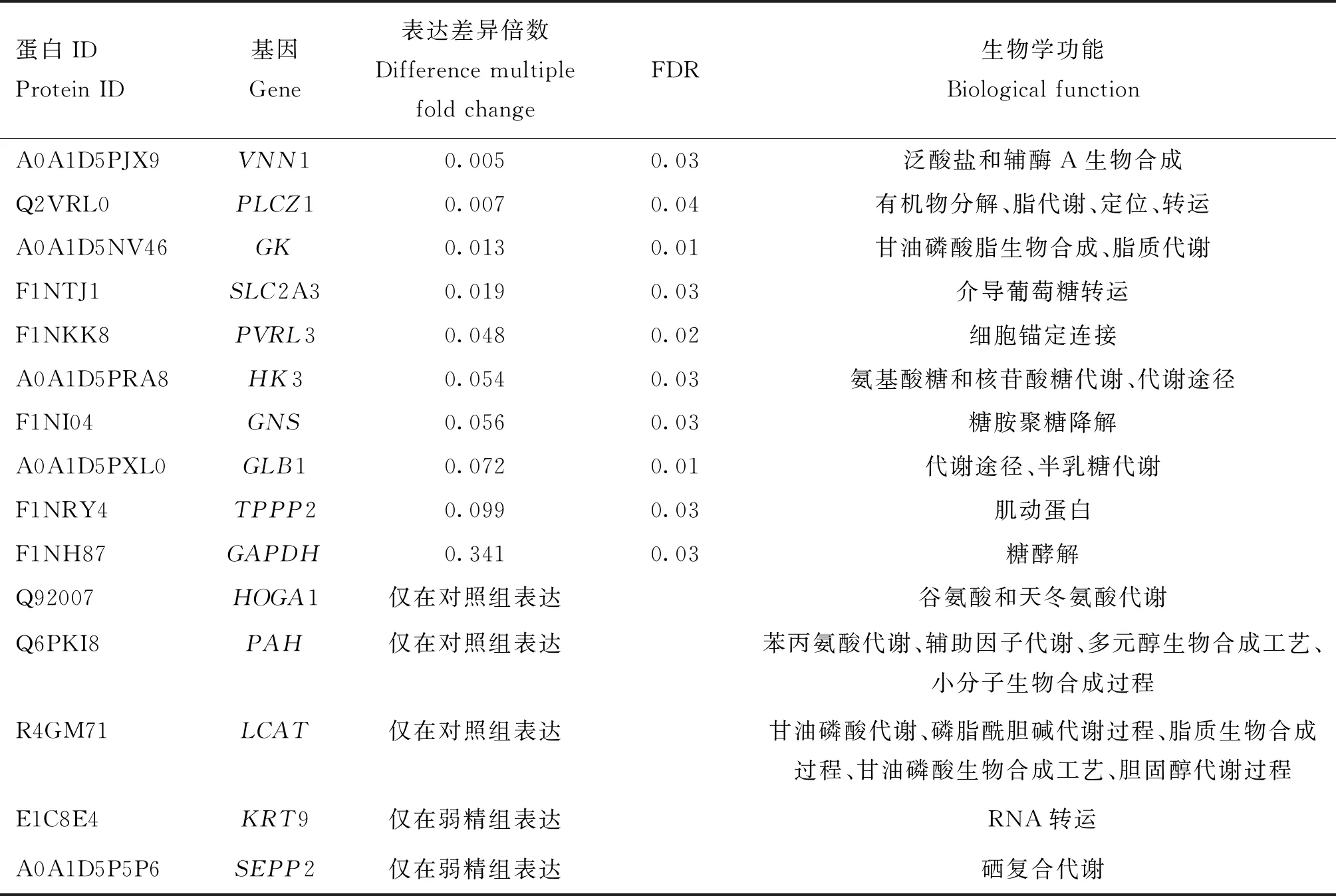
表2 部分差异表达蛋白结果
本研究所得到的弱精组和对照组差异表达蛋白后续经过进一步验证并结合多组学研究,为今后发现更多与弱精症发生相关的未知蛋白或基因提供可能,也为进一步阐明弱精症的发病机理提供依据。
4 结 论
在宁都黄鸡弱精症和正常公鸡的精浆蛋白中筛选到78个差异表达蛋白,其中,5个蛋白在弱精组中表现为上调,其余均表现为下调。生物信息学分析显示,差异表达蛋白功能涵盖糖代谢、脂代谢、ATP合成和小分子代谢等生物学功能。
