鼠伤寒沙门菌烈性噬菌体的分离鉴定与生物学特性
2021-03-30何依蓉张奕杰陈晓聪张家翔陈培富
何依蓉,张奕杰,杨 伟,陈晓聪,张家翔,陈培富
(云南农业大学动物医学院, 昆明 650201)
沙门菌(Salmonellaspp.)是食物污染中常见的致病菌。全球每年因沙门菌引起的伤寒及胃肠炎病例约有13亿例[1-2]。其中,鼠伤寒沙门菌具有广泛的致病性,分离率居高不下,耐药性也日趋突出,是具有重要公共卫生意义的人兽共患病原菌[2]。在当前我国实施禁止饲料预防性添加抗生素的政策形势下,积极发展噬菌体制剂用于耐药性鼠伤寒沙门菌引起的感染治疗或对环境、食品的污染控制,具有重要的现实意义和应用价值。噬菌体广泛分布于自然环境。据估计,噬菌体的丰度为106~108·mL-1,这为人类提供了一个丰富的天然抗菌资源库[3-4]。其中,烈性噬菌体作为一种能够高效裂解细菌的病毒,具有高度的宿主特异性,只裂解特定种及型的宿主菌,因此它们不会破坏环境中的其他微生物[5],也不会破坏肠道正常菌群结构,有望替代抗生素用于防治细菌性感染[6]。美国食品和药物管理局批准了一种由噬菌体混合而成的食品添加剂,能够有效杀灭食物中的多型李斯特杆菌[7]。本试验拟以前期自行分离自散装鲜牛奶样品的一株鼠伤寒沙门菌为宿主菌,分离相应的烈性噬菌体,并对其生物学特性进行研究,以及评价其在动物体内防治疾病的效力。
1 材料与方法
1.1 材料
武定鸡3只,分笼饲养;BALB/c小鼠100只(雌雄各半),均为健康动物。细菌培养基购自环凯生物有限公司。宿主菌ND104由本实验室分离自散装牛奶并保存。细菌DNA提取试剂盒和胶回收试剂盒购自生工生物工程有限公司。肠炎沙门菌参考菌株ATCC13076购自中国菌种保藏中心,其他受试菌株由本实验室分离并保存。
1.2 噬菌体的富集
3只试验鸡连续7 d每日灌服鼠伤寒沙门菌悬液1 mL (1.04×109CFU)。随后参照Mclaughlin等[8]报道的方法富集噬菌体,即7 d后取1.0 g混合粪样加入5 mL LB液体培养基,充分混匀,自然沉降10 min,取上清用灭菌滤纸过滤。滤液经12 000 r·min-1离心10 min,以0.22 μm孔径的灭菌滤膜再次过滤,取2 mL收集的液体与10 mL处于对数生长期(OD600 nm= 0.6)的鼠伤寒沙门菌悬液混匀。37 ℃,170 r·min-1摇床振荡培养过夜,12 000 r·min-1离心10 min,取上清液重复3次富集培养操作,最后用0.22 μm微孔滤膜过滤以除去残留的细菌细胞,以获取含噬菌体的原液,分装,4 ℃ 保存备用。
1.3 噬菌体的分离与纯化
将20 μL噬菌体原液与500 μL对数生长期鼠伤寒沙门菌悬液混匀,加入5 mL冷却至50 ℃的含7 g·L-1琼脂的LB培养基,倒至预先凝固的LB平板上制成双层平板,37 ℃倒置培养过夜。挑取单个噬菌斑,接种于菌液,37 ℃、170 r·min-1振荡培养12 h,取样制成双层平板进行纯化,反复纯化2~3次。
1.4 噬菌体生物学特性分析
1.4.1 噬菌体效价测定 以LB培养液对纯化噬菌体液进行10倍连续稀释,各取10 μL稀释液与10 μL宿主菌悬液混合,静置3 min,迅速制成双层平板,37 ℃倒置培养过夜,取噬菌斑数在30~300的平板计数,计算噬菌体效价。噬菌体效价(PFU·mL-1)= 噬菌斑数×稀释倍数×100[9]。
1.4.2 噬菌体核酸类型鉴定及其宿主谱分析 参照《分子克隆实验指南》提取噬菌体基因组[10],于-20 ℃条件下保存备用。分别加入RNase A和DNase Ⅰ进行处理核酸样品,37 ℃温育30 min;分别使用限制性内切酶SacⅠ、EcoR Ⅴ、EcoR Ⅰ对噬菌体基因组进行酶切,随后点样5 μL于10 g·L-1琼脂糖凝胶做电泳分析。根据酶切图谱,估算病毒基因组大小。将噬菌体溶液滴加于单层细菌培养物表面,培养12 h,观察噬菌体对各受试菌株的裂解情况,确定其宿主谱。
1.4.3 噬菌体最佳感染比(MOI) 将噬菌体与鼠伤寒沙门菌混匀成1∶100、1∶10、1∶1、10∶1、100∶1的不同比例,37 ℃孵育3 min,8 000 r·min-1离心5 min,弃上清,用5 mL LB液体培养基轻轻吹打重悬菌体,37 ℃ 170 r·min-1振荡培养2 h,12 000 r·min-1离心2 min,用0.22 μm微孔滤膜过滤,取上清,按“1.3”方法灌制双层平板测定噬菌体滴度,最佳感染比为产生最高噬菌体滴度的比例[11-12]。试验重复3次,每次设两个平行(下同)。
1.4.4 噬菌体一步生长曲线 将噬菌体与鼠伤寒沙门菌按最适MOI值混匀,37 ℃孵育5 min,4 000 r·min-1离心5 min,立即弃上清,以液体LB培养基轻洗沉淀,然后,加入液体LB培养基置于恒温水浴振荡器,37 ℃、180 r·min-1培养2 h,以开始培养记作0 min,于不同时间点取样测定噬菌体效价,试验重复3次。以感染时间为横坐标,噬菌体效价的对数为纵坐标,取效价平均值绘制一步生长曲线图,并计算噬菌体裂解量,裂解量=裂解末期噬菌体滴度/初期宿主菌浓度[13]。
1.4.5 噬菌体热稳定性和酸碱稳定性 取5 mL新鲜噬菌体溶液(1×107PFU·mL-1)分别于20、30、40、50、60、70、80 ℃水浴锅孵育1 h,迅速冷却样品,取样制双层平板测定噬菌体效价,每组重复3次[14]。 将缓冲蛋白胨水(BPW)pH分别调整为1、2、4、6、7、8、10和12,与噬菌体(1×107PFU·mL-1)按9∶1体积比分别混合,37 ℃孵育1 h,双层平板法测定噬菌体效价,每组重复3次[15]。
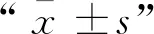
2 结 果
2.1 噬菌体的分离纯化及其效价
采用双层平板法分离纯化出1株鼠伤寒沙门菌烈性噬菌体,命名为KM104。该噬菌体在双层琼脂平板上形成清晰圆形空斑,噬菌斑直径在1 mm左右(图1)。

图1 噬菌体KM104形成的噬菌斑Fig.1 The plaques produced by phage KM104
2.2 噬菌体核酸类型及宿主谱
KM104噬菌体核酸经DNase Ⅰ处理后完全降解,而不被RNase A降解,表明核酸类型为DNA。基因组能被限制性内切酶EcoRⅠ消化为多个片段,根据酶切片段大小估算基因组大小约为28 kb。
噬菌体KM104能有效裂解YS7、ND104 2株鼠伤寒沙门菌;也能裂解YN2、YS4、YS2、YS6 4株沙门菌,但效果不理想。详情见表1。
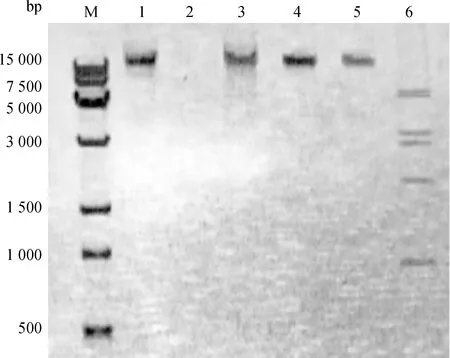
M. 15 kb相对分子质量标准; 1. KM104基因组; 2. DNase 处理基因组; 3. RNase A处理基因组; 4. Sac Ⅰ酶切基因组; 5. EcoR Ⅴ酶切基因组; 6. EcoR Ⅰ酶切基因组 M. 15 kb molecular marker; 1. Genome of phage KM104; 2. DNase Ⅰ treated genome; 3. RNase A-treated genome; 4. Sac Ⅰ digested genome; 5. EcoR Ⅴ digested genome; 6. EcoR Ⅰ digested genome图2 噬菌体KM104核酸类型及酶切电泳分析Fig.2 The electrophoresis analysis of nucleic acid type of phage KM104 and enzyme digestion
2.3 噬菌体最佳感染比(MOI)
噬菌体KM104的MOI为1∶10时,产生子代噬菌体的效价最高,达4.6×108PFU·mL-1,故1∶10 是KM104扩增时的最适MOI值(表2)。
2.4 噬菌体一步生长曲线
在最佳感染比(MOI=0.1)条件下测定噬菌体的一步生长曲线(图3),显示噬菌体KM104与宿主菌作用6 min后效价显著升高,表明KM104潜伏期为6 min,而后效价平稳持续上升,一直持续到70 min。 噬菌体裂解量为41(1.31×108/3.2×106)。
2.5 噬菌体热稳定性和酸碱稳定性
噬菌体KM104经20~60 ℃水浴处理1 h后效价基本不发生改变,但经70 ℃处理1 h后效价下降约70%,80 ℃处理 1 h后完全失活(图4)。
在pH 2.0~8.0时,噬菌体KM104效价与初始效价无显著变化,维持良好的裂解活性,但当pH达到10以上,噬菌体活性快速下降,pH达12时噬菌体活性完全消失,表明噬菌体KM104耐酸性强,不耐强碱性环境(图5)。

表1 KM104宿主谱
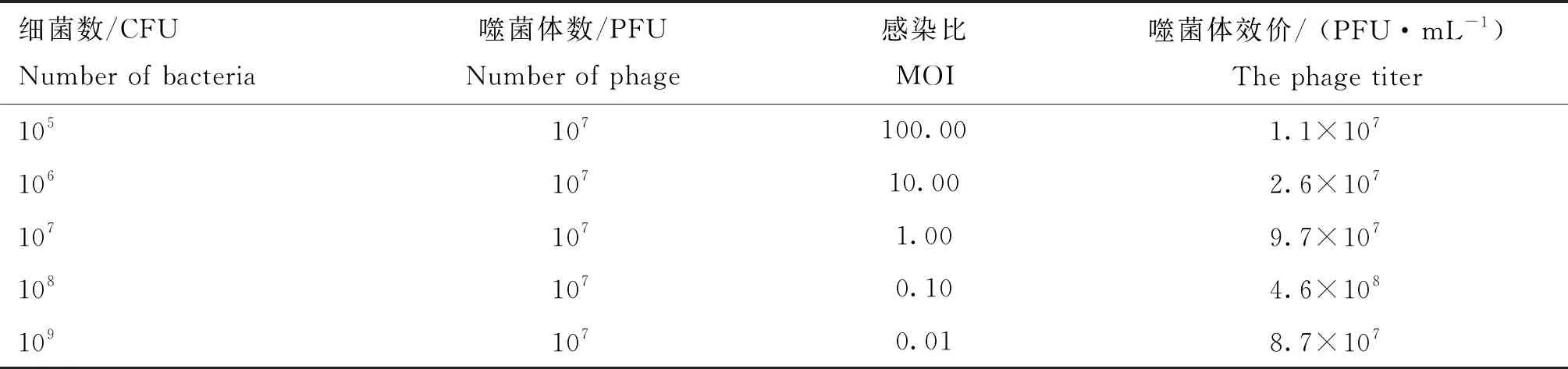
表2 噬菌体KM104最佳感染比测定
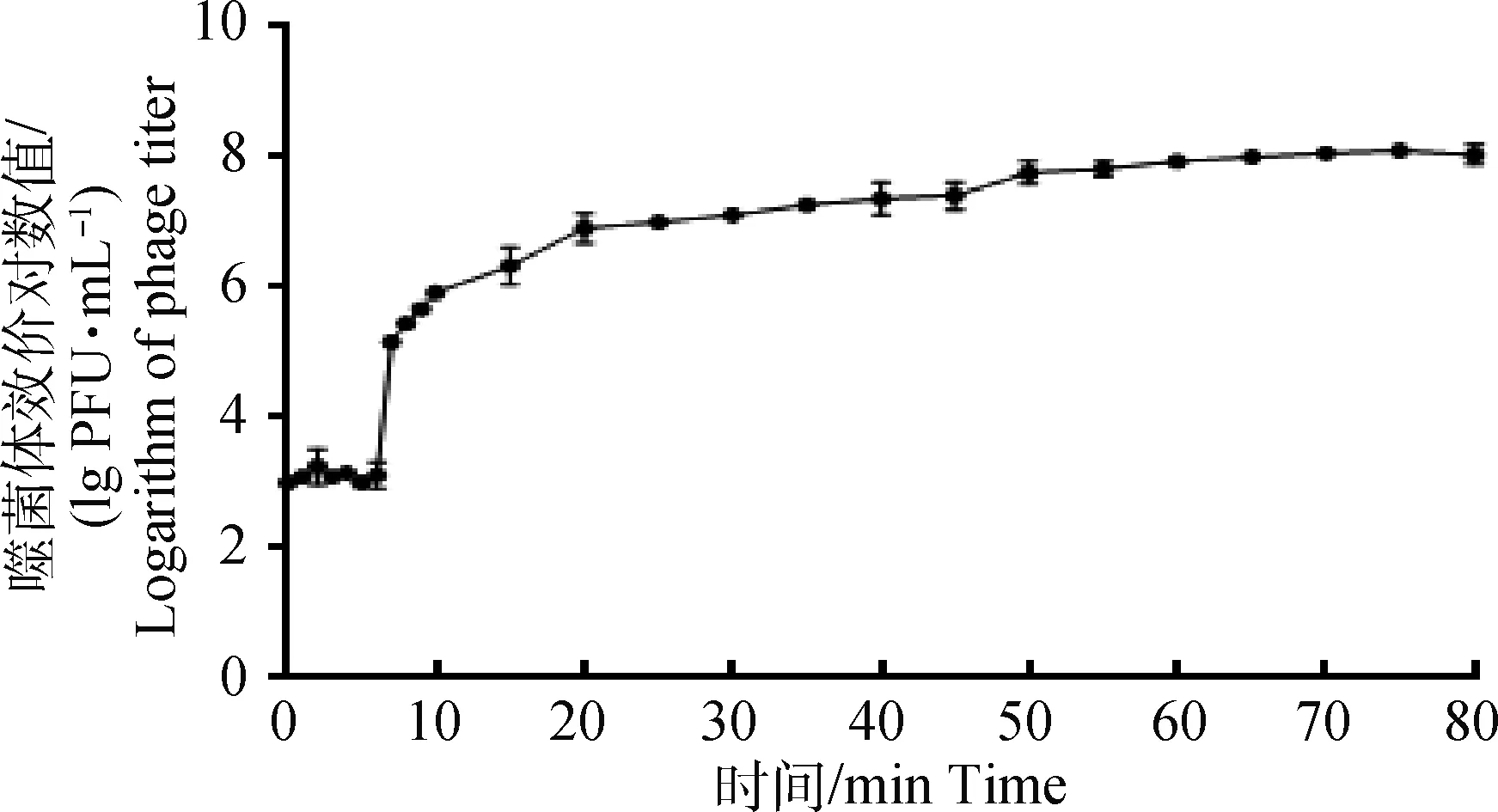
图3 噬菌体KM104一步生长曲线Fig.3 The one-step growth curve of phage KM104

图4 噬菌体KM104热稳定性Fig.4 The thermal stability of phage KM104

图5 噬菌体KM104 pH稳定性Fig.5 The pH stability of phage KM104
2.6 噬菌体体内裂解能力
感染未治疗组小鼠24 h开始出现死亡,剖检发现鼠肝、脾肿大充血,肠系膜静脉充血,部分肠道坏死;感染治疗组小鼠72 h内未见死亡,剖检仅见脾轻微充血,肠腔内有少量黄色浆液性内容物;未感染治疗组小鼠72 h内未见死亡,剖检仅见肠腔内容物增多(图6)。
感染未治疗组及感染治疗组小鼠脾指数和胸腺指数与对照组差异极显著(P<0.01);未感染治疗组小鼠脾指数和胸腺指数略高于对照组,但差异不显著(P>0.05)(图7)。
小鼠十二指肠切片经HE染色后镜检发现,感染未治疗组小鼠十二指肠黏膜下层毛细血管扩张充血及出血,肠腺细胞质深染,肠绒毛结构不完整,绒毛上皮严重脱落,固有层有炎性细胞(淋巴细胞和巨噬细胞为主)浸润;感染后治疗组小鼠十二指肠小肠绒毛仅有少量脱落,绒毛上皮有少量的杯状细胞,少量充血和炎性细胞。未感染治疗组与对照组,十二指肠形态完整,结构清晰,细胞质染色均匀(图8)。与对照组相比,感染未治疗组十二指肠绒毛高度和腺窝深度降低,差异极显著(P<0.01),而噬菌体治疗可显著改善沙门菌诱导的这种降低(图9)。
3 讨 论
本试验前期尝试在污水沟、池塘、鸡场堆粪坑等多处采样分离噬菌体,均未获得成功,究其原因可能与噬菌体密度小和宿主谱狭窄有关。之后通过给鸡提供人为添加宿主菌株的饮水以诱导相应噬菌体在体内增殖,成功从试验鸡粪便中分离得到1株鼠伤寒沙门菌烈性噬菌体。该株噬菌体(KM104)能够裂解鼠伤寒沙门菌,但对甲型副伤寒沙门菌裂解作用明显较弱,未见其裂解肠炎沙门菌,表明该株噬菌体有较强的宿主特异性。若应用于动物生产,针对其宿主谱较窄的不足,可与其他噬菌体合用,或对控制噬菌体裂菌谱的基因片段进行基因工程改造以增加其裂菌谱[16]。

1. 感染未治疗组; 2. 感染后治疗组; 3. 未感染治疗组; 4. 对照组。A. 肝; B. 脾; C. 胃及肠道 1. The infected but untreated group; 2. The infected and treated group; 3. The uninfected but treated group; 4. The control group; A. Liver; B. Spleen; C. Stomach and intestine图6 不同处理组小鼠病理变化(部分样品)Fig.6 The gross lesion in groups of mice with different treatment (partial samples)

#.0.01 A. 对照组; B. 未感染治疗组; C. 感染未治疗组; D. 感染治疗组 A. Control group; B. Uninfected but treated group; C. Infected but untreated group; D. Infected and treated group图8 不同处理组十二指肠HE染色(400×)Fig.8 HE staining of the duodenum in groups with different treatment (400×) 噬菌体KM104在pH为2~8效价保持稳定,即使在pH为1的强酸性条件下仍能保留一定活性,鉴于动物胃酸通常保持pH≥2.2,这将利于该噬菌体的口服应用,其耐酸碱能力强于SP17、T139、SLMP1等噬菌体[17-19];噬菌体KM104的热稳定性也明显优于Pst87170、PS11等噬菌体[20-21]。 在测定噬菌体生长曲线时,按最适MOI混匀噬菌体与菌液后需37 ℃孵育10~15 min[22-24],使噬菌体吸附于宿主菌,离心后洗涤菌体沉淀,再继续进行培养,按培养时间测定噬菌体效价。但本试验尝试分别孵育10、15 min后测定噬菌体效价,均已错过噬菌体潜伏期的测定时间,后将孵育时间缩短为5 min,成功测出噬菌体潜伏期,约为6 min。表明KM104吸附期及潜伏期较短,能在短时间内开始释放子代噬菌体。 本试验采取腹腔注射,使用噬菌体KM104治疗鼠伤寒沙门菌感染的小鼠,结果显示,感染治疗组小鼠存活率较感染未治疗组提高75%,优于赵影等[25]报道的沙门菌噬菌体治疗效果;小鼠病理剖检及十二指肠组织切片染色观察可发现,使用噬菌体治疗能减少感染鼠伤寒沙门菌引起的十二指肠损伤,且高效价的KM104对小鼠无明显毒性,表明噬菌体KM104对鼠伤寒沙门菌感染具有良好治疗效果。 通过给鸡饲喂含鼠伤寒沙门菌的饮水,随后从其粪便中分离到1株鼠伤寒沙门菌噬菌体(KM104),该噬菌体潜伏期短,增殖迅速,热稳定性及酸碱耐受性良好,并在小鼠表现出较好的治疗效果,显示其具有应用于生物防治的前景。
4 结 论
