红曲橙色素的发酵制备及其在红曲红色素化学半合成中的应用
2021-03-30刘彩陈莎高梦祥李利
刘彩,陈莎,高梦祥,李利
(长江大学生命科学学院,湖北 荆州 434025)
红曲色素是红曲菌(霉)发酵产生的一类聚酮化合物,作为一种天然食用色素可添加于肉制品、乳制品、糖果、糕点等多种食品中(GB2760—2014《食品安全国家标准食品添加剂使用标准》)。根据颜色和吸收光谱特征,红曲色素可分为3大类:红曲橙色素、黄色素和红色素[1]。其中,红曲橙色素中的红斑红曲素(rubropunctatin)和红曲玉红素(monascorubrin)的化学性质比较活泼,在pH≥6的条件下,能与氨基酸等一级胺发生亲氨基反应(aminophilic reaction),通过形成希夫氏碱和脱水步骤,最终导致其吡喃环中的氧被氮替换,所生成的红色衍生物属于红曲红色素[2-5]。在目前报道的49种红曲红色素中,至少有27种被认为是红斑红曲素和红曲玉红素发生亲氨基反应所产生的衍生物[6]。
研究表明,在红曲色素发酵培养基中添加各种氨基酸[4,7-9],或者分离纯化得到红斑红曲素和红曲玉红素,再与氨基酸在体外进行亲氨基反应[2,9-11],均可产生对应的氨基酸衍生红曲红色素。与2种经典红曲红色素——红斑红曲胺和红曲玉红胺相比,这些氨基酸衍生红曲红色素不仅具有水溶性好、稳定性高等特点[4,7-8],还具有抗炎[11]、预防肥胖[12-14]、抑菌[15]、抗病毒[16]等多种生物活性,其应用前景十分广阔。
然而,在发酵过程中,所加入的氨基酸在作为红曲色素衍生物的前体物的同时,也是重要的氮源物质,对红曲菌的生长、以及红曲色素和真菌毒素桔霉素等次生代谢产物的生物合成都有重要影响[17-18]。例如,添加色氨酸不利于红曲菌的生长,红曲红色素产量也很低;添加谷氨酸利于红曲菌的生长和红曲红色素的产生,但会引起毒素桔霉素的大量积累[17]。相比之下,氨基酸衍生红曲红色素的体外化学半合成,是一种更安全的生产方法,但是,由于化学半合成的前体物红斑红曲素和红曲玉红素的分离纯化及制备,目前主要依靠制备型液相色谱[2]、硅胶柱层析[19]和薄层层析[14]等方法,载样量小,效率低,严重制约了其规模化生产。在本课题组前期研究中,发现酸性条件可以诱导红斑红曲素和红曲玉红素的大量积累[20]。在此基础上,本研究通过低pH值条件下的两步发酵过程,结合简单、高效的结晶分离步骤,获得了高纯度的红斑红曲素和红曲玉红素,并将其与氨基酸进行了体外亲氨基反应,成功合成了氨基酸衍生红曲红色素。本研究结果可为优质、高活性的氨基酸衍生红曲红色素的生产提供参考。
1 材料与方法
1.1 材料与试剂
红色红曲菌M7(Monascus ruberM7,CCAM070120):中国典型培养物保藏中心;葡萄糖、柠檬酸、磷酸氢二钠、磷酸氢二钾、磷酸二氢钠、硝酸钠、氯化钾、硫酸镁、硫酸亚铁、蔗糖、甲酸、甲醇、无水乙醇(均为分析纯):国药集团化学试剂有限公司;乙腈(色谱纯):美国天地有限公司;琼脂、酵母膏(生物试剂):北京奥博星生物技术有限责任公司。
1.2 仪器与设备
紫外-可见分光光度计(UV-1900):北京普析公司;离心机(Beckman Allegra X-30R):德国贝克曼公司;高效液相色谱仪(LC1200):美国安捷伦公司;液相色谱-质谱联用仪(TripleTOF 5600+):美国 AB Sciex公司;可调高速匀浆机(FSH-II):江苏金坛市环宇科学仪器厂;pH计(PB-10):德国赛多利斯公司;恒温摇床(IS-RDS3):美国精骐公司;生化培养箱(SPX-250BZ):上海博迅实业有限公司医疗设备厂;生物安全柜(HFsafe-1200):上海力申科学仪器有限公司;高压灭菌锅(HVE-50):日本株式会社平山制作所;光学显微镜(BM1000):南京江南永新光学有限公司;电热恒温鼓风干燥箱(DHC-9073BS):上海新苗医疗器械制造有限公司。
1.3 方法
1.3.1 红曲橙色素的发酵
红曲橙色素的两步发酵过程参照文献[20],具体如下:红色红曲菌M7接种于查氏酵母膏琼脂培养基(NaNO33.0 g/L、K2HPO41.0 g/L、KCl 0.5 g/L、MgSO4·7H2O 0.5 g/L、FeSO4·7H2O 0.01 g/L、蔗糖 30.0 g/L、酵母膏5.0 g/L,pH值自然),28℃培养10 d,加入无菌水,用接种环轻轻刮下孢子,双层擦镜纸过滤除去菌丝,得到孢子液,用血球计数板计数并调整孢子浓度至105个/mL。在发酵的第一步,按1%的接种量将红曲菌孢子液(105个/mL)接种于100 mL马铃薯葡萄糖液体培养基(去皮马铃薯200 g、葡萄糖20g、蒸馏水1000mL,pH值自然),28℃,200r/min恒温振荡条件培养40 h,让菌丝体充分生长但不合成色素;在发酵的第二步,向培养40 h的发酵液中加入100 mL无菌的0.2 mol/L,pH 3.0柠檬酸-磷酸氢二钠缓冲液,使培养基维持较低的pH值,28℃,200 r/min继续培养5 d,以诱导红曲橙色素的大量合成。
1.3.2 红曲橙色素的制备
发酵完毕后,10 000 r/min离心10 min,弃上清,加入与发酵液体积相等的70%的乙醇溶液(用无水乙醇和pH 2的酸水配制),10 000 r/min高速匀浆1 min,置4℃浸提12 h,10 000 r/min再次离心10 min,取上清即为红曲色素提取液。用70%的酸性乙醇溶液调整提取液的色价至(45.0±1.0)U/mL,加入0.5或1.0倍体积的酸水(用甲酸调至pH 2)降低乙醇浓度使红曲橙色素达到过饱和,置-20℃静置2 h使红曲橙色素结晶析出,10 000 r/min离心10 min,收集红曲橙色素晶体。转移橙色素晶体到培养皿中,40℃烘干至恒重。
1.3.3 红曲橙色素与氨基酸的体外亲氨基反应
用甲醇(含0.1%甲酸)配制1 mg/mL红曲橙色素溶液,用200 mmol/L,pH 7.0的磷酸缓冲液配制16 mmol/L的氨基酸溶液。由于红曲橙色素水溶性差,亲氨基反应在50%甲醇的溶液中进行,即每10 mL反应体系含上述氨基酸溶液5mL,红曲橙色素溶液1 mL,甲醇4 mL。在30℃,250 r/min摇床中孵育2 h后,用C18固相萃取柱进行净化,90%甲醇洗脱即得到氨基酸衍生红曲红色素。
1.3.4 紫外-可见光谱分析
将色素溶液稀释一定倍数后,使其在最大吸收波长处的吸光值为(1.0±0.1)左右,于300 nm~600 nm范围内以1 nm间隔进行扫描,绘制光谱图。红曲橙色素和红色素的色价分别以470 nm和500 nm的吸光值计算。色价/(U/mL)=吸光值A×稀释倍数;橙色素产量/(U/L)=[色价(U/mL)×色素提取液体积(mL)]/发酵培养基体积(mL)×1 000。
1.3.5 高效液相色谱分析
红曲色素的高效液相色谱(high performance liquid chromatography,HPLC)分析条件如下。
色谱柱:Inertsil ODS-3(250 mm× 4.6 mm,5 μm);柱温:30 °C;进样量:10 μL;检测器:二极管阵列检测器(diode array detector,DAD);检测波长:210nm~600nm,其中红曲黄色素、橙色素和红色素组分的监测波长分别为380、470、520 nm,桔霉素的监测波长为330 nm。分析红曲橙色素时,流动相A相为乙腈,B相为酸水(pH 3,甲酸调节),C 相为纯水,流速:0.8 mL/min;分析红色素时,流动相A相为乙腈(含0.1%甲酸),B相为酸水(含0.1%甲酸),梯度洗脱条件:0~18 min,15%A~80%A;18 min~30 min,80%A;30min~31min,80%A~15%A;31min~35min,15%A,流速:1.0 mL/min;分析桔霉素时,流动相A相为乙腈,B相为酸水(pH 3,甲酸调节),等度洗脱,A∶B=65∶35(体积比),流速:1.0 mL/min。红曲橙色素的HPLC梯度洗脱条件见表1。
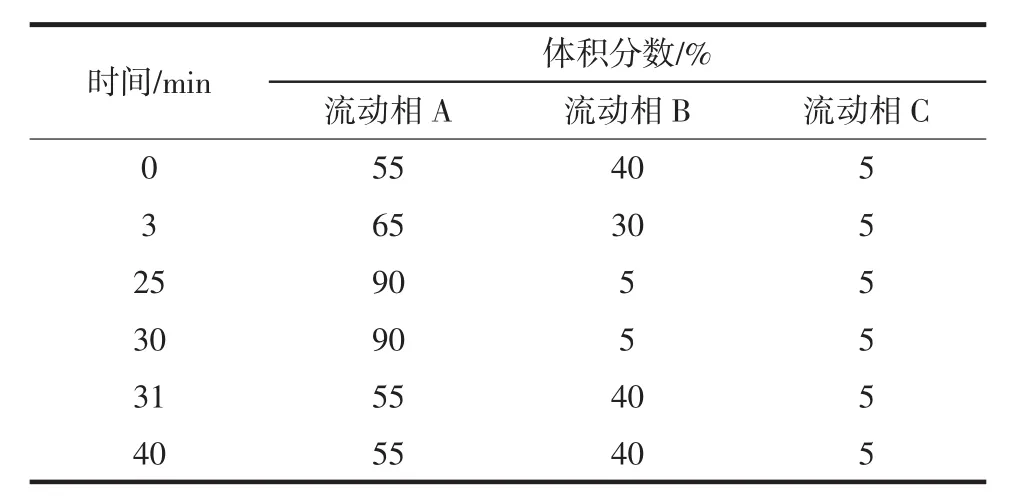
表1 红曲橙色素的HPLC梯度洗脱条件Table 1 Gradient elution conditions of HPLC for orange Monascus pigments
1.3.6 液相色谱质谱联用分析
红曲色素的液相色谱质谱联用(liquid chromatography/mass spectrometry,LC/MS)分析条件如下。
色谱柱:Kinetex 2.6 μm F5(100 mm × 2.1 mm);柱温:30℃;流动相:A相为酸水(含0.1%甲酸),B相为乙腈;梯度洗脱条件:0~1 min,95%A;1 min~8 min,95%A~15%A;8 min~9 min,15%A;9 min~9.1 min,15%A~95%A;9.1min~11min,95%A;流速:0.2mL/min;进样量:10 μL;DAD 检测波长:190 nm~700 nm;离子源:电喷雾电离,正离子模式;扫描范围:m/z 100~1 000;电喷雾电压:5 500 V;离子源温度:550℃;雾化气压力379 kPa;辅助气压力379 kPa;气帘气压力172 kPa。根据质谱检测到的准分子离子[M+H]+峰确定各红曲色素组分的分子量,并与目前报道的100多种红曲色素[7]的分子量进行比对,以进行定性分析。
2 结果与分析
2.1 红曲橙色素的液态发酵
红曲色素乙醇提取液的紫外-可见光谱图见图1。
采用pH 3条件下的两步发酵法,所获得的红曲色素提取液在300 nm~600 nm范围内仅有1个吸收峰,为472 nm。由于红曲黄色素、橙色素和红色素的最大吸收波长通常分别分布于330 nm~450 nm、460 nm~480 nm和490 nm~530 nm[1],图1所示的光谱特征表明酸性条件下生成的红曲色素以橙色素为主,而红色素和黄色素均较少,与Li等[20]的报道一致。同时,该发酵条件不仅适合红曲菌的生长,而且利于红曲橙色素的合成,生物量(干重)达(5.7±0.5)g/L,橙色素产量达(7.9±0.2)×104U/L。
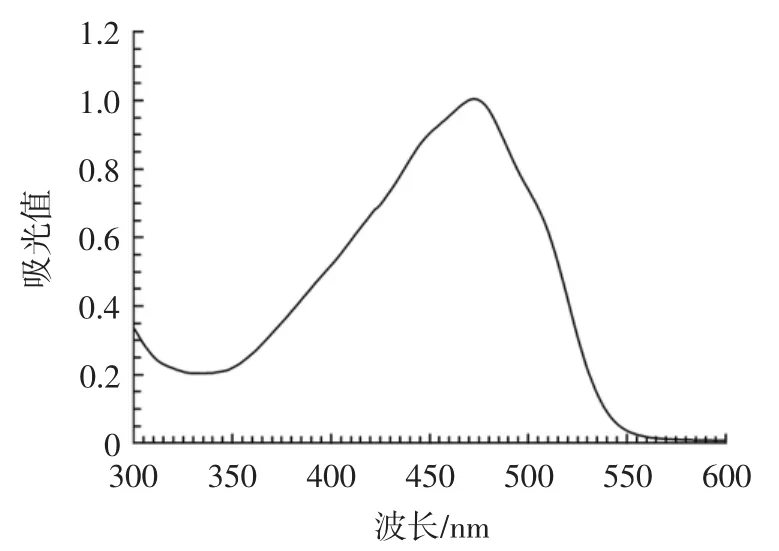
图1 红曲色素乙醇提取液的紫外-可见光谱图Fig.1 The ultraviolet-visible spectrum of the ethanolic extract of Monascus pigments
2.2 红曲橙色素的结晶分离
由于红曲橙色素的水溶性较差,向橙色素提取液(含70%乙醇)中加入水,降低乙醇浓度,可以使橙色素达到过饱和而结晶析出。红曲橙色素晶体的HPLC分析见图2。

图2 红曲橙色素晶体的HPLC分析Fig.2 The HPLC analysis of the crystallized orange Monascus pigments
由图2A和2B可知,当加入1.0倍和0.5倍体积的水时,所获得的色素晶体均检出2个主要组分O1和O2。根据二极管阵列检测器监测到的光谱图(图2C),O1和O2均在470 nm处有最大吸收峰,符合典型的红曲橙色素组分的光谱特征。其中,当加入1.0倍体积的水进行结晶分离时,每升发酵培养基可获得(0.89±0.05)g色素晶体,HPLC检测显示该色素晶体除了2个主要成分O1和O2外,还有少量杂质(图2A,峰1~峰4);当加入0.5倍体积的水进行结晶分离时,每升发酵培养基获得的色素晶体约减少了29%,为(0.63±0.04)g,但橙色素晶体纯度明显提高,未检出明显杂质(图2B)。因此,为了获得高纯度的橙色素,减少结晶分离时加入水的比例是一个有效手段。此外,2种橙色素晶体中均未检出真菌毒素桔霉素,可避免发酵时添加某些氨基酸导致的桔霉素积累而引起的安全隐患。红曲橙色素组分O1和O2的质谱图见图3。

图3 红曲橙色素组分O1和O2的质谱图Fig.3 The mass spectra of orange Monascus pigment compound O1 and O2
进一步通过LC-MS对主要组分O1和O2进行了定性分析,结果显示其准分子离子峰[M+H]+分别为m/z 355.154 1和m/z 388.184 8,分别与橙色素中的红斑红曲素和红曲玉红素的分子量相符。
2.3 红曲橙色素与氨基酸的体外亲氨基反应
亲氨基反应溶液的紫外-可见光谱图见图4。

图4 亲氨基反应溶液的紫外-可见光谱图Fig.4 The ultraviolet-visible spectrum of the aminophilic reaction solution
以不利于红曲菌生长和红色素产生的色氨酸[18],以及利于红曲菌生长和红色素产生、但导致真菌毒素桔霉素大量积累的谷氨酸[18]为前体物,与2.2制备的橙色素进行了体外亲氨基反应,反应后的色素为鲜亮的红色,在300 nm~600 nm范围有两个吸收峰,分别在410 nm和500 nm附近。HPLC分析表明,色氨酸和谷氨酸与橙色素发生反应后的红色素均含有2个主要组分,分别为 Trp-R1、Trp-R2 和 Glu-R1、Glu-R2,且该4种组分在520 nm附近有吸收峰,符合典型的红曲红色素组分的光谱特征(见图5)。
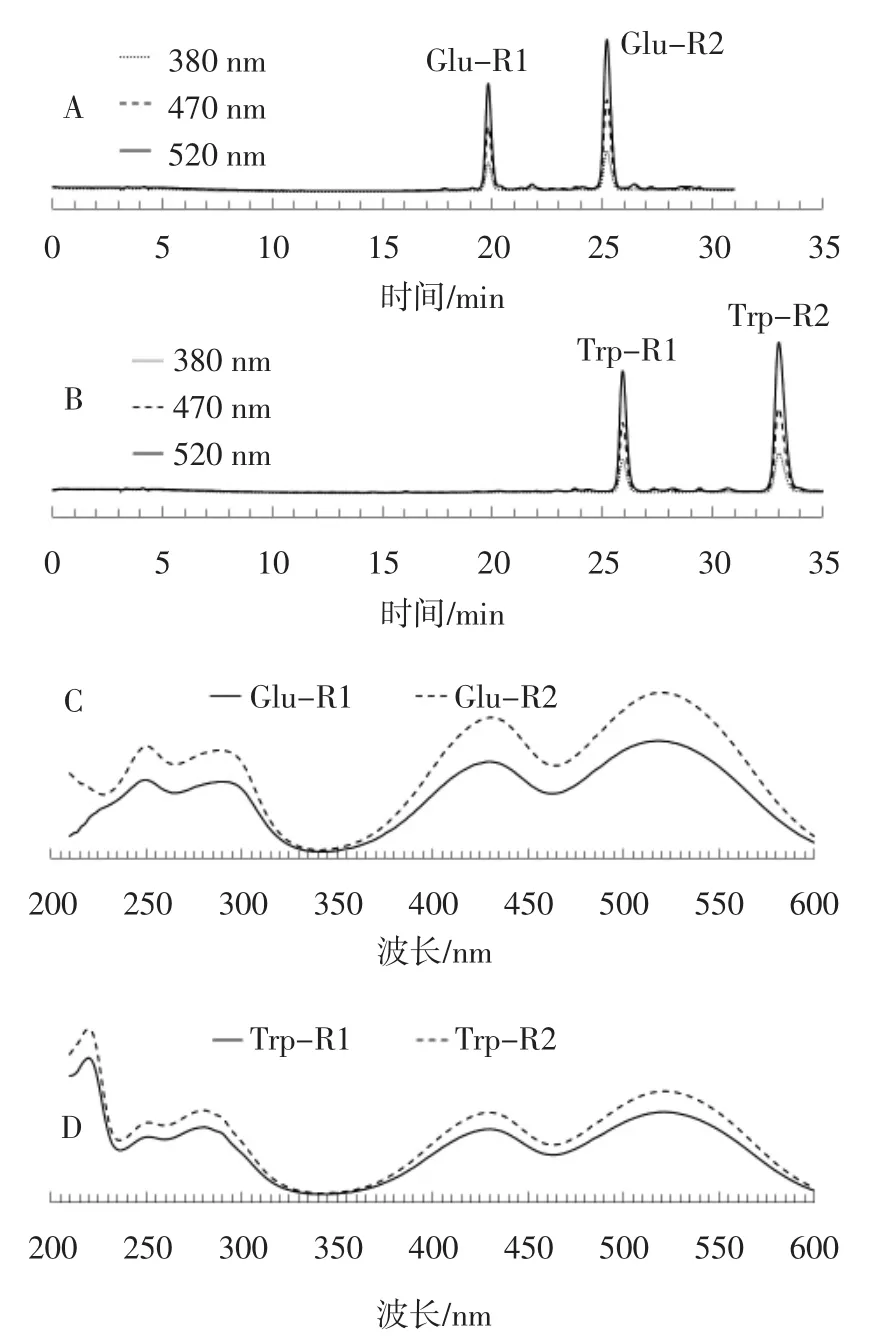
图5 氨基酸衍生红曲红色素的HPLC分析Fig.5 The HPLC analysis of amino acid-derived red Monascus pigments
根据红斑红曲素和红曲玉红素与一级胺的亲氨基反应原理,推测了其与色氨酸和谷氨酸反应后产物的化学结构,结果见图6。
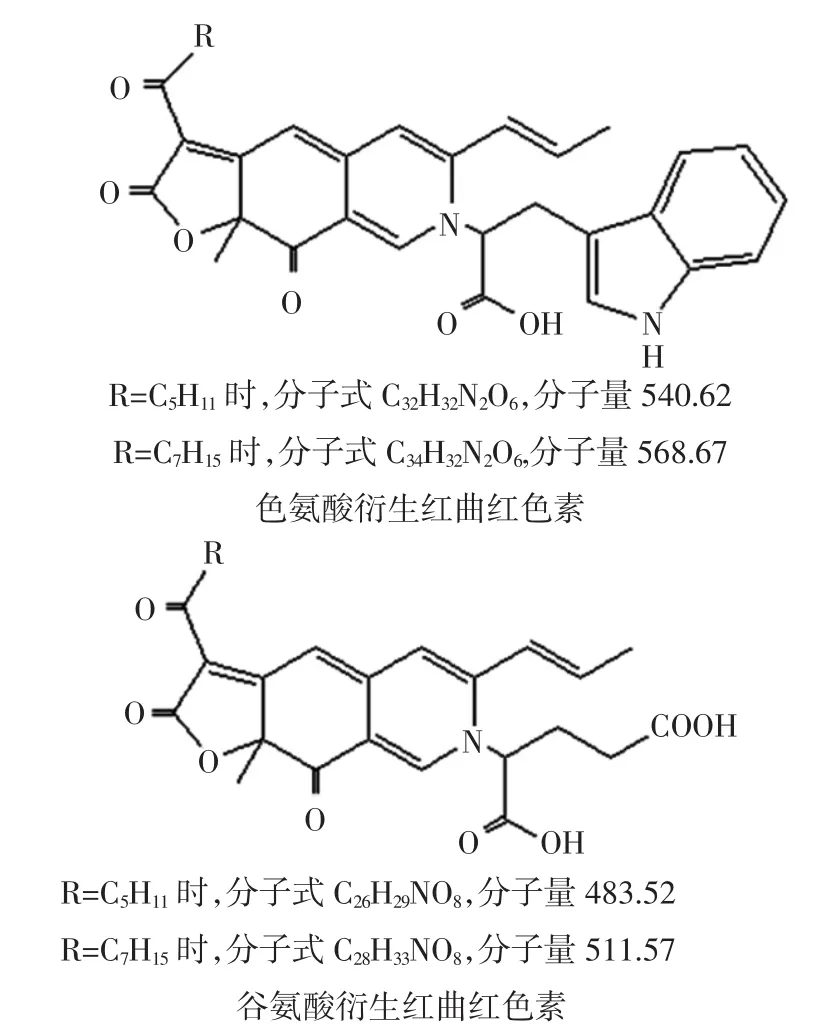
图6 色氨酸和谷氨酸衍生红曲红色素的结构Fig.6 The chemical structures of Trp-and Glu-derived red Monascus pigments
LC-MS显示,Trp-R1和Glu-R1分子量分别同红斑红曲素与色氨酸和谷氨酸的反应产物相符,Trp-R2和Glu-R2分子量分别同红曲玉红素与色氨酸和谷氨酸的反应产物相符,结果见图7。

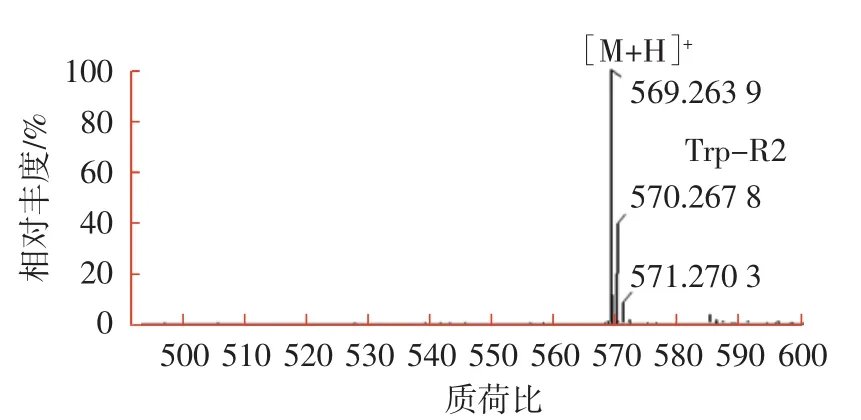
图7 红曲色素组分Glu-R1,Glu-R2,Trp-R1和Trp-R2的质谱图Fig.7 The mass spectra of pigment component Glu-R1,Glu-R2,Trp-R1 and Trp-R2
结果表明该体外反应成功地合成了特定结构的红曲红色素。在相同的条件下,1.0 mg红曲橙色素在10 mL反应体系中,与色氨酸和谷氨酸反应后生成的红色素色价无显著差异,分别为(4.0±0.1)U/mL和(3.8±0.1)U/mL,表明体外半合成反应可克服发酵时某些氨基酸作为不良氮源引起的发酵效率低下问题。
3 结论
低pH值条件下的两步发酵法,不仅利于红曲菌的生长,而且能高效率地积累以红斑红曲素和红曲玉红素为主要成分的红曲橙色素,产量达(7.9±0.2)×104U/L。利用橙色素水溶性差的特点,向提取液中加入水,降低乙醇浓度,可使橙色素结晶析出,且调节水加入的比例,可在保证较高得率的同时,提高橙色素纯度。本研究通过向70%的乙醇提取液中加入0.5倍体积的水进行橙色素结晶分离,每升发酵培养基可获得(0.63±0.04)g高纯度橙色素晶体,未检出桔霉素,安全性高。利用所制备的高纯度橙色素,与色氨酸和谷氨酸在体外进行了亲氨基反应,成功获得了色氨酸和谷氨酸衍生红曲红色素,且橙色素向2种衍生红曲红色素的转化率无显著差异,1.0 mg红曲橙色素在10 mL反应体系中,生成的红色素色价分别为(4.0±0.1)U/mL和(3.8±0.1)U/mL。该红曲橙色素的发酵制备及体外半合成红曲红色素的方法,既可克服发酵时某些氨基酸引起的桔霉素积累问题,也可解决某些氨基酸作为不良氮源导致的发酵效率低下问题,具有很好的工业推广价值。
