抗传染性支气管炎病毒S1蛋白单克隆抗体的制备与鉴定
2021-03-29李佳楠周景明祁艳华张改平王爱萍
李佳楠,杜 林,周景明,祁艳华,马 强,张改平,王爱萍*
(1.郑州大学生命科学学院,河南郑州 450001;2. 东北林业大学生命科学学院,黑龙江哈尔滨 150040)
传染性支气管炎病毒(Infectious bronchitis virus,IBV)是严重危害家禽业的一种高度传染性病原体,易感染呼吸道,也可引起禽类肾脏和生殖道疾病[1]。IBV是一种单股正链RNA病毒,基因组全长约27 kb,主要编码参与病毒复制的非结构蛋白、3种主要的结构蛋白(S糖蛋白,E蛋白,M蛋白)和参与基因组包装的N蛋白[2]。S糖蛋白由S1和S2亚基组成,S1亚基含有受体结合域,负责病毒附着宿主细胞并能刺激宿主产生中和抗体,因此S1蛋白被认为是最为重要的结构蛋白[3]。由于病毒重组和宿主选择压力使S1蛋白突变较高率[4],导致IBV不断产生变异从而出现新的血清型和基因型[5-6],给鸡传染性支气管炎(Infectious bronchitis,IB)的诊断和预防带来困难。
S1蛋白结构功能复杂,为研究S1蛋白带来一定阻碍,利用基因工程技术获得S1蛋白相对容易。目前,国内外许多学者以杆状病毒、腺病毒和哺乳动物细胞系等真核表达系统成功表达获得了S1蛋白[7-8],但由于表达量低和糖基化不完全等原因不利于S1蛋白的大量获得。邹年莉等[9]截取S1蛋白一段抗原区(81-422aa)进行原核表达,并制备了抗IBV S1蛋白的单克隆抗体。本研究通过分析S1蛋白的结构,选择抗原性高、亲水性好且包含潜在受体结合位点的一段抗原区(241-414aa)进行表达,获得重组S1蛋白并制备针对IBV S1蛋白的单克隆抗体,以期为IB的诊断、IBV快速检测方法的建立和S1蛋白结构功能的研究提供材料。
1 材料与方法
1.1 材料
1.1.1 毒株、质粒和细胞 IBV M41毒株购于中国兽医药品监察所,质粒pET-28a,宿主菌BL21(DE3)、DH5α和SP2/0细胞为郑州大学分子免疫学实验室保存。
1.1.2 主要试剂BamHⅠ、XholⅠ限制性内切酶为NEB公司产品;TaqDNA聚合酶、T4 DNA连接酶等为Takara公司产品;Goat Anti-mouse IgG/HRP、Goat Anti-Chiken IgG/HRP为北京博奥森生物科技公司产品。
1.1.3 主要仪器 PCR仪(C1000TM)为美国Bio-Rad公司产品;分析天平(TP-214)为美国Denver公司产品;酶标仪(imarkTM)为美国Bio-Rad公司产品;分光光度计(NanoDrop 2000c)为美国 Thermo 公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank上公布的IBV M41毒株(登录号:AY561711.1)S1基因序列(241-414aa)设计引物S1-F和S1-R,分别在上游引物和下游引物5′端引入BamHⅠ和XholⅠ限制性酶切位点(下划线部分),S1-F序列:5′-CGCGGATCCAAAGGTGTTTATTCAGGTG-3′,S1-R序列:5′-CCGCTCGAGTTATCTAAAACGACGTGTT-3′,引物由上海生工生物工程有限公司合成。
1.2.2 RT-PCR扩增S1基因 无菌提取病毒总RNA,反转录为cDNA,以cDNA为模板进行目的基因S1的扩增,PCR扩增程序为:98℃ 10 s;55℃ 30 s;72℃ 30 s;共30个循环,72℃ 10 min。PCR产物用10 g/L琼脂糖凝胶进行鉴定并纯化回收。
1.2.3 重组原核表达载体的构建 将S1基因与pET-28a载体分别用BamHⅠ和XholⅠ进行双酶切并纯化回收,连接后转化DH5α,挑取单菌落扩大培养后进行菌液PCR验证,并送公司测序。
1.2.4 重组S1蛋白的诱导表达 用测序结果正确的质粒转化BL21(DE3)感受态细胞中,并采用菌液PCR和双酶切方法进行鉴定。将鉴定正确的菌液在LB培养基中37℃培养至OD600nm值达0.6~0.8时,加入1 mmol/L IPTG进行诱导表达。
1.2.5 重组S1蛋白表达形式分析 将诱导表达的菌液4℃、6 000 r/min离心10 min,去掉培养基,用 1×PBS溶液重悬菌体。超声破碎15 min,4℃、12 000 r/min离心20 min,分离上清和沉淀进行SDS-PAGE分析。
1.2.6 重组S1蛋白纯化 将超声破碎离心后沉淀用0.1倍体积的含有100 mmol/L EDTA和100 ml/L TritonX-100、pH 7.5的Tris-HCl重悬。离心弃上清,沉淀用20 g/L十二烷基肌氨酸钠溶解,室温孵育15 min,用pH 8.5的1 mol/L Tris-HCl进行透析复性。
1.2.7 重组S1蛋白Western blot鉴定 将纯化的重组S1蛋白进行SDS-PAGE后,电转到硝酸纤维素膜上,用50 g/L脱脂奶粉37℃封闭2 h,PBS'T洗膜3次,加入抗IBV M41毒株鸡阳性血清室温孵育1 h,PBS'T洗膜3次,加入1∶5 000稀释的羊抗鸡IgG/HRP,室温孵育1 h,PBS'T洗膜5次,AEC显色液进行显色观察。
1.2.8 小鼠免疫 用Bradford蛋白浓度测定试剂盒测定重组S1蛋白浓度,每只小鼠免疫30 μg重组蛋白,每2周免疫1次,共免疫3次,细胞融合前3 d天进行加强免疫。
1.2.9 细胞融合与单克隆抗体的筛选 取血清效价高的小鼠脾细胞进行融合,并采用有限稀释法进行3~4轮亚克隆,通过间接ELISA方法对杂交瘤细胞进行筛选,小鼠体内诱生腹水并用辛酸-硫酸铵方法进行腹水纯化。
1.2.10 单克隆抗效价及亲和力测定 以重组S1蛋白为包被原,采用间接ELISA方法测定纯化后腹水单抗效价,并根据以下方法计算单抗亲和力:Kaff=(n-1)/2(n[Ab′]t-[Ab]t),其中,n=[Ag]t/[Ag′]t,[Ag]t、[Ag′]t分别代表2个不同包被浓度,[Ab′]t、[Ab]t分别代表各包被浓度下50% OD450nm值所对应的摩尔浓度。
1.2.11 免疫过氧化物酶单层细胞试验(IPMA) 将原代鸡胚肾细胞培养至80%~90%融合度,接种IBV M41毒株,继续培养48 h,将细胞进行固定,加入单克隆抗体或者阳性鸡血清于37℃孵育1 h,PBS洗3次,再加入羊抗鼠-HRP或羊抗鸡-HRP室温孵育1 h,PBS洗5次,AEC显色液进行显色并在显微镜下观察。
2 结果
2.1 S1基因的扩增
以IBV M41毒株的cDNA为模板,S1-F、S1-R为引物,对目的基因S1进行PCR扩增,扩增出大小为519 bp的单一条带(图1),该条带符合预期目的基因S1条带大小。

1.DNA标准DL 2 000; 2.S1基因; 3.NC1.DNA Marker DL 2 000; 2.S1 gene; 3.NC
2.2 pET-28a-S1重组载体的鉴定
提取重组质粒并用作模板,用T7通用型引物进行菌液PCR,扩增出大小为750 bp的条带(图2),与预期条带大小一致。
1.DNA标准DL 2 000; 2~4.重组载体; 5.NC1.DNA Marker DL 2 000; 2-4.Recombinant plasmid; 5.NC
2.3 重组S1蛋白的表达和表达形式分析
对超声破碎后的上清和沉淀进行SDS-PAGE分析,与空载菌相比较,重组菌诱导后在约20 ku位置出现重组S1蛋白,与预期大小一致;重组S1蛋白主要以包涵体形式表达(图3)。
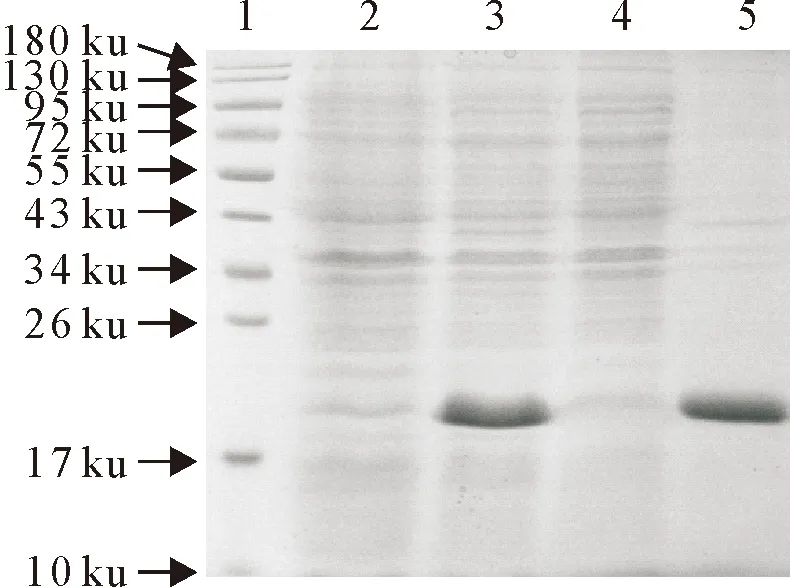
1.蛋白分子质量标准; 2.诱导前;3.诱导后;4.超声上清;5.超声沉淀;
2.4 重组S1蛋白的纯化及Western blot鉴定
S1蛋白经变性-复性过程后,以可溶形式存在(图4),经Western blot鉴定,可见表达的S1蛋白可与阳性血清反应(图5)。

1.蛋白分子质量标准; 2~3.复性后S1蛋白1.Protein molecular weight Marker; 2-3.S1 protein

1.蛋白分子质量标准; 2.重组S1蛋白1.Protein molecular weight Marker; 2.Recombinant S1 protein
2.5 单克隆抗体的鉴定
经3次亚克隆后,筛选出能稳定分泌抗IBV S1蛋白单克隆抗体的3D9细胞株,通过小鼠体内诱生腹水并纯化单克隆抗体,用间接ELISA方法测得纯化腹水中单克隆抗体效价可达1∶2.56×105(图6),计算单克隆抗体的亲和力为2.01×109L/mol。
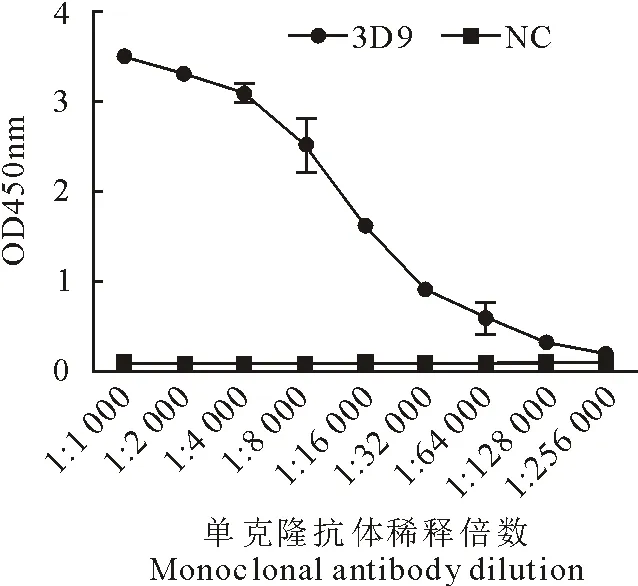
图6 单克隆抗体效价图
2.6 免疫过氧化物酶单层细胞试验
IPMA结果显示,阳性鸡血清和单克隆抗体3D9均可以与IBV M41毒株反应(图7),表明单抗3D9可以用来检测IBV。
3 讨论
S1蛋白位于IBV粒子的表面,是所有结构蛋白中最重要的抗原蛋白[10],不仅能诱导血凝抑制抗体和中和抗体的产生,还可以引起细胞毒性T细胞的免疫应答反应[11-12]。用原核表达系统将S1基因分为A(N端)、B(C端)两段分别进行表达,结果表明C末端的免疫原性高于N端。S1蛋白上有6个抗原决定簇(S1A-S1F),其中一个为291-398aa(S1ABC),其可以诱导宿主产生中和性抗体。将S1蛋白分为N端(S1-NTD:21-237aa)和C端(S1-CTD:269-414aa)分别进行研究,结果表明S1 C端上存在受体结合位点[13]。本研究根据S1蛋白的抗原性、亲水性、抗原决定簇以及文献报道,确定将S1蛋白C端的抗原区进行表达,表达量较高并且重组S1蛋白不含较大标签。融合蛋白以包涵体形式存在,这可能与S1基因内含有许多大肠埃希氏菌的稀有密码子有关,也与S1蛋白本身存在许多疏水区有关。纯化S1蛋白用N-十二烷基肌氨酸钠进行溶解后再复性,重组S1蛋白损失较少且复性完全从而获得重组S1蛋白,此方法简单易操作、耗时短且节约成本。纯化S1蛋白先选用尿素进行变复性,但蛋白损失严重且复性不完全,用N-十二烷基肌氨酸钠进行溶解从而获得重组S1蛋白,此方法简单易操作、耗时短且节约成本。在筛选单抗时,采用间接ELISA方法确定阳性杂交瘤细胞,重组S1蛋白为包被原并用其他无关蛋白做阴性对照,既方便快捷又尽可能排除非特异性反应。

图7 抗IBV单克隆抗体的IPMA检测结果(100×)
本研究成功获得了重组IBV S1蛋白并制备了抗IBV M41 S1蛋白的单克隆抗体,IPMA结果表明,制备的单抗可与IBV结合,为IB的诊断和IBV快速检测方法的建立奠定了基础。
