同时性多原发癌伴肝转移1例并文献复习
2021-03-28白银银许新新路玲干惠珠
白银银 许新新 路玲 干惠珠
作者单位:130033 长春 吉林大学中日联谊医院1血液肿瘤科,2呼吸科
多原发癌(multiple primary carcinoma,MPC),又称复合癌、重复癌,是指同一个体同时或相继发生两种或两种以上彼此相互独立的原发性癌,按发生时间间隔又可分为同时性多原发癌和异时性多原发癌。MPC的发生率为2%~17%,多为实体瘤,同时涉及血液系统肿瘤与实体瘤的MPC罕见。本文报道1例多发性骨髓瘤(multiple myeloma,MM)同时合并结肠癌,分析其特点及治疗方案,以期提高对该病的诊治水平。
1 临床资料
患者,男性,59岁,因头晕、乏力1个月于2017年5月18日就诊于吉林大学中日联谊医院血液肿瘤科。入院时实验室检查:血红蛋白为50 g/L,网织红细胞百分比为2.32%;肝功能检查示球蛋白78.37 g/L,白蛋白22.59 g/L;粪便潜血检查(++);肾功能检查、离子四项及肿瘤标志物检查等均未见明显异常。进一步查血清免疫球蛋IgG为63.3 g/L,IgA为0.12 g/L,IgM 为 0.13 g/L;β2 微球蛋白为 3 932 μg/L;免疫固定电泳示IgG-κ型。骨髓象可见浆细胞明显增多,以幼稚浆细胞为主,有核细胞占38.5%,提示MM(图1)。荧光原位杂交检测(FISH)示14q32 IgH基因重排阳性,其余基因重排均阴性(图2)。腹部CT可见升结肠占位,肿瘤性病变可能性大;肝脏未见明显异常。肠镜示升结肠中段见溃疡性病变(图3),镜下病理活检示中分化腺癌。全身骨核素扫描未见典型多发骨转移及溶骨性改变。根据病史及临床资料明确诊断为MM(IgG-κISS分期Ⅱ期)及结肠癌。给予VTD方案(硼替佐米+地塞米松+沙利度胺)化疗2个周期后血象接近正常,复查腹部CT较前无明显变化。于2017年8月7日行右半结肠癌切除术及周围淋巴结清扫术,术后病理学检查为右半结肠、部分小肠及阑尾中分化腺癌,侵及肠壁全层达肠周脂肪,肠周淋巴结转移,ypTNM:T3N1cMx(图4)。免疫组化示 HER-2(++)、P53(90%)、Ki67(70%)、PMS2(+)、MSH6(+)、MLH1(+)、MSH2(小弱灶+)、CDX-2(+)。术后 4 周复查腹部CT可见肝内多发圆形低密度影,考虑转移瘤可能性大。因患者拒绝行肝组织穿刺活检,给予VTD方案联合XELOX方案(奥沙利铂+卡培他滨)化疗。2017年10月24日行超声引导下肝病损射频消融术,术后继续予以VTD方案联合XELOX方案化疗2个周期,然后复查腹部CT可见肝转移灶较前明显缩小。此后因失访,未能观察长期疗效。

图1 骨髓穿刺图片(HE×1 000)Fig.1 Bone marrow smear(HE×1 000)

图2 骨髓荧光原位杂交结果Fig.2 Fluorescence in situ hybridization detection of bone marrow
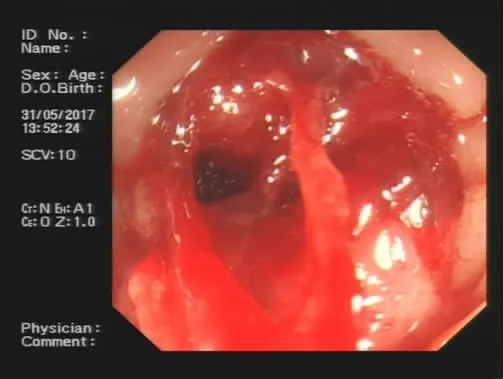
图3 升结肠中段溃疡性病变Fig.3 Ulcerative lesions in the middle part of the ascending colon

图4 升结肠病变组织HE染色结果(HE×1 000)Fig.4 HE staining results of ascending colon lesions(HE×1 000)
2 讨论
目前定义MPC主要遵循国际癌症登记协会(IACR)和国际癌症研究机构(IARC)的制定标准[1-2]:⑴两种或多种原发癌症的存在不依赖于时间;⑵原发癌特指病变源于原发部位并排除扩散、复发等;⑶发生于同一组织或器官的多原发癌应具有明确的组织形态学证据,但值得注意的是累及多脏器的单一肿瘤(如血液系统肿瘤和卡波西肉瘤)不应当作为MPC。IARC建议将原发肿瘤发生时间间隔<6个月称为同时性MPC,>6个月为异时性MPC。MPC发生率为2%~17%,其中累及结肠的MPC发生率为16.9%[3]。平均发病年龄MPC高于单肿瘤患者,同时性癌的发病平均年龄较异时性癌大,其中50岁以上的MPC患者超过75%[4]。目前认为MPC涉及的血液系统肿瘤主要包括MM、骨髓增生异常综合征、非霍奇金淋巴瘤,实体瘤主要发生部位为胃、结肠、乳腺和食管[5]。有研究报道一级亲属患有直肠癌的人群罹患MM的风险增加[6]。也有研究显示MM发病与家族性聚集的大肠癌、乳腺癌、前列腺癌、非甲状腺内分泌肿瘤、白血病等相关,尤其在结直肠癌家族中表现出较强的关联性[7]。本例患者同时确诊MM和结肠癌,符合同时性癌定义,发病年龄为59岁,也符合MPC高发年龄段。
关于MPC发病的机制,既往研究报道MPC发病风险增加的因素可能包括遗传易感性、环境、生活方式暴露(吸烟、饮酒、饮食及肥胖等)、激素水平、免疫缺陷、感染、放化疗副作用等[8]。MM是骨髓浆细胞恶性克隆肿瘤,14q32 IgH基因重排是MM最常见的类型,该区域重排是MM发病机制中的早期分子事件之一,也是骨髓瘤细胞恶性增殖和发展中最重要的标记[9]。国外报道了1例结肠腺癌患者通过聚合酶链式反应显示假阳性克隆性IgH重排[10]。GENG等[11]也发现所有类型的IgH均在结肠上皮细胞中表达,而结肠癌细胞主要表达IgG。以上研究提示IgG可能与结肠癌进展密切相关。本例患者FISH检测同样显示14q32 IgH基因重排阳性,因此推测IgG可能是导致本例患者MM和结肠癌同时发病的重要原因,但仍有待进一步探究。伴有以上MPC发病高危因素的人群应尽早监测筛查,以早发现、早诊断、早治疗。
MPC诊断难度大且尚无统一标准,本例患者以贫血为首发症状,行骨髓穿刺后明确MM诊断,若未进一步完善腹部CT,易漏诊结肠癌;术后1个月发现肝占位时需思考肝原发癌还是其他部位肿瘤转移,需进一步病理活检明确。本例患者尤其需注意以下鉴别诊断:⑴鉴别贫血的主次原因。浆细胞瘤浸润可发生于胃肠道的任何部位,最常见部位是小肠,其次是胃、结肠和食管[12]。因此,以消化道症状为首发临床表现的MM需与结肠原发肿瘤鉴别,目前活检仍是确诊的主要手段。本例患者以贫血为首发症状,而两种原发癌均可导致贫血,鉴于浆细胞恶性克隆增殖可直接抑制骨髓造血,且结肠癌需长期慢性失血才可导致严重贫血,因此考虑MM为引起贫血的主要原因。鉴别贫血的主次原因至关重要,对后续治疗方案的选择及其顺序影响重大。⑵鉴别转移或新发肿瘤来源。本例患者术后1个月发现肝占位,因拒绝病理检查,鉴于约75%的结肠癌患者有肝转移倾向,在结合影像学表现基础上考虑结肠癌肝转移可能性大。但鉴于髓外浆细胞瘤最常见的受累部位是肝脏、肾脏和中枢神经系统[13],因此仍不能忽视原发性肝癌或髓外浆细胞瘤可能性。此外,对于有癌症病史及潜在抗癌治疗的MPC患者,鉴别新发肿瘤来源对后续的管理治疗策略同样有重大影响,新发肿瘤可能来自第一原发癌转移,也可能为第二种原发癌的一部分。
对于MPC治疗目前亦尚无标准方案,相关文献中只有病例报告,且此类患者绝大多数被排除在涉及新疗法的临床试验之外。治疗手段主要包括手术切除、放疗、化疗[14],大部分患者在选择治疗时需经多学科小组会议讨论,尤其是血液系统肿瘤合并实体肿瘤,应更多从年龄、病理类型、肿瘤标志物水平、肿瘤侵犯程度及有无基因突变等角度考虑,详细评估患者实际情况及肿瘤分期等制定治疗方案。本例患者以重度贫血为首发症状,临床表现并不明显,综合考虑下首先选用一线VTD方案治疗MM,贫血改善及骨髓负荷减轻后行结肠癌手术切除及XELOX方案术后辅助化疗,并对随后发生的肝占位行射频消融治疗,与PANTOJA等[15]依据具体情况制定血液肿瘤合并实体瘤的最佳化疗顺序理念一致。值得注意的是,结直肠癌患者一线化疗方案FOLFOX-4急性神经毒性发生率与XELOX方案相似,但就神经毒性累积量而言,两种方案累积剂量相当,但FOLFOX-4方案可能较XELOX方案更具神经毒性[16]。沙利度胺经常导致感觉运动性轴索神经病,而硼替佐米则主要导致感觉神经病,在评估硼替佐米与沙利度胺联合使用的试验中,3~4级神经毒性的发生率相对较低,可能归因于沙利度胺的抗炎作用对硼替佐米具有保护作用,此外,一些接受来那度胺挽救化疗患者的神经毒性症状也显著改善[17]。尽管硼替佐米、沙利度胺、奥沙利铂在临床试验中均报道可导致神经毒性,但本例患者通过适当降低药物剂量、延长给药时间、改变给药方式、给予营养神经药物等措施有效减轻了联合化疗方案引起的毒性。此外,患者术后病理提示结肠癌细胞退行性病变,符合骨髓瘤治疗后反应,考虑可能原因是硼替佐米作为蛋白酶体抑制剂,有效抑制了实体瘤细胞内的组成型蛋白酶体[18],提示同一种抗肿瘤药物或方案可能对两种肿瘤都发挥积极意义,这也为MPC治疗提供了新的思路。此外,针对结肠癌及MM靶向治疗的一系列临床试验正在开展,有望改变MPC治疗模式。
综上所述,同时性MM和结肠癌伴肝转移罕见,涉及的肿瘤间相互独立,但往往会出现相同的临床表现,容易掩饰另一原发癌,在临床工作中应详细询问病史,全面完善辅助检查,防止误诊、漏诊。明确诊断后应经多学科小组会议讨论,详细评估患者实际情况及肿瘤分期等制定最佳治疗方案,让患者最大获益。
