基于液质联用的人血清代谢组学样品前处理方法研究
2021-03-28李倩倩任冠桦叶春华吴龙俊宇黎远冬张春燕
李倩倩 任冠桦 叶春华 吴龙俊宇 黎远冬 张春燕
作者单位:530021 南宁 广西医科大学附属肿瘤医院实验研究部
代谢组学是系统生物学的重要组成部分,研究对象主要包括生物体液、细胞或组织、植物和相关样品中的低分子量代谢物(相对分子量<1 000 Da),这些代谢物能准确、灵敏地反映生物体系的整体功能状态[1-2]。血清是代谢组学研究中的重要体液样本之一,含有多种内源性代谢产物[3],且获取方式简便、成本低廉[4-10]。在基于液质联用的血清代谢组学分析中,样品前处理是影响分析结果质量的重要环节[11],但目前尚缺乏理想的血清代谢组学前处理方法。本研究基于超高效液相色谱-四级杆飞行时间串联质谱联用(ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-QTOF-MS)技术建立血清代谢组学样品前处理方法,为血清样品前处理提供新方法。
1 材料与方法
1.1 主要材料与仪器
收集于广西医科大学附属肿瘤医院就诊的200例患者晨起空腹抽取的血液标本,于室温下静置30 min,4 000 r/min离心10 min,每份取10 μL上清液充分混匀,置于-80℃下冷冻保存待用。所有血液样本均为实验前2 d收集。
超高效液相色谱仪、SCIEX X500R四级飞行时间串联质谱仪为美国SCIEX公司产品;ACQUITY BEH C18色谱柱(2.1 mm×100.0 mm,1.7 μm)为 Waters 公司产品,乙腈、甲酸(色谱纯)为Merck公司产品,Amicon Ultra-0.5超滤离心管(截留分子量3 000 Da)为美国Merck millipore公司产品,真空离心浓缩仪为德国Eppendorf公司产品;实验超纯水为本中心自制。
1.2 色谱条件
ACQUITY BEH C18色谱柱(2.1 mm×100.0 mm,1.7 μm);流动相:0.1% 甲酸水溶液(A)-0.1%甲酸乙腈溶液(B);线性梯度洗脱(0~9 min:B 2%→45%;9~15 min:B 45%→100%;15~18 min:B 100%;18~20 min:B 100%→2%;20~23 min:B 2%)。进样前色谱柱在初始流动相条件下平衡15 min,流速0.4 mL/min,柱温40℃,进样量10 μL。
1.3 质谱条件
电喷雾离子源分别采用ESI+和ESI-扫描模式,喷雾电压分别为5 500 V和-4 500 V,源温度500℃,雾化气压50 MPa,干燥气压50 MPa,气帘气35 MPa。MS 扫描范围为质荷比(m/z)100~1 250,碰撞能为 10 eV;MS/MS扫描范围为m/z 50~1 000,碰撞能为(35±15)eV。扫描过程中动态扣除背景离子。
1.4 样品前处理方法
混和血清样品于室温下解冻,分别取100 μL血清转移至15个1.5 mL的EP管,并按照不同处理方法分为3组,每组5个。
血清样品经三倍乙腈沉淀处理(方法一):每个样品分别加入300 μL乙腈,涡旋混匀30 s,于-20℃下冷冻沉淀蛋白1 h,然后以15 000 r/min离心15 min,取上清液至进样瓶中。
血清样品经三倍乙腈沉淀后再通过浓缩复溶方式处理(方法二):每个样品分别加入300 μL乙腈,涡旋混匀30 s,于-20℃下冷冻沉淀蛋白1 h,以15 000 r/min离心15 min,转移上清液至1.5 mL EP管中,用真空离心浓缩仪在室温下浓缩4 h至干,再用 100 μL 乙腈:水(1∶1)复溶,涡旋混匀 30 s,再以15 000 r/min离心15 min,转移上清液至进样瓶中。
血清样品经一倍乙腈沉淀后再通过超滤管截留大分子方式处理(方法三):每个样品分别加入100 μL的乙腈,涡旋混匀30 s,于-20℃下冷冻沉淀蛋白1 h,以15 000 r/min离心15 min,取上清液至Amicon Ultra-0.5超滤离心管中,15 000 r/min离心15 min,截留分子量≥3 000 Da的分子,取离心管内液体至进样瓶中。
3组血清样品经上述方法处理后,15个样本分别取 10 μL 配成质控(quality control,QC)样品,每 5 个样品穿插1个QC样品进样,分析仪器的精密度、稳定性及重复性。
1.5 数据处理及分析
数据采集使用SCIEC OS系统。采用数据格式转换软件MSConvert将采集的原始数据(wiff格式)转换成为XCMS可识别的mzXML格式文件,并导入数据处理软件XCMS进行峰的识别、对齐及过滤,最终获得包括 m/z、保留时间(retention time,RT)及其峰强度的二维数据矩阵。在ESI+和ESI-两种模式下,分别按照时间顺序在色谱图中随机选取10个离子峰,根据XCMS软件处理后得到的峰强度矩阵图,分别计算每种方法5个样品的峰强度均值,再根据稀释倍数,计算各方法前处理后每10 μL血清中所测的10个离子峰峰强度及其变异系数(coefficient of variation,CV)。
1.6 统计学方法
采用IBM SPSS Statistics 23软件对数据进行统计分析。3种前处理方法所测峰强度以均值表示,多组间比较采用随机区组的单因素方差分析,若组间差异有统计学意义,进一步的两两比较采用Bonferroni检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同血清前处理方法提取的代谢物特征总数
ESI+和ESI-扫描模式下获得的液质联用原始谱图数据经格式转化及XCMS软件进行预处理后,结果显示,在ESI+模式下,方法二可检测到最多的代谢物特征数(12 801个),方法三(8 502个)次之;ESI-模式下,方法二和方法三所检测的代谢物特征数接近,分别为5 889个、5 528个;而方法一在ESI+和ESI-扫描模式下所检测的代谢物特征数均最少,分别为7 896个、3 980个。
2.2 不同血清前处理方法所测代谢物的峰强度
ESI+和ESI-扫描模式下,方法二和方法三进行前处理后,大部分离子峰的峰强度CV值<25.00%,而方法一中大部分离子峰的峰强度CV值>25.00%,见表1和表2,说明方法二和方法三对血清中代谢物提取的重复性较好。3种前处理方法在ESI+和ESI-扫描模式下测得离子峰的峰强度均值比较差异均具有统计学意义(均P<0.05),其中方法一与方法三比较差异无统计学意义(P>0.05),但均大于方法二(均P<0.05);方法三的血清样品离子基峰图见图1。以上结果表明,方法三更适于需要大样本分析的血清代谢组学研究。

图1 ESI+/ESI-扫描模式下检测得到的血清样品离子基峰图Fig.1 Chromatogram of serum sample ion base peaks detected in ESI+/ESI-scan modes
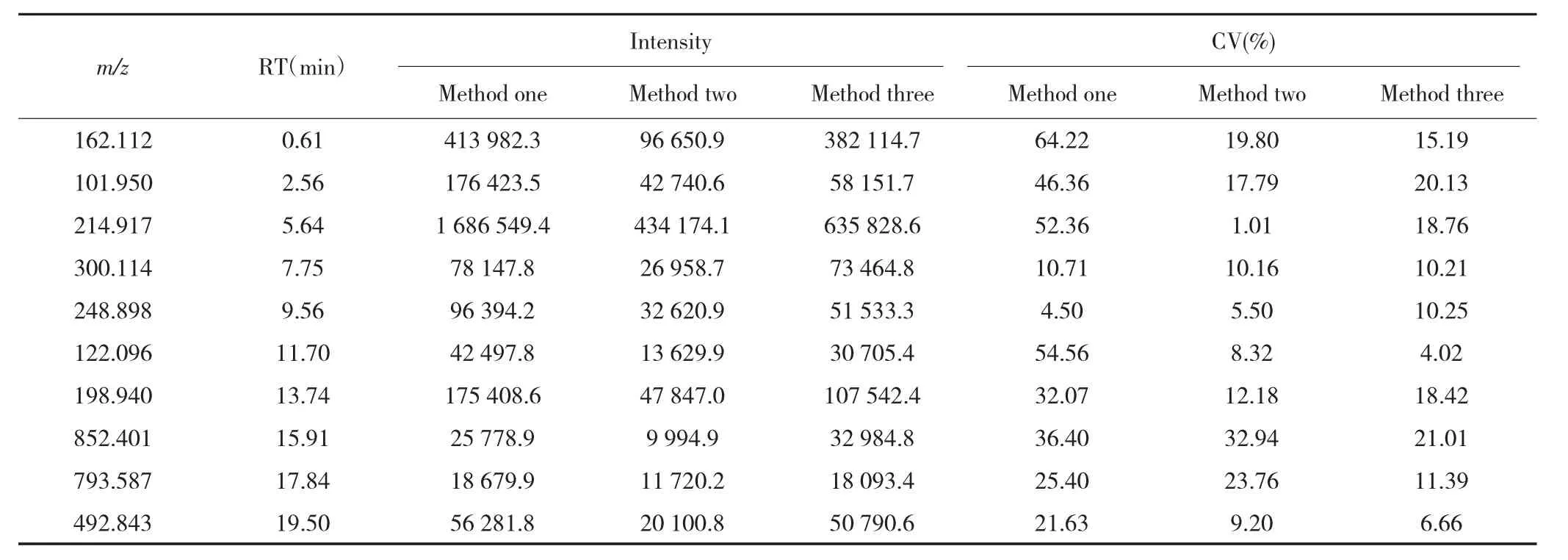
表1 ESI+扫描模式下3种前处理方法测得的峰强度及CV值Tab.1 Peak intensity and CV measured by three pre-processing methods in ESI+scan mode
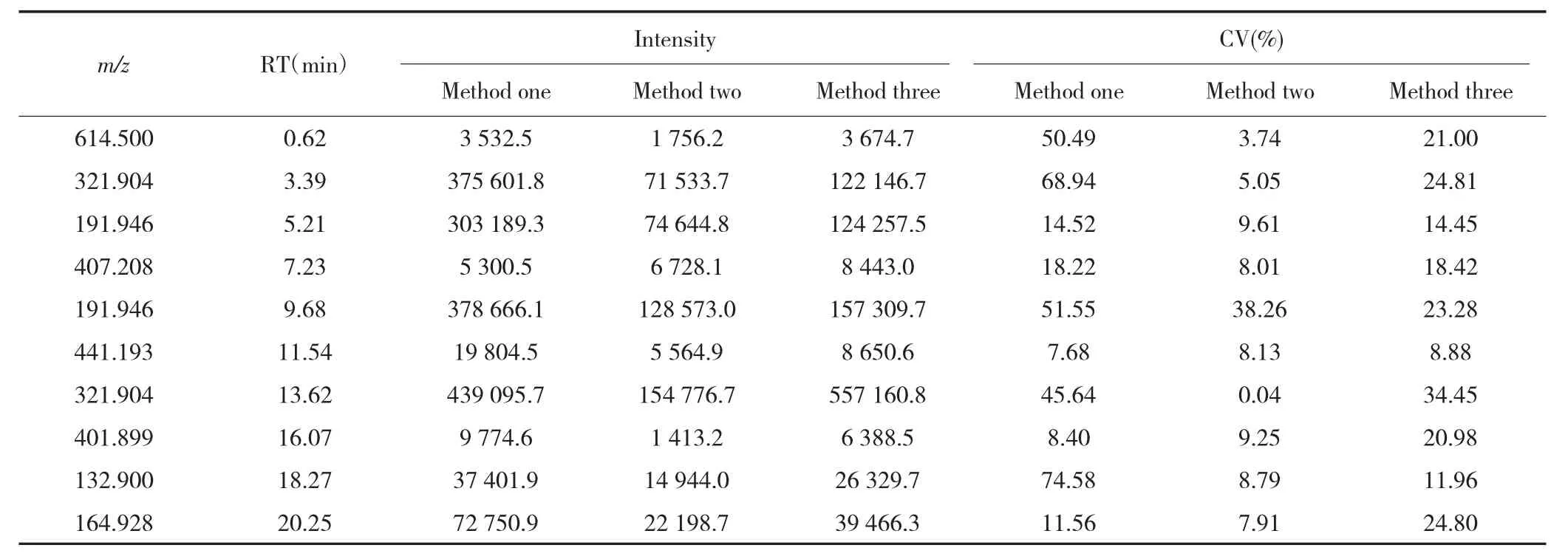
表2 ESI-扫描模式下3种前处理方法测得的峰强度及CV值Tab.2 Peak intensity and CV measured by three pre-processing methods in ESI-scan mode
2.3 仪器的精密度、稳定性及重复性考察
在ESI+和ESI-扫描模式下,分别叠加QC样品3次进样的总离子流色谱图,结果显示叠加效果均较好,见图2。分别在QC样品色谱图的前、中、后随机共选取10个离子峰的提取离子色谱图进行分析,结果显示RT的偏差均<0.1 min且其CV值均≤1.00%,各峰面积和峰强度的CV值均<25.00%,见表3~4。以上结果表明本研究样品分析过程中仪器的精密度、稳定性及重复性均较好,满足分析要求。
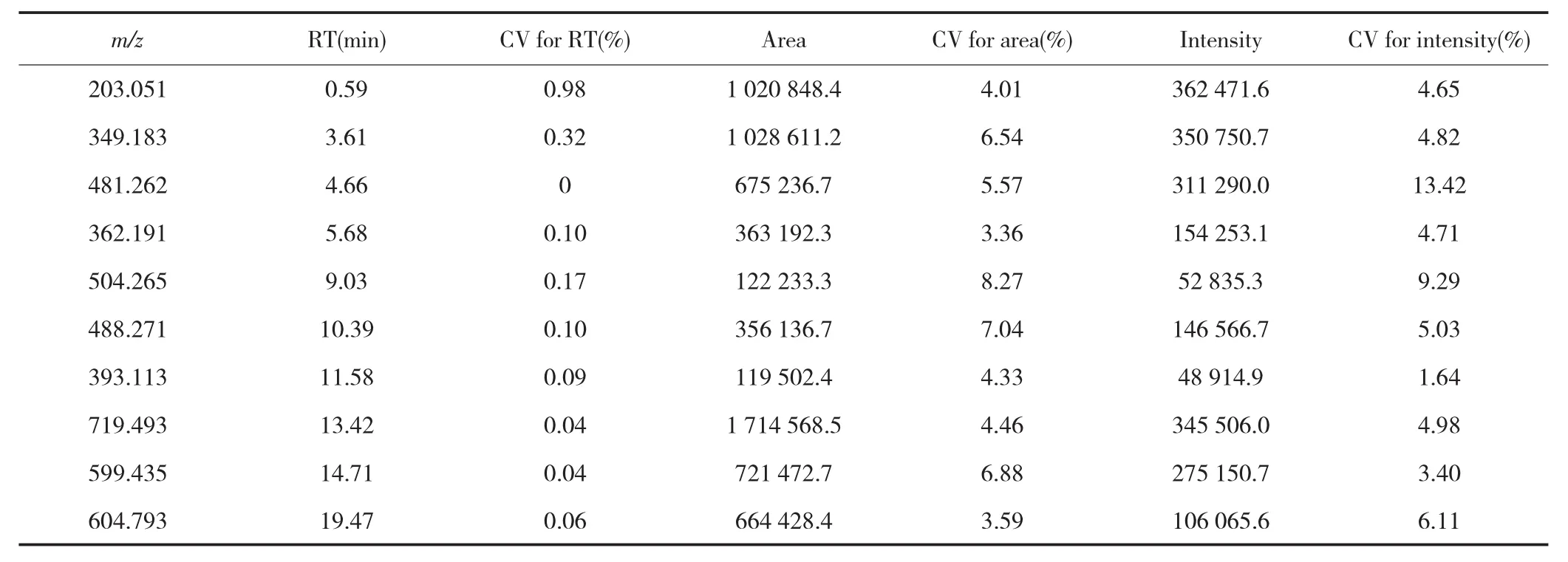
表3 ESI+扫描模式下QC样品考察结果Tab.3 Investigation results of QC samples in ESI+scan mode
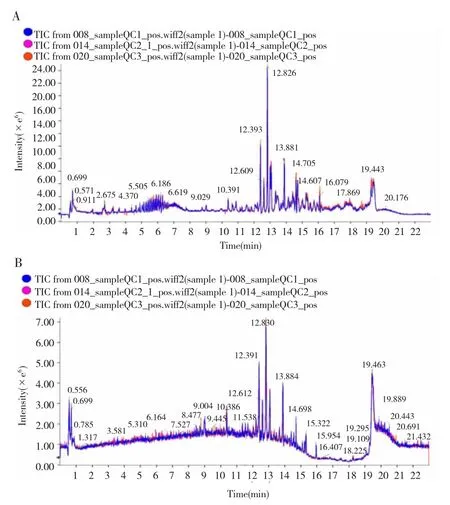
图2 ESI+/ESI-扫描模式下QC样品3次进样的总离子流色谱图的叠加情况Fig.2 The stack of total ion current chromatograms of three injections of QC samples in ESI+/ESI-scan modes
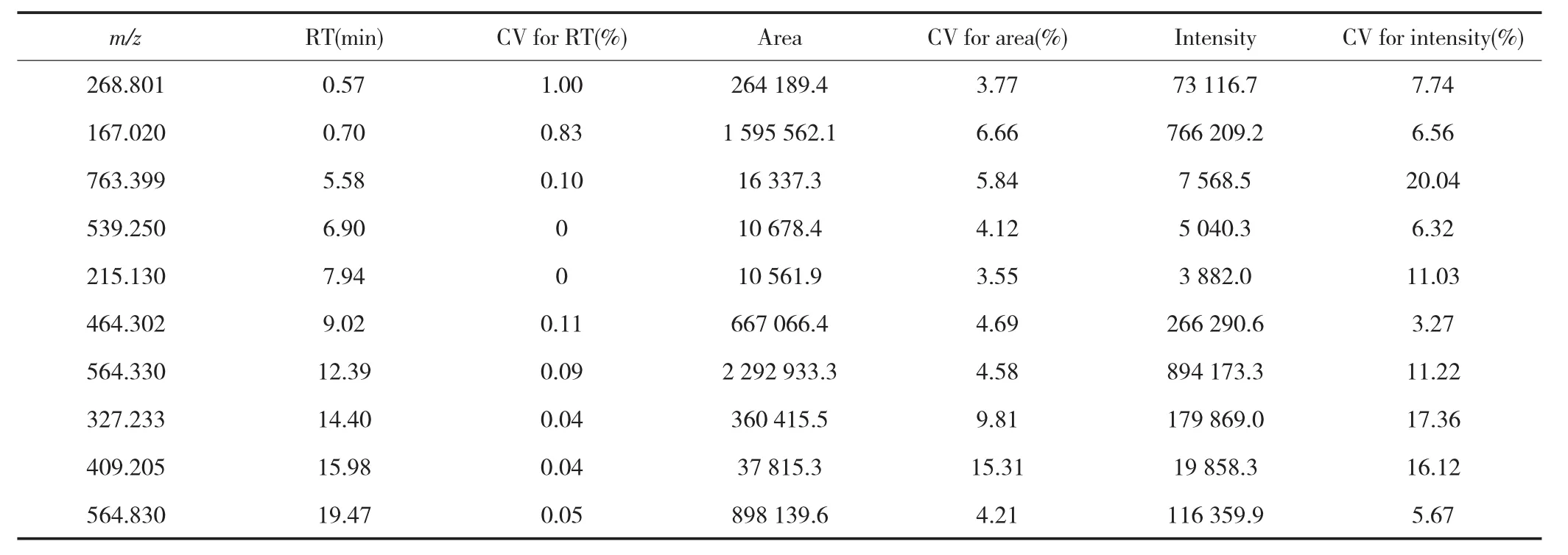
表4 ESI-扫描模式下QC样品考察结果Tab.4 Investigation results of QC samples in ESI-scan mode
3 讨论
在基于液质联用的代谢组学分析中,去蛋白是人血清样品前处理的关键,研究表明蛋白质的存在对色谱柱寿命造成很大的影响,且对含量较低的代谢物的质谱产生一定的干扰[12],因此在进行代谢组学分析前需要进行去蛋白处理。目前血清样品前处理常用的一种方法是有机溶剂沉淀蛋白质[13-15],另一种方法是血清样品经有机溶剂沉淀蛋白质后再进行浓缩复溶[16-18],前者操作简便但可能沉淀蛋白不完全,而后者则操作繁琐且耗时。本研究对3种不同的血清样品前处理方法进行对比分析,发现单纯三倍乙腈沉淀蛋白的处理方式简便耗时短,测得的化合物峰强度亦较高,但该法对代谢物提取的重复性较差;同时可能由于稀释的原因导致一些含量较低的代谢物不易被检测到,该法测得的代谢物特征总数较少。三倍乙腈沉淀后再通过浓缩复溶处理所提取的代谢物特征总数稍多且提取代谢物的重复性较好,但处理方式复杂且耗时;同时真空浓缩干燥过程中可能导致一些易挥发代谢物丢失,故该法所测得的代谢物峰强度偏低。一倍乙腈沉淀后再通过超滤管截留大分子的处理方式简便且耗时短,既能保证测得的代谢物的总量,又能保证测得的代谢物的峰强度,且代谢物提取的重复性较好,说明该法更适于需要大样本分析的血清代谢组学研究。为排除样品分析过程中仪器对检测结果的干扰,本研究同时采用穿插在检测序列中的QC样本对分析系统的稳定性进行论证,结果精密度、稳定性及重复性均较好,满足分析要求。说明本研究测试样本之间的差别主要来自于样本中提取的代谢物差异,不是来自分析方法误差,证明在代谢组学研究中发现的差异代谢物可靠。
综上所述,本研究利用一倍乙腈沉淀蛋白后再通过超滤管截留大分子建立的血清样本前处理方操作简便,重复性好,能够更全面保留和检测到血清样品中的小分子化合物,符合代谢组学的高通量研究的基本要求,适用于大批量样品分析,是一种值得推广的代谢组学血清样品前处理方法。
