大鼠发育期热性惊厥后海马microRNA差异表达谱的相关研究*
2021-03-26徐健李晓东孙明强何小华高振忠
徐健,李晓东,孙明强,何小华,高振忠
[1.潍坊医学院妇幼保健院(潍坊市妇幼保健院),山东 潍坊261011;2.武汉大学 基础医学院,湖北 武汉430071]
热性惊厥在婴儿和儿童中很常见,约占2%,是儿童最常见的神经系统疾病[1]。根据美国儿科学会的定义,热性惊厥是一种无代谢异常或颅内感染,与发热性疾病相关的惊厥,可分为单纯型惊厥和复杂型惊厥[2],与体温达39℃或更高有关。另有研究发现,急性电解质失衡、发育迟缓、病毒感染、有发烧痉挛家族史[3-4],以及铁、锌的缺乏可能是导致热性惊厥的潜在危险因素[5]。临床研究表明,单纯退热治疗对预防热性惊厥复发无效,与苯巴比妥联合使用可有效预防热性惊厥的复发[6]。由于这些药物潜在的毒性已远远超过了儿童热性惊厥造成的危害,因此迫切需要寻找更多新的生物标志物来预测、诊断和治疗热性惊厥。
近年来,随着对非编码RNA 的深入研究,microRNA(miRNA)在神经系统疾病中的作用,尤其是与大脑发育的关系越来越受到重视[7-9]。miRNA属于一个非编码的微小RNA 家族,是一种重要的转录后调控因子,可以抑制mRNA 翻译或直接降解靶mRNA[10]。miRNA 对神经元的正常发育至关重要,与许多神经系统疾病有关,其机制仍有待研究。例如miRNA 在涉及大脑发育和成人神经可塑性的基因调控网络中具有重要作用[9]。miR-124a 和miR-9 能够调节胚胎干细胞向神经元或胶质细胞的分化[11],而脑特异性miR-9 在调节干细胞衍生的神经前体细胞的细胞行为中起关键作用。miRNA 作为一种表观遗传学调控方式,在惊厥、癫痫等神经系统疾病中发挥非常重要的作用。
本研究首先通过经典热水浴诱导惊厥的方法复制反复热性惊厥大鼠模型。随后利用大鼠miRNA表达谱芯片比较分析大鼠发育期反复热性惊厥后海马和健康大鼠海马中差异表达的miRNA,并采用多种生物信息学方法如分级聚类分析、功能分类、基因网络分析、靶基因预测分析等对芯片数据进行深入挖掘和分析,以获取大量生物信息。这些候选的易感miRNA 及潜在的芯片数据信息对研究热性惊厥的发病机制及其与癫痫的发生、发展的关系具有重要的作用,为发现新的热性惊厥临床分子生物靶标提供重要依据。
1 材料与方法
1.1 反复热性惊厥模型的复制
选取10 只SPF 级14 d日龄健康SD 大鼠,通过经典热水浴诱导惊厥,复制热性惊厥动物模型,连续热水浴7 d,按照热性惊厥的5 级行为学评分标准[12],选取热性惊厥行为综合评分最高的3 只SD 大鼠进行miRNA 表达谱基因芯片分析,同时选取3只健康SD 大鼠。实验动物生产许可证号:SCXK(鄂)2014-0012;实验动物使用许可证号:SYXK(鄂)2014-0067。
1.2 实验方法
1.2.1 miRNA 表达谱基因芯片将两组大鼠海马组织样本送至上海康成基因公司,按照安捷伦miRNA 表达谱芯片(大鼠)标准化操作流程进行芯片分析。
1.2.2 差异表达miRNA的筛选从miRNA 表达谱基因芯片中获得标准化数据,首先以随机方差模型和Limma 算法作为差异鉴别方法,以P<0.05,FC>1.5 为差异基因标准,筛选出两组间存在差异表达的miRNA。
1.2.3 miRNA靶基因预测成熟的miRNA 序列均来 自miRBase(http://www.mirbase.org)。分别利用TargetScan(http://www.targetscan.org)和miRDB(http://www.mirdb.org)2 个在线数据库预测miRNA 的潜在靶基因,并取两者的交集作为最终候选靶基因。
1.2.4 差异表达miRNA 靶基因的生物信息分析通过生物信息学对上述筛选的候选靶基因进行GO 功能注释分析。通过计算其P值(Fisher 确切概率法)、富集分数,可获得显著富集的GO 类别。通过GO 功能分析可聚焦具有显著差异的功能集群,筛选并鉴定感兴趣的靶基因与何种基因功能相关[13]。通过联合KEGG 等多种数据库,利用Fisher 精确概率法对候选靶基因的Pathway 进行显著性富集分析。通过信号通路分析可以筛选及鉴定候选靶基因所参与的Pathway,进而研究靶基因与哪些细胞信号通路的改变相关。蛋白相互作用网络分析是利用STRING 数据库结合Cytoscape 软件分析miR-148a-3p 靶基因(蛋白)之间的相互作用关系。
1.2.5 实时荧光定量聚合酶链反应(qRT-PCR)验证基因芯片数据采用qRT-PCR 验证差异表达miRNA。通过提取海马组织总RNA,逆转录获得cDNA,并以此为模板。根据miRNA 序列设计PCR引物,并检测其相对表达量;按照Qiagen 试剂盒说明书进行操作。选取U6基因为内参基因。根据公式2-△△Ct=[Ct(target)-Ct(U6)]A-[Ct(target)-Ct(U6)]B,计算miRNA 相对表达量。引物序列见表1。
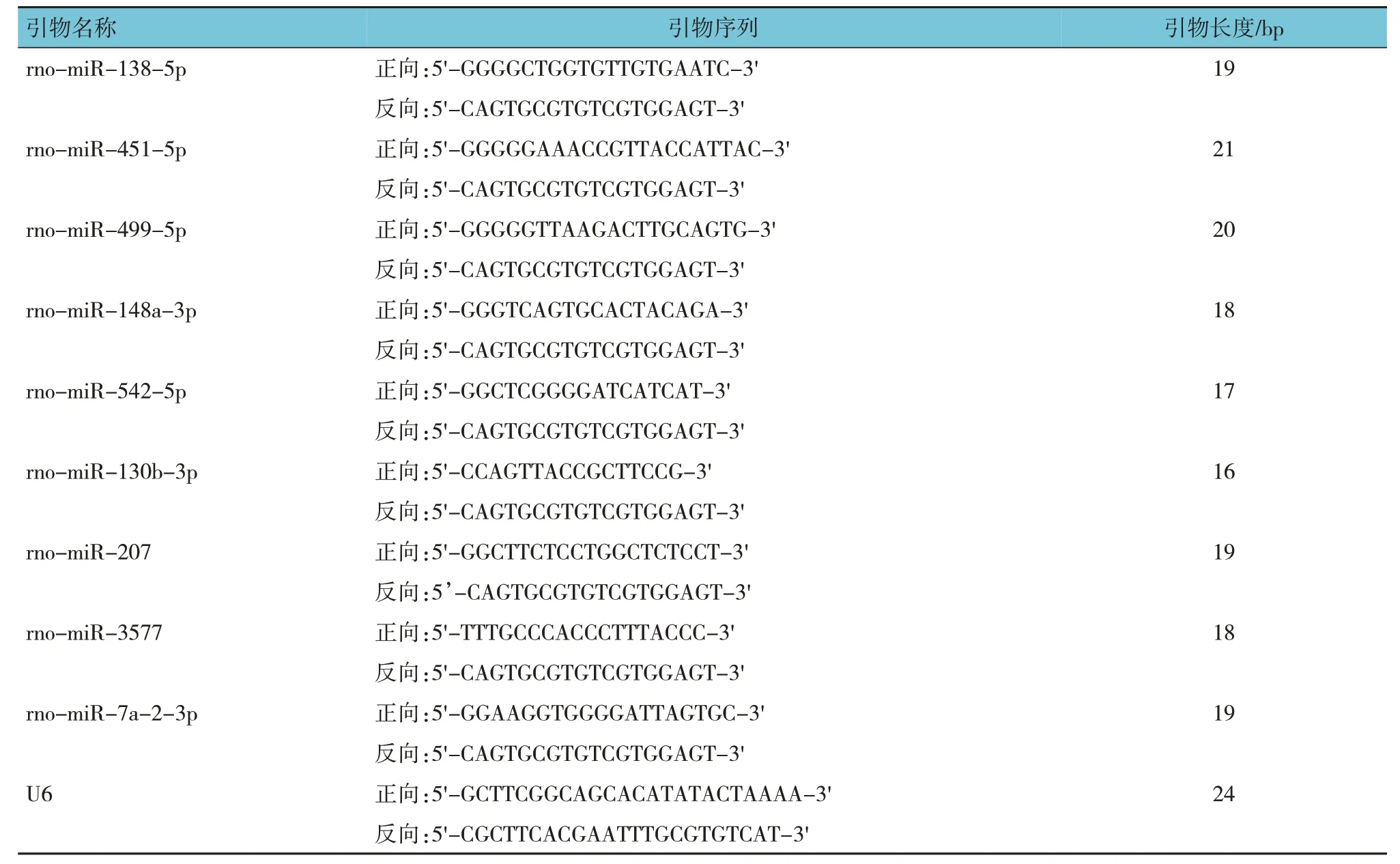
表1 qRT-PCR引物序列
1.3 统计学方法
数据分析采用SPSS 11.0 统计软件。计量资料以均数±标准差(±s)表示,两样本差异分析用t检验,多组间比较用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 差异表达miRNA聚类分析
分级聚类主要根据基因表达谱数据的相似性,利用Pearson 相关系数作为相似性度量,最后将个体样本进行集群分析。经过分级聚类分析,所有实验样本被分为2 个主要的不同集群,符合笔者预期的实验分组结果。以P<0.05,FC >1.5 为筛选标准,筛选获得31个差异表达miRNA,其中包括21个上调miRNA 和10 个下调miRNA(见图1A)。
2.2 qRT-PCR验证差异表达miRNA
为进一步证实基因芯片数据的可靠性,随机挑选9 个差异表达miRNA。结果显示,qRT-PCR 的验证结果与基因芯片的结果相符,证明基因芯片数据可靠(见图1B)。

图1 差异表达miRNA热图和qRT-PCR验证实验
2.3 差异表达miRNA的靶基因GO功能和Path‐way分析
为进一步分析筛选得到的差异表达miRNA 的靶基因的GO 功能,利用miRNA 靶基因预测数据库TargetScan 和miRDB 预测出3 247 个交集靶基因。利用生物信息学方法对靶基因进行GO 功能分类。以P<0.01 为阈值,获得显著差异的GO 功能集群,主要包括基因转录、神经元分化、大脑及海马发育等。见图2。

图2 31个差异表达miRNA的GO功能分析
同时,以P<0.05 为筛选标准,对差异表达基因参与的显著性Pathway 进行分析。获得具有显著差异的TOP 10 信号通路,主要包括:显著富集的Pathway 主要包括癌症相关、FoxO信号通路、PI3K/Akt信号通路、多巴胺突触通路等,这些信号通路均与癫痫等神经系统疾病的发病机制密切相关。见图3。

图3 31个差异表达miRNA信号通路分析
2.4 miR-148a-3p靶基因预测分析
根据生物信息及文献检索分析,笔者选定miR-148a-3p 作为候选易感miRNA 进行后续研究。首先通过miRNA 靶基因预测数据库TargetScan 和miRDB 进行靶基因预测筛选,共获得186个靶基因,其中120 个靶基因(红色)参与神经、免疫、表观遗传等功能,其是惊厥、癫痫等的重要影响因素。见图4。
2.5 miR-148a-3p靶基因GO功能和Pathway分析
为进一步分析筛选得到的miR-148a-3p 靶基因的GO 功能,利用miRNA 靶基因预测数据库TargetScan 和miRDB 共预测186 个交集靶基因(见图4)。结合AmiGO 多个数据库的信息对186 个靶基因进行GO 功能分析。以P<0.05 为阈值,获得具有显著差异GO 功能分类,包括神经元生成及分化、大脑发育、转化生长因子结合、组蛋白修饰等多种与神经、免疫及表观遗传相关的功能,这些因素与惊厥及癫痫有着非常密切的联系(见图5A~C)。

图4 miR-148a-3p靶基因预测结果
同时,以P<0.05 为阈值,对186 个靶基因所参与的显著性Pathway 进行分析,获得具有显著差异的TOP 10 信号通路,主要包括:FoxO信号通路、PI3K-Akt信号通路、TGF-β信号通路、Hippo信号通路等,这些信号通路都与惊厥和癫痫疾病的发病机制密切相关。见图5D。
2.6 miR-148a-3p 靶基因的蛋白相互作用网络分析
通常情况下,基因不是单独起作用,而是多个基因形成相互作用的复杂的分子网络从而控制机体的生物进程。为进一步探索靶基因之间的网络关系,笔者选取186 个交集靶基因,利用STRING 数据库进行靶基因蛋白相互作用分析,结果表明分子网络中红颜色的基因(Ube2d1、Ube2d2、Ube3b、Skp1、Fbxl19、Ccnf、Smurf2)位于网络结构的中心,被认为是在该网络中起关键调控作用的基因。见图6。
2.7 miR-148a-3p的靶基因NCOA1
通过生物信息分析及文献搜索,笔者发现NCOA1的功能与神经、免疫系统有着密切的联系,因此确定NCOA1作为候选靶基因进行验证。通过TargetScan 数据库分析发现,NCOA1基因上存在miR-148a-3P 的靶基因作用位点(见图7)。通过双荧光素酶报告实验进一步验证NCOA1是否为miR-148a-3p 的真正靶基因。将构建成功的WT-pGL3-NCOA13'-UTR 载 体、MUT-pGL3-NCOA13'-UTR 载体,分别与miRNA-148a-3p mimics或对照质粒共转染海马神经元细胞,48 h 后检测荧光素酶活性。实验结果显示,对照组、miR-148a-3p mimics 组、共转染组的萤火虫荧光素酶活性分别为(0.96±0.01)、(0.13±0.00)、(0.98±0.10),经方差分析,差异有统计学意义(F=224.899,P=0.000)。与对照组比较,miR-148a-3p mimics 组和共转染组的荧光素酶活性受到抑制(P<0.05),而miR-148a-3p mimics 组与共转染组比较,差异无统计学意义(P>0.05)。实验结果表明,miR-148a-3p 与NCOA1的靶位点共同存在时,才能抑制荧光素酶基因表达,将靶位点部分碱基突变后,则不能发挥抑制作用。实验表明NCOA1是miR-148a-3p 作用的靶基因,下一步可进行其功能机制的研究。

图5 miR-148a-3p预测靶基因的GO功能和Pathway分析

图6 miR-148a-3p 靶基因蛋白网络结构图

图7 TargetScan数据库预测靶基因位点示意图
3 讨论
热性惊厥在0~5 岁幼儿和儿童中常见,多种因素可能会增加热性惊厥风险[10]。不同种类的miRNA 在大脑中表达,并在惊厥及癫痫等神经疾病中发挥关键作用。其中miR-148a-3p 参与免疫系统的发育和动态平衡,且参与多种类型的癌症、自身免疫性疾病、炎症疾病及其他病理过程。鉴于以上原因,本研究利用miRNA 表达谱基因芯片技术,探讨miRNA 在热性惊厥中的作用机制,以期更好地研究热性惊厥的病理机制。
本研究首先复制热性惊厥大鼠模型,利用miRNA 表达谱基因芯片技术对惊厥和健康大鼠海马组织miRNA 表达进行深入分析。根据分级聚类分析的结果,6 组实验样本被分成2 个不同集群,由此可推断出实验样本分类是可靠的,与预期结果相符。经过信息分析,获得31个差异表达miRNA 及相关的功能信息。21 个miRNA 显著上调,包括miR-542-5p、miR-499-5p、miR-148a-3p、miR-451-5p。11个miRNA显著下调,其中以miR-207、miR-130b-3p下调最为显著。这些差异表达miRNA 是否参与热性惊厥的发生、发展过程需要进一步研究。同时,为验证基因芯片数据的可靠性,选取10 个差异表达miRNA,利用qRT-PCR 进行验证,结果与芯片结果相符,为后续表达谱基因芯片的分析提供可靠的基础。
随后,经过信息综合分析发现miR-148a-3p 在海马组织的表达水平升高,与qRT-PCR 结果一致,因此选取miR-148a-3p 进行深入研究和分析。差异表达miR-148a-3p 的功能与神经免疫、细胞凋亡都有密切联系。最新研究表明,在缺血性脑卒中疾病中,miR-148a-3p 可以与lncRNA-h19和ROCK2基因形成作用路径,进而调节由于缺血性脑卒中造成的氧化应激[14]。另外,miR-148a-3p 可以靶向KLF6基因,调节骨骼肌细胞的增殖和凋亡[15]。miR-148a 作为miR-148a-3p 的前体,与其有着同样的活性,并且可以调控多种神经系统发育相关的蛋白因子。在帕金森和阿尔茨海默病等神经系统疾病中,miR-148a 的表达存在显著异常。生物信息分析筛选获得的其他差异表达的miRNA 也值得去研究,其功能都与神经免疫等因素有紧密的联系。研究表明,在缺血缺氧性脑病中,miR-499-5p可以通过调节C 反应蛋白的表达水平发挥神经保护作用[16]。miR-207 可能参与了OSA 诱导的认知障碍。另外,miR-130b-3p 可以抑制eCIRP 诱导的炎症反应[17]。
笔者通过TargetScan 和miRDB 数据库预测miR-148a-3p 的靶基因,获得交集靶基因186 个。利用相关数据库信息构建靶基因关系图。在网络关系图中发现KLF6基因被证实是miR-148a-3p 的靶基因,并且可以促进神经元的轴突再生[18]。同时,在预测的靶基因中,发现多个靶基因与神经免疫功能密切相关。例如,NCOA1、NOG、NPTN等。NCOA1又名SRC-1,可以影响大鼠海马突触可塑性和空间学习记忆能力,并且可以影响下丘脑神经元的功能。随后笔者通过双荧光素酶报告实验验证NCOA1是miR-148a-3p 调节的靶基因。另有研究发现,基因NOG拮抗剂可以恢复海马神经干细胞的数量和神经生成,同时可以促进髓鞘的修复[19]。Neuronplastin(NPTN)作为一种多功能的神经元黏附分子,与长时程的突触可塑性密切相关[20]。
选取miR-148a-3p 的186 个候选靶基因进行GO功能和Pathway 分析。分析结果提示热性惊厥与神经免疫炎症关系密切,为研究免疫炎症在热性惊厥中的作用提供了重要线索。例如,显著GO 功能包括神经元分化、大脑发育、突触发生等。在差异显著Pathway 中,FoxO信号通路存在显著差异。在癫痫状态下,通过激活FoxO信号通路可引起惊厥诱导的神经元的死亡[21]。同时,FoxO信号通路家族可以参与多种病理条件下的细胞死亡[22]。FoxO1和FoxO2在免疫细胞的发育、分化中起重要作用。FoxO1和FoxO3可以促进调节性T 细胞的形成,抑制Th1 和Th17 细胞的形成[23]。
最新研究表明,miRNA 与神经系统疾病中海马神经元的凋亡密切相关[24-25]。miR-223 表达上调可以抑制惊厥大鼠的海马神经元凋亡和大脑损伤[26]。miR-421 可以通过TLR 受体信号通路进而抑制癫痫大鼠的海马神经元凋亡[27]。沉默miR-134 可以减轻癫痫大鼠的海马神经元损伤及自发惊厥频率[28]。另有研究表明,miR-148a-3p 与细胞凋亡关系密切。miR-148a-3p 与DNMT1 形成调控路径,促进肿瘤的增生[29]。另有研究表明,在急性胰腺炎疾病中,miR-148a-3p 可以通过靶向PTEN 来抑制细胞坏死[30]。上调miR-210-3p 可以抑制缺氧诱导的海马神经元凋亡[31]。miR-34a 抑制剂可以通过Wnt信号通路调节海马神经元细胞凋亡[32]。在前面的研究中,课题组采用miRNA 表达谱芯片及qRT-PCR证实大鼠发育期反复惊厥后海马miR-148a-3p 显著上调,提示miR-148a-3p 可能参与惊厥的发生、发展。其可能通过分析结果中预测的某个靶基因或者信号通路参与惊厥的发生、发展过程。
综上所述,本研究通过对反复惊厥大鼠海马miRNA 表达谱基因芯片进行分析,获得一系列的差异表达miRNA 和候选预测靶基因的GO 及Pathway等相关信息。这些丰富的数据对于后期研究热性惊厥的发病机制起重要的提示作用,为发现新的热性惊厥临床分子靶标提供有利的证据。
