电针治疗对完全性骶上脊髓损伤后神经源性膀胱大鼠尿流动力学和脊髓组织中CyclinD1、Ngn1的影响*
2021-03-26邓悦宁周达岸王卓马贤德
邓悦宁,周达岸,王卓,马贤德
(1.锦州医科大学附属第三医院,辽宁 锦州121000;2.辽宁中医药大学教学实验中心,辽宁 沈阳110847)
随着交通事故与高空坠落事件的逐年增多,以两者为主要发病原因的疾病——脊髓损伤(spinal cord injury, SCI)在全球的发病率由1995年的10.4~83.0/100 万[1]增 长 到2018年 的87.2~136.9/100 万[2],其损伤严重程度以美国脊髓损伤协会(ASIA)标准分级为A 级居多,即完全性SCI。完全性SCI 中约80%以上的患者为完全性骶上脊髓损伤(sacral spinal cord injury, SSCI),是临床中最常见的脊髓损伤节段[3]。并发各种程度的括约肌和反射功能障碍,损伤平面以下运动感觉功能完全丧失。完全性SSCI 后骶髓排尿中枢失去脑桥排尿中枢的抑制,逼尿肌无抑制反复收缩,形成神经源性膀胱(neurogenic bladder, NB)逼尿肌反射亢进,晚期形成肾衰竭危及生命。
电针治疗完全性SSCI 后NB 的临床疗效及安全性已得到高度的认可[4-5],其治疗的作用机制已成为研究热点。耿鑫[6]研究发现电针通过调控Notch 信号通路能够促进内源性神经干细胞增殖,并抑制内源性神经干细胞向星形胶质细胞和少突胶质细胞分化。脊髓室管膜区和白质普遍存在内源性神经干细胞[7],其激活后可增殖、分化为神经细胞,修复神经功能[8-9]。
Wnt/β-catenin 信号通路在神经修复中发挥重要作用[10]。本课题的前期研究发现电针通过促进Wnt/β-catenin 信号通路中Wnt-1 和β-catenin 关键蛋白在脊髓组织中的表达来改善模型大鼠排尿功能[11]。基于前期的研究结果,本文继续探讨电针治疗完全性SSCI 后NB 大鼠的作用机制。
1 材料与方法
1.1 实验动物与分组
SD雌性大鼠60只,6~8周龄,体重(210±10)g,购自辽宁长生生物技术有限公司,实验动物生产许可证号:SCXK(辽)2016-0001,实验动物使用许可证号:SYXK(辽)2019-0004。大鼠随机分为假手术组12 只,模型组48 只。在室温23℃、湿度50%、通风良好的环境下饲养7 d,鼠笼垫料更换1 次/2 d,食水自由。实验过程对大鼠的处置方式符合中华人民共和国科技部2006年发布《关于善待实验动物的指导性意见》。
1.2 主要仪器和试剂
电热恒温培养箱(天津泰斯特公司),Sanyo 超低温冰箱(日本Sanyo 公司),全自动脱水机、轮转式切片机、展片机、包埋机、烤片机(德国Leica 公司),VE-180 双垂直电泳槽、4200 SF 凝胶成像分析系统、ESP 300 电泳仪(上海天能科技有限公司),DM 2000 数码显微镜(德国徕卡公司),SHA-B 恒温振荡器(常州国华电器有限公司),WD-9405B 脱色摇床(北京市六一仪器厂),Bio-Rad 型PCR 仪(美国伯乐公司),BL-420 S 16 通道生物机能实验系统(成都泰盟科技有限公司),SDZ-Ⅲ电针治疗仪、华佗牌针灸针(苏州医疗用品厂有限公司)。水合氯醛(国药集团化学试剂沈阳有限公司),CyclinD1 抗体(Ab 16663)、Neurogenin 1 抗体(Ab 66498)、β-actin抗体(Ab 8227)(英国Abcam 公司),二抗、SP 试剂盒(北京中杉金桥生物技术有限公司),蛋白提取试剂盒(P0013)、蛋白定量试剂盒(P0010S)、SDSPAGE 凝胶试剂盒(P0012A)、蛋白marker(P0068)(上海碧云天生物技术有限公司),SP 试剂盒、DAB显色试剂盒(武汉博士德生物科技有限公司)。
1.3 模型复制方法
采取手术方式复制完全性SSCI 大鼠模型。1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,大鼠俯卧位固定于手术台,脊柱背侧胸椎下段备皮,碘伏消毒,解剖定位T10椎体,以T10棘突为中心沿背侧正中线切开皮肤,切口长约2 cm,然后向下逐层分离皮下组织,沿椎板钝性分离竖脊肌,暴露T9~T11棘突和椎板。手术刀切开T9、T10的棘间韧带,咬骨钳自T9、T10椎板间隙紧贴椎板平行脊髓进钳,轻轻咬除椎板,直至咬除整个T10椎板及两侧的关节突。咬骨过程中,注意保护脊髓硬脊膜、血管和神经根。用弯头眼科镊挑起脊髓,于脊髓上缘横向切断脊髓,反复切割脊髓3~5 次。此时可见大鼠双下肢抽搐,尾巴甩动并松弛,提示脊髓完全横断。用明胶海绵充分止血并填充内缩形成的空洞,逐层缝合。假手术组暴露T9~T11,并用咬骨钳去除T10棘突,然后逐层缝合。
1.4 模型评价
术后待大鼠完全清醒,采用BBB 评分评价各组大鼠脊髓横断情况[12]。评分由0~21 分组成,0 分为无可见双后肢运动,分数越高则大鼠后肢运动功能越好,21 分为持续状态的掌面移动、协调步态、足趾抓地、躯干稳定、尾巴翘起,活动过程中身体与主动爪位置始终处于平行状态。3人采用单盲法记录评价结果并整理分析。大鼠完全性SSCI 后双后肢呈拖动前行状态,无任何运动为0分,表明大鼠脊髓横断模型复制成功。术后大鼠正常饲养,模型组大鼠每日手法排尿,记录尿量。连续2 周后,大鼠排尿量稳定,测定假手术组和模型组大鼠的尿流动力学指标,评估完全性SSCI后NB 大鼠模型情况。
1.5 干预
模型复制后大鼠正常饲养至第2 周结束,将模型复制成功的大鼠再次随机分为模型对照组、电针组、电针对照组,每组12 只。
4 组大鼠干预因素如下:假手术组不作处理,正常饲养7 d。模型对照组,再次分组后不作处理,正常饲养7 d。电针组以0.3 mm×25.0 mm 毫针直刺,连接电针仪,正极连接大椎穴,负极连接次髎穴,电针仪参数设定为疏密波,10/50 Hz(疏波10 Hz/9 s,密波50 Hz/5 s),留针20 min,强度以针刺处出现规律性收缩抽动为宜,1 次/d,连续7 d;参照文献准确定位[13-14],大椎穴:背部正中第7 颈椎和第1 胸椎间,直刺5 mm。次髎穴:第2、3 骶骨的棘突间隙正中偏上旁开5~10 mm(左右隔日交替进行),直刺5~12 mm。电针对照组的针刺点分别选取以大椎穴、次髎穴为中心旁开10 mm 处(远脊柱侧)[15],针刺,电针仪参数同上,留针20 min,1 次/d,连续1 周。
1.6 尿流动力学检测
末次电针干预完成后1 h,各组大鼠以1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,麻醉后手法按压大鼠下腹部进行辅助排尿,排空膀胱后将大鼠仰卧位固定在手术台上,导管经三通管连接测压通道及微量灌注泵,排空管腔气体,导管润滑后经尿道插入大鼠膀胱并固定,此时压力值为膀胱基础压力,随后以7.5 ml/h 的速度进行温生理盐水灌注,观察随膀胱灌注量的增加大鼠膀胱压力的变化。尿道口有液体流出时,即为膀胱漏尿点压力和膀胱最大容量。漏尿后继续灌注至逼尿肌压力稳定,取压力峰值为膀胱最大压力,计算得出膀胱顺应性。
1.7 CyclinD1、Ngn1 mRNA和蛋白检测
尿流动力学检测完成后,颈椎脱位处死大鼠,于脊髓横断处,向下截取脊髓残端5~10 mm,分置2 份于1.5 ml 冻存管中,置入-80℃冰箱冷冻保存,一份用于RT-PCR 检测CyclinD1 和Ngn1 mRNA 表达,另一份用于Western blotting 法检测CyclinD1 和Ngn1蛋白表达。向上截取脊髓残端5~10 mm,浸泡于4%多聚甲醛溶液中,常温固定24 h 以上,用于免疫组织化学法检测CyclinD1、Ngn1的表达。
1.7.1 RT-PCR 检测各组大鼠脊髓组织中CyclinD1、Ngn1 mRNA 表达Trizol 裂解法提取脊髓组织中总RNA,采用逆转录试剂盒,将RNA 逆转录为cDNA,然后再以CyclinD1、Ngn1 扩增引物(见表1)为模板,进行PCR 扩增,扩增产物在琼脂糖凝胶中进行水平电泳,凝胶成像分析系统中采集电泳图像,并测定目的基因和内参基因扩增产物条带的积分光密度值,以大鼠脊髓组织中CyclinD1 和Ngn1 条带与βactin 条带灰度值的比值表示mRNA 相对表达量。

表1 引物序列
1.7.2 Western blotting 检测脊髓组织中CyclinD1、Ngn1蛋白表达常规提取脊髓组织中总蛋白,进行蛋白定量,加入5×上样缓冲液,沸水浴中变性5 min,按照50 μg/孔的蛋白总量进行垂直电泳,电泳完成后,采用湿转法将凝胶中蛋白转印至PVDF 膜,取出PVDF 膜,TBST 缓冲液冲洗,5%BSA 封闭液中封闭1 h,浸泡于一抗(1∶500)中,4℃孵育过夜,次日洗膜,浸泡于二抗(1∶2 000)中,室温摇床上震荡孵育2 h,洗膜,将PVDF膜放入凝胶成像分析系统中,滴加ECL 发光液,采集条带照片,以β-actin 为内参,以目的蛋白条带灰度值与内参条带灰度值的比值作为该目的蛋白的相对表达量。
1.7.3 免疫组织化学法检测脊髓组织中CyclinD1、Ngn1 蛋白表达常规制备石蜡切片,切片厚度为5 μm,二甲苯及梯度乙醇脱蜡至水,浸入柠檬酸盐缓冲液中,沸水浴中加热20 min 进行抗原修复。滴加3%H2O2去除内源性过氧化物酶。滴加5%BSA 封闭液,封闭15 min,分别滴加CyclinD1 抗体和Ngn1抗体工作液,稀释度为1∶300,4℃孵育过夜。次日洗片后滴加二抗工作液,37℃恒温水浴锅中孵育1 h,洗片后滴加DAB 显色液,显色3~10 min,需实时观察切片染色情况,自来水下冲洗,终止染色。苏木精复染后1%盐酸乙醇分化,中性树胶封片,数码显微镜下观察切片。选取染色良好区域,每张切片拍摄5 张照片,测定每个视野的平均光密度值,5 张照片的平均值作为该目的蛋白的相对量。
1.8 统计学方法
数据分析采用SPSS 23.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验或方差分析,两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况观察
术前所有实验大鼠食水、活动正常,自主排尿。术后假手术组大鼠常规护理,较术前差异不大。模型组大鼠1~2 h 麻醉苏醒,双后肢无任何运动,食水量下降,出现自啮、血尿、腹胀、肠梗阻等情况,均予以对症处理。至模型复制成功前共剔除12 只大鼠(术后BBB 评分> 0 分4 只,自啮1 只,血尿1 只,腹胀1 只,肠梗阻2 只,第15 天仍存在尿潴留3 只)。
2.2 模型评价
2.2.1 BBB 评分假手术组大鼠的BBB 评分为(21.000±0.000)分,无行动功能障碍,模型复制后模型组大鼠的BBB 评分为(0.080±0.279)分,行动功能下降。假手术组和模型组大鼠BBB 评分比较,差异有统计学意义(t=257.755,P=0.000)。
2.2.2 尿流动力学的变化术后第15 天,假手术组和模型组大鼠的膀胱基础压力、膀胱最大压力、膀胱漏尿点压力、膀胱最大容量及膀胱顺应性比较,差异有统计学意义(P<0.05),模型组大鼠膀胱基础压力、膀胱最大压力及膀胱漏尿点压力升高,膀胱最大容量和膀胱顺应性降低。见表2。
表2 两组大鼠尿流动力学结果比较 (±s)

表2 两组大鼠尿流动力学结果比较 (±s)
组别n 膀胱基础压力/cmH2O 膀胱最大压力/cmH2O 膀胱漏尿点压力/cmH2O 膀胱最大容量/ml 膀胱顺应性/(ml/cmH2O)假手术组模型组t 值P 值12 48 19.800±1.914 36.902±2.144-24.535 0.000 38.050±2.681 60.345±2.865-23.701 0.000 37.325±2.897 53.818±2.636-18.320 0.000 5.100±1.421 0.702±0.165 18.597 0.000 0.292±0.119 0.030±0.007 13.435 0.000
2.3 电针干预后尿流动力学的变化
电针干预后4 组大鼠膀胱基础压力、膀胱最大压力、膀胱漏尿点压力、膀胱最大容量、膀胱顺应性比较,差异有统计学意义(P<0.05)。进一步两两比较,与假手术组比较,其余3 组大鼠膀胱基础压力和膀胱最大压力升高(P<0.05),膀胱最大容量和膀胱顺应性降低(P<0.05),模型对照组和电针对照组膀胱漏尿点压力升高(P<0.05),电针组膀胱漏尿点压力差异无统计学意义(P>0.05);与模型对照组比较,电针组大鼠膀胱基础压力、膀胱最大压力和膀胱漏尿点压力降低(P<0.05),膀胱最大容量和膀胱顺应性升高(P<0.05);模型对照组与电针对照组比较,尿流动力学检测结果无统计学意义(P>0.05);与电针组比较,电针对照组大鼠膀胱基础压力、膀胱最大压力和膀胱漏尿点压力升高(P<0.05),膀胱最大容量和膀胱顺应性降低(P<0.05)。见表3。

表3 4组大鼠电针干预后尿流动力学结果比较 (n=12,-x± s)
2.4 4组大鼠脊髓组织中CyclinD1和Ngn1 mRNA表达比较
4 组大鼠脊髓组织中CyclinD1 和Ngn1 mRNA 表达比较,差异有统计学意义(P<0.05)。进一步两两比较,与假手术组比较,其余3组CyclinD1 mRNA表达升高(P<0.05),Ngn1 mRNA表达降低(P<0.05);与模型对照组比较,电针组CyclinD1 和Ngn1 mRNA表达升高(P<0.05);模型对照组与电针对照组CyclinD1 和Ngn1 mRNA 表达比较,差异无统计学意义(P>0.05);与电针组比较,电针对照组CyclinD1和Ngn1 mRNA表达降低(P<0.05)。见表4和图1。

表4 4组大鼠脊髓组织中Cyclin D1和Ngn1 mRNA表达比较 (n=12,-x± s)

图1 4组大鼠脊髓组织中CyclinD1和Ngn1 mRNA表达
2.5 4组大鼠脊髓组织中CyclinD1和Ngn1蛋白表达比较
4 组大鼠脊髓组织中CyclinD1 和Ngn1 蛋白表达比较,差异有统计学意义(P<0.05)。进一步两两比较,与假手术组比较,其余3组CyclinD1蛋白表达升高(P<0.05),模型对照组和电针对照组Ngn1蛋白表达降低(P<0.05),电针组Ngn1蛋白表达差异无统计学意义(P>0.05);与模型对照组比较,电针组CyclinD1和Ngn1蛋白表达升高(P<0.05),电针对照组CyclinD1和Ngn1蛋白表达差异无统计学意义(P>0.05)。与电针组比较,电针对照组CyclinD1 和Ngn1蛋白表达降低(P<0.05)。见表5和图2。

表5 4组大鼠脊髓组织中CyclinD1和Ngn1蛋白表达比较(n=12,-x± s)
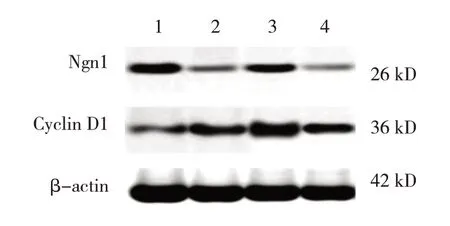
图2 4组大鼠脊髓组织中CyclinD1和Ngn1蛋白表达
2.6 4 组大鼠脊髓组织切片的CyclinD1 和Ngn1蛋白表达
4 组大鼠脊髓组织切片CyclinD1 和Ngn1 蛋白表达比较,差异有统计学意义(P<0.05)。进一步两两比较,与假手术组比较,其余3组CyclinD1蛋白表达升高(P<0.05),模型对照组和电针对照组Ngn1 蛋白表达降低(P<0.05),电针组Ngn1 蛋白表达差异无统计学意义(P>0.05);与模型对照组比较,电针组CyclinD1 和Ngn1蛋白表达升高(P<0.05),电针对照组CyclinD1 和Ngn1 蛋白表达差异无统计学意义(P>0.05);与电针组比较,电针对照组CyclinD1 和Ngn1蛋白表达降低(P<0.05)。见表6和图3、4。
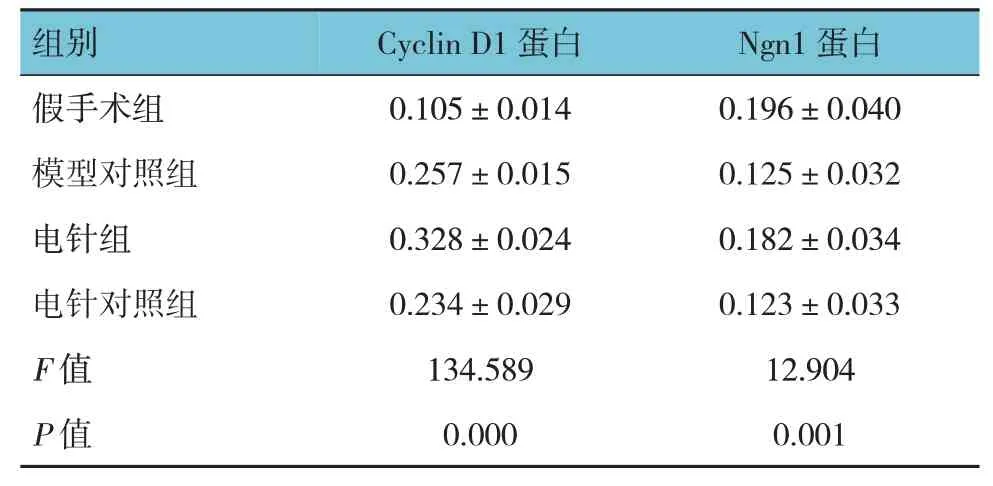
表6 4组大鼠脊髓组织切片的CyclinD1和Ngn1蛋白表达比较 (n=12,-x± s)

图3 4组大鼠脊髓组织切片中CyclinD1蛋白表达 (IHC×400)
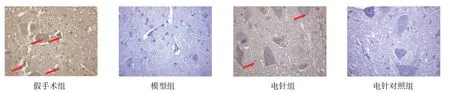
图4 4组大鼠脊髓组织切片中Ngn1蛋白表达 (IHC×400)
3 讨论
中国传统医学归纳完全性SSCI 后NB 的病机为:督脉不通、淤血凝滞[16]。督脉上始于脑,下止于骶,经脊里与五脏六腑气血经脉相表里。与西医脊髓生理解剖定位相一致。电针大椎穴和次髎穴为干预手段,在取穴上严格做到单一变量控制,在体内形成一条正负电流,达到通督补肾、恢复膀胱气化功能,改善临床症状。有研究证实[17],电针在促进内源性神经干细胞增殖分化中发挥着重要作用。
本研究复制完全性SSCI后NB大鼠模型,以BBB评分作为模型大鼠双下肢行为学评价的“金标准”,判断模型大鼠脊髓是否为完全损伤。与假手术组大鼠比较,模型组大鼠BBB 评分下降,证明模型组大鼠双后肢完全丧失运动功能,脊髓横断。术后大鼠正常饲养至第15 天,采用尿流动力学检测,形成“高压低顺应性”膀胱。在电针干预1周后再次采用尿流动力学检测,与模型对照组比较,电针组大鼠膀胱基础压力、膀胱最大压力和膀胱漏尿点压力下降,膀胱最大容量和膀胱顺应性升高;与电针组比较,电针对照组大鼠膀胱基础压力、膀胱最大压力和膀胱漏尿点压力升高,膀胱最大容量和膀胱顺应性下降。说明电针大椎穴和次髎穴可以有效调节完全性SSCI后NB大鼠的排尿功能。
SCI 后内源性神经干细胞出现短暂性增殖反应增强,Wnt/β-catenin 信号通路可调控内源性神经干细胞增殖和分化为功能性神经元[18]。电针大椎穴和次髎穴能够进一步激活Wnt/β-catenin 信号通路,上调Wnt-1、β-catenin mRNA及蛋白的表达[11]。Cyclin D1和Ngn1 是Wnt/β-catenin 信号通路下游靶基因[19]。CyclinD1 是细胞周期增殖信号的关键蛋白。罗时鹏等[20]研究表明,CyclinD1 与β-catenin 的表达呈正相关。本研究的前期研究发现[11],完全性SSCI 能够激活Wnt/β-catenin 信号通路,与假手术组比较,模型对照组β-catenin 的表达升高,与模型对照组比较,电针组β-catenin 的表达升高。本研究发现,与假手术组比较,其他3组大鼠CyclinD1 mRNA 及蛋白表达升高;与模型对照组比较,电针组大鼠CyclinD1 mRNA及蛋白表达升高;与电针组比较,电针对照组大鼠Cyclin D1 mRNA 及蛋白表达水平降低。Ngn1 在神经分化中起重要作用[21]。有研究表明[22],完全性SCI后假手术组与模型组均未检出Ngn1 mRNA 的表达。在SCI 后Ngn1 的表达与假手术组比较呈下降趋势[23]。张巧梅[24]的研究发现,Ngn1 能够短暂表达于神经增殖细胞,当神经增殖细胞分化为成熟的神经细胞类型后其表达消失。本研究结果发现,与假手术组比较,模型对照组大鼠Ngn1 mRNA 及蛋白表达降低;与模型对照组比较,电针组大鼠Ngn1 mRNA 及蛋白表达升高;与电针组比较,电针对照组大鼠Ngn1 mRNA及蛋白表达水平降低。说明电针干预能够增加Ngn1在模型大鼠脊髓组织中的表达,促进内源性神经干细胞进一步分化,恢复受损组织神经功能。大鼠脊髓组织中CyclinD1 和Ngn1 mRNA 及蛋白在电针组和电针对照组的表达比较差异有统计学意义,证明取穴准确,具有相对特异性。
综上所述,电针大椎穴、次髎穴对完全性SSCI后NB 大鼠尿流动力学具有明显改善作用,其作用机制之一是通过调控Wnt/β-catenin信号通路中CyclinD1和Ngn1 mRNA 及蛋白表达,促进脊髓内源性神经干细胞的增殖和活化而实现。在今后的研究中,应增加时间点的选择,以便研究观察指标的变化趋势,寻求最佳治疗周期。在确定最佳治疗周期的基础上,继续探讨治疗后有效性的持续时间,细化研究内容,精确指导临床应用;进一步完善Wnt信号通路中其他相关蛋白的检测,增加Wnt信号通路中关键蛋白抑制剂应用后的变化研究,继续探讨Wnt信号通路中相关因子变化与神经干细胞标志物Nestin表达的相关性。
